췌장 낭성 병변의 진단: 내시경 초음파의 임상적 유용성
Diagnosis of Pancreatic Cystic Neoplasms: Clinical Utility of Endoscopic Ultrasound
Article information
Trans Abstract
Pancreatic cystic neoplasms (PCNs) are being detected with increasing frequency due to advances in imaging technology. The challenge for clinicians is accurately differentiating benign lesions from those with malignant potential, which is a crucial step in appropriate patient management. While modern cross-sectional imaging modalities, such as computed tomography and magnetic resonance imaging, are essential for initial screening, they often do not have the specificity required for a definitive diagnosis. Endoscopic ultrasound (EUS) has emerged as an invaluable tool that provides high-resolution images of internal cystic structures. However, the major advantage of EUS is the ability to facilitate a suite of advanced diagnostic techniques. This review explores the current landscape of EUS-based modalities for evaluating PCNs, including cyst fluid analysis, contrast-enhanced EUS, through-the-needle biopsy, and advanced visualization methods, such as needle-based confocal laser endomicroscopy and cystoscopy. We focused on the advantages, diagnostic performance, and limitations of each technique to provide a practical overview for clinical application.
서 론
췌장 낭성 병변은 최근 영상 기술의 발달로 진료 현장에서 점점 더 빈번하게 발견되고 있다. 췌장 낭성 병변은 양성에서부터 악성에 이르기까지 다양한 스펙트럼을 가지므로 정확한 진단과 악성 위험 평가가 필수적이다. 대부분의 췌장 낭성 병변은 computed tomography (CT)나 magnetic resonance imaging (MRI)을 통한 단순 영상 검사로 종양의 종류를 어느 정도 구분할 수는 있으나 내시경 초음파(endoscopic ultrasound, EUS)는 선택적인 병변 부위에 대해서 더욱 우수한 해상도를 제공하며 중격(septa), 벽 비후(wall thickness) 그리고 벽 내 결절(mural nodules)과 같은 낭종의 내부 구조를 정교하게 확인할 수 있게 해주어 종양 진단에 많은 정보를 준다. 이처럼 EUS는 양성과 악성 낭종을 감별하는 데 있어 MRI나 CT와 유사하거나 보다 높은 정확도를 보이는 강력한 진단 도구이지만 EUS를 다른 고도화된 기술과 결합함으로써 진단 능력을 향상시킬 수 있다. 본고에서는 이러한 췌장 낭성 종양 진단을 위한 최신 EUS 기반 검사들을 심층적으로 다루며 그 실질적인 유용성, 진단 성능, 주요 한계점을 설명하고자 한다.
본 론
내시경 초음파-세침 흡인술(EUS-fine needle aspiration)
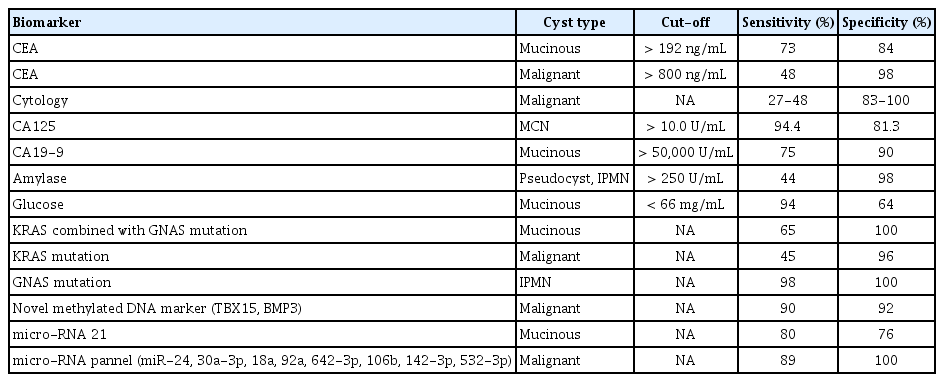
EUS-세침 흡인술(EUS-fine needle aspiration, EUS-FNA)을 통해 얻어진 낭종액(cyst fluid)은 양성 및 악성 췌장 낭성 병변(pancreatic cystic neoplasms, PCNs)의 감별을 위한 세포학적 분석(cytological analysis) 및 점액성(mucinous) 및 비점액성(non-mucinous) 병변을 구분하기 위한 종양표지자 분석(tumor biomarker analysis)에 사용된다(Table 1). 세포학적 분석은 악성 낭종을 식별하는 데 매우 특이적(83-100%)이지만 민감도(27-48%)는 매우 낮아 진단의 정확도(8-59%)가 비교적 낮다[1]. 이에 비해 낭종액의 종양표지자인 carcinoembryonic antigen (CEA)은 점액성 낭종과 비점액성 낭종을 감별하는 데 있어 기준치(threshold)를 192 ng/mL로 설정하였을 시 민감도 52-78%와 특이도 63-91%로 높은 정확도를 보여주었다[2]. CA19-9, CA724, CA125, CA153와 같은 다른 종양표지자들도 분석하였으나 CEA보다는 낮은 민감도를 보여 임상적 활용에는 제약이 있었다[3]. 낭종액의 아밀라제(amylase) 수치는 낭종이 췌관과 연결되어 있는지를 반영하는 지표로 활용되며 수치가 높은 경우 가성 낭종이나 일부 췌관 내 유두상 점액 종양(intraductal papillary mucinous neoplasm, IPMN)에서 흔히 관찰되는 반면 점액성 낭선종(mucinous cystic neoplasm)과 장액성 낭선종(serous cystadenoma)에서는 일반적으로 250 U/L 미만으로 측정된다[4]. 최근 연구들은 낭액 내 포도당 수치(glucose level)가 점액성 병변을 진단하는 데 있어 CEA 대체 가능성을 보여주었다. 66 mg/dL의 기준치를 사용하였을 때 낮은 포도당 수치는 점액성 낭종 진단에 있어 높은 민감도(94%)와 특이도(64%) 그리고 정확도 (84%)를 보였다[5].
최근에는 낭종액의 DNA, RNA, 단백질 그리고 대사체 마커를 이용한 분자 분석은 췌장 낭성 종양의 아형 및 악성의 진단 정확도를 상당히 높이는 유망한 방법으로 주목받고 있다. 특히 GNAS 또는 KRAS 돌연변이는 점액성 낭종 감별에 민감도 65%, 특이도 100%를 보였다[6]. TBX15 및 BMP3 와 같은 새로운 메틸화 DNA 표지자들이 민감도 90%와 특이도 92%로 악성 PCN 진단을 위한 잠재적 표지자로 확인되어 위험 평가에 있어 상당한 진전을 이루었다[7]. 또한 micro-RNA 21을 포함한 다양한 RNA 마커들이 저위험과 고위험 IPMN 구분에 활용될 수 있으며 액체 내 단백질(amylase isoenzymes, mucins, CEACAM, S100)를 이용하여 췌장 낭성의 점액성/장액성 및 악성/양성 평가에 정확한 정보(정확도 90-99%)를 얻을 수 있다[8]. 하지만 이러한 분자 분석들은 비용적인 제약이 따르며 현재 일부 시설에서 연구 목적으로만 가능하기에 아직까지는 현실적으로 도움은 주지는 못한다는 한계가 있다.
조영제 증강 내시경 초음파(contrast-enhanced harmonic EUS)
조영제 증강 EUS (contrast-enhanced harmonic EUS, CEEUS)는 초음파 조영제(sonazoid 또는 Sonoveu)를 주입함으로써 기존 EUS에서 보이던 영상 허상 또는 이물질(artifacts)을 배제할 수 있어 벽 내 결절(mural nodules)의 감지 및 조영 증가 등의 특성 확인이 가능하며 낭종벽과 중격 내 미세혈관 순환을 탁월한 선명도로 감지할 수 있다. 체계적 문헌 고찰 및 메타 분석에 따르면 CE-EUS로 확인된 벽 내 결절의 크기가 다른 인자들(증상, 피 검사, 낭종 크기, 주췌관 확장 정도 등)보다 IPMN의 악성화를 예측하는 매우 중요한 인자였다[9]. 특히 결절 크기 cut-off를 8 mm로 하였을 때 민감도100%, 특이도 86%로 악성도 평가에 높은 정확도를 보였다. 또다른 연구에 따르면 CE-EUS에서 췌장 낭성 종양의 조영증강 정도(hyper-, hypo-, iso-, non-enhancement)를 통하여 악성도 감별에 92% 이상의 정확도를 보여 CT/MRI/EUS보다 정확한 예측이 가능함을 보고하였다[10]. 이처럼 CE-EUS는 결절과 중격의 혈관성을 더 잘 평가하는 데 도움이 되기에 유럽 기반의 가이드라인과 같은 최신 지침에서는 의심되는 벽 내 결절 및 낭종 내 혈관성을 추가로 평가할 필요가 있는 경우 CE-EUS를 권장하고 있다[11].
내시경 초음파 기반 세침 현미 겸자 생검(EUS-guided through-the-needle microforceps biopsy)
세침 현미 겸자 생검(through-the-needle microforceps biopsy, TTNB)은 microforceps를 19G EUS-FNA 바늘을 통해 삽입하여 낭벽이나 격벽, 결절 부위의 조직을 직접 채취하는 방법이다. EUS-guided TTNB (EUS-TTNB)는 높은 기술적 성공률(98.2%)을 보였으며 기존의 낭액 세포 검사에 비해 진단률이 72.5%로 향상되고 점액성/비점액성 구분에서 88.6- 90.1%의 민감도와 94.0-94.7%의 특이도를 보인다[12]. 수술 병리학 결과와의 일치율도 82.3-93.0%로 높아 수술 전 병변 분류에 있어 신뢰성이 높다[13]. 특히 TTNB는 단순 낭액 세포 검사보다 이형성 등 병변의 등급 평가에서도 더 높은 일치율을 보인다. 다만 합병증 발생률이 최대 12.5%로 보고되어 있으며 주된 합병증으로는 낭종 내 출혈, 췌장염, 낭종 감염, 복통 등이 있고 드물게 중등도 이상의 중증 합병증 및 사망도 보고되었다[14]. EUS-TTNB는 실현 가능하고 높은 진단율을 보이지만 그 역할을 완전히 정립하고 안전성을 높이기 위해서는 더 많은 대규모 전향적 연구가 필요하다.
내시경 초음파 기반 세침 공초점 레이저 현미경 검사 (EUS-guided fine needle-based confocal laser endomicroscopy)
세침 공초점 레이저 현미경 검사(fine needle-based confocal laser endomicroscopy, nCLE)는 형광 물질(fluorescein)을 정맥 투여한 뒤 19G EUS-FNA 바늘을 통해 소형 프로브를 낭종 내로 삽입하여 낭벽의 상피 구조를 실시간 고배율로 관찰하는 기법이다. 점액성 낭종에서는 상피 띠 모양과 가지 모양 혈관 패턴, IPMN에서는 유두상 돌출과 유사한 패턴, 악성 췌장 낭성 종양에서는 종양세포의 어두운 군집(dark aggregates of neoplastic cells) 패턴이 관찰된다(Fig. 1) [15,16]. 최근 메타 분석에 따르면 nCLE의 진단 정확도는 83%, 민감도 85%, 특이도 90%로 보고되고 있으며 시술 안전성도 EUSFNA 대비 큰 차이가 없는 것으로 보고되었다. 하지만 아직까지 대규모의 전향적인 연구 결과가 부족하고 근거가 제한적이며 영상 해석은 주관적이기 때문에 판독자 간 차이가 발생할 수 있다. 또한 장기적으로는 불필요한 수술을 줄여 비용을 절감할 수 있지만 환자에게 부과되는 초기 재정적 부담이 큰 장벽이 될 수 있다.
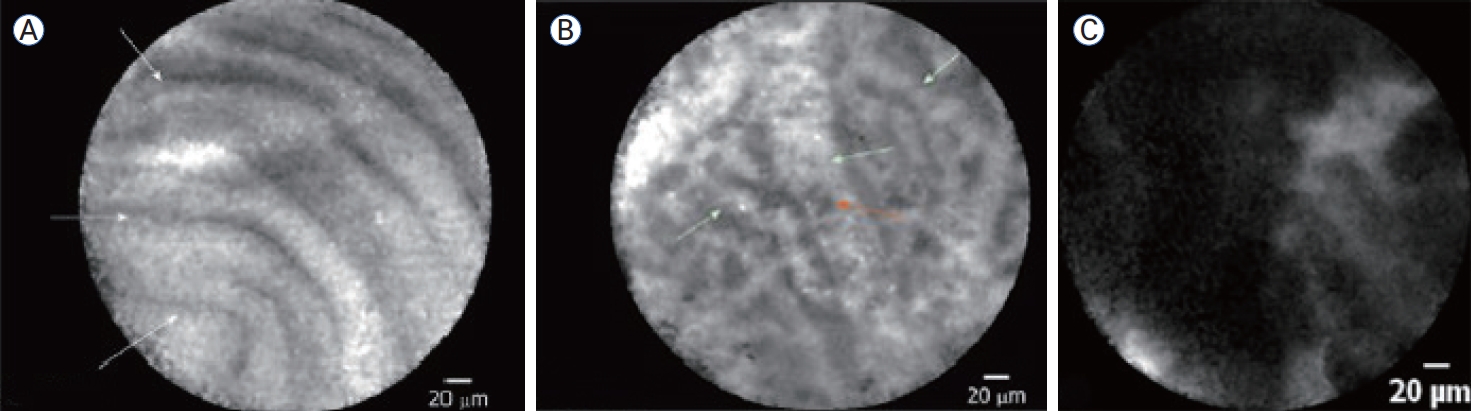
EUS-guided fine needle-based confocal laser endomicroscopy imaging. (A) Intraductal papillary mucinous neoplasm showing multiple papillary projections. (B) Serous cystadenoma exhibiting a superficial vascular network pattern. (C) Pancreatic adenocarcinoma displaying dark clusters of tumor cells [15,16]. EUS, endoscopic ultrasound.
초음파 내시경 기반 세침 낭종경 검사(EUS-guided through the needle cystoscopy)
기본적으로 nCLE와 원리는 비슷하지만 cystoscopy는 19G EUS-FNA 바늘을 통해 광섬유 내시경 (spyglass)을 삽입하여 낭종 내부벽과 내부 내용물을 직접 시각화하는 기법이다. 점액성 낭종은 흐린 액체와 매끄러운 벽, IPMN은 유두 모양 돌출과 점액 구름, 장액성 낭종은 나뭇가지 모양 혈관 패턴을 보인다[17]. 그러나 한 전향적 연구에 따르면 점액의 존재 여부는 진단에 유용하였으나(민감도 90%) 기타 다른 시각 소견들은 진단 신뢰도가 낮았다[18]. 또한 점도 높은 낭액으로 인하여 영상 품질이 저하되는 경우가 33%로 nCLE에서의 저하된 영상 품질의 비율(10%)보다 높아 면밀한 관찰에 제약이 발생하였다. 이에 cystoscopy 단독 사용보다는 국소 병변을 탐색한 후 nCLE로 표적화하는 보조 수단으로 활용하는 전략이 제시되고 있다.
결 론
췌장 낭성 병변은 영상 기술의 발전에 따라 발견 빈도가 지속적으로 증가하고 있으며 정확한 병변 진단과 악성 평가가 중요하다. 이에 따라 최근 발전을 보이고 있는 EUS를 이용한 다양한 첨단 기법을 살펴보았다. 이러한 발전에도 불구하고 실제 임상 현장에서 이용되기에는 비용 및 접근성에 있어서 많은 제한이 있으며 검사 결과에 대한 진단 표준이 아직 확립되지 않은 상태이다. 따라서 향후 추가적인 연구가 필요하나 췌장 낭성 병변의 평가에서 영상 검사와 EUS뿐만 아니라 CE-EUS, TTNB, nCLE, cystoscopy와 같은 첨단 기법을 통합 활용함으로써 진단 정확도와 환자 맞춤형 치료 전략을 향상시킬 수 있을 것으로 기대된다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
All work was performed by the corresponding author,Jung Wan Choe.
ACKNOWLEDGEMENTS
None.