 |
 |
| Korean J Med > Volume 100(2); 2025 > Article |
|
Abstract
Human epidermal growth factor receptor-2 (HER2)-positive breast cancer accounts for approximately 20% of all breast cancer cases. The advent of therapies targeting HER2 has significantly improved the prognosis for HER2-positive breast cancer. Neoadjuvant/adjuvant chemotherapy with HER2-targeted agents is recommended for early and locally advanced breast cancer. The appropriate use of novel HER2-targeted therapies is recommended for metastatic breast. We aimed to examine the diagnosis and personalized treatment for HER2-positive breast cancer.
ņ”ØļĪĆ 1: 57ņäĖ ņŚ¼ņ×ÉĻ░Ć ņÖ╝ņ¬Į Ļ░ĆņŖ┤ņØś ļŹ®ņØ┤ļĪ£ Ļ▓Ćņé¼ļź╝ ņ£äĒĢśņŚ¼ ļ│æņøÉņŚÉ ņÖöļŗż. 1Ļ░£ņøö ņĀäļČĆĒä░ Ļ░ĆņŖ┤ņØś ļŹ®ņØ┤ļź╝ ļŖÉĻ╝łĻ│Ā ņĀÉņ░© ņ╗żņ¦ĆļŖö ņ¢æņāüņ£╝ļĪ£ ņŗĀņ▓┤ Ļ▓Ćņé¼ņŚÉņä£ ņÖ╝ņ¬Į ņ£Āļ░® ņĀäņ▓┤Ļ░Ć ļČēĻ▓ī ļ░£ņĀüņØ┤ ļÉśĻ│Ā ļö▒ļö▒ĒĢśĻ▓ī ļ¦īņĀĖņĪīņ£╝ļ®░ ņÖ╝ņ¬Į ļ¬®ņØś ļ”╝ĒöäņĀłņØ┤ ņ┤ēņ¦äļÉśņŚłļŗż. ņ┤łņØīĒīī ņ£ĀļÅäĒĢś ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ĒØēļČĆ computed tomography (CT)ņÖĆ ļ│ĄļČĆCT, 18F-fluorodeoxyglucose (18FDG) positron emission tomography-CT (PET-CT)ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņ£Āļ░® ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ ņ╣©ņ£żņä▒ ņ£ĀĻ┤ĆņĢö(invasive ductal carcinoma)ņØ┤ ņ¦äļŗ©ļÉśņŚłĻ│Ā ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉņłśņÜ®ņ▓┤(estrogen receptor, ER) ņØīņä▒, ĒöäļĪ£Ļ▓īņŖżĒģīļĪĀņłśņÜ®ņ▓┤(progesterone receptor, PR) ņ¢æņä▒, human epidermal growth factor receptor-2 (HER2) strong positive (3), Ki-67 40% ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. ĒØēļČĆCT Ļ▓Ćņé¼ņŚÉņä£ ņÖ╝ņ¬ĮņØś Ļ▒░ļīĆĒĢ£ ņ£Āļ░® ļŹ®ņØ┤ņÖĆ ņÖ╝ņ¬Į ņćäĻ│©ņ£äļ”╝ĒöäņĀłĻ│╝ Ļ▓©ļō£ļ×æļ”╝ĒöäņĀłņØś ļ╣äļīĆļź╝ ļ│┤ņśĆļŗż(Fig. 1A). 18FDG PET-CT Ļ▓Ćņé¼ņŚÉņä£ļŖö ņóģĻ▓®ļ”╝ĒöäņĀłĻ│╝ ņÖ╝ņ¬Į ļé┤ņ£Āļ”╝ĒöäņĀłņØ┤ ļŹö ĒÖĢņØĖļÉśņŚłļŗż(Fig. 1B). HER2 ņ¢æņä▒ ņ£Āļ░®ņĢöņ£╝ļĪ£ ņ¦äļŗ©ĒĢśĻ│Ā T4N3M0, ļ│æĻĖ░ 3ĻĖ░ļĪ£ ĻĄŁņåī ņ¦äĒ¢ēņä▒ ņ£Āļ░®ņĢöņ£╝ļĪ£ ņ¦äļŗ©ĒĢśņśĆļŗż. ņłśņłĀ ņĀä ĒĢŁņĢö ĒÖöĒĢÖ ņÜöļ▓Ģņ£╝ļĪ£ docetaxel + carboplatin + trastuzumab + pertuzumab ņÜöļ▓ĢņØä 6ĒÜī ņŗ£Ē¢ēĒĢ£ Ēøä ņÖ╝ņ¬Į ņ£Āļ░® ņĀäņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņłśņłĀ ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ ņ£Āļ░®Ļ│╝ ļ”╝ĒöäņĀłņŚÉ ņ×öņĪ┤ņĢöņØ┤ ņŚåļŖö ļ│æļ”¼ĒĢÖņĀü ņÖäņĀä Ļ┤ĆĒĢ┤ļź╝ ļ│┤ņśĆļŗż. ņłśņłĀ Ēøä ļ│┤ņĪ░ ņÜöļ▓Ģņ£╝ļĪ£ trastuzumab + pertuzumabņØä 12ĒÜī ņŗ£Ē¢ēĒĢśņŚ¼ 1ļģäĻ░äņØś HER2 ņÜöļ▓ĢņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ļ│┤ņĪ░ ļ░®ņé¼ņäĀ ņ╣śļŻīņÖĆ ļ│┤ņĪ░ ĒśĖļź┤ļ¬¼ ņÜöļ▓ĢņØä ļ│æĒ¢ēĒĢśņśĆļŗż.
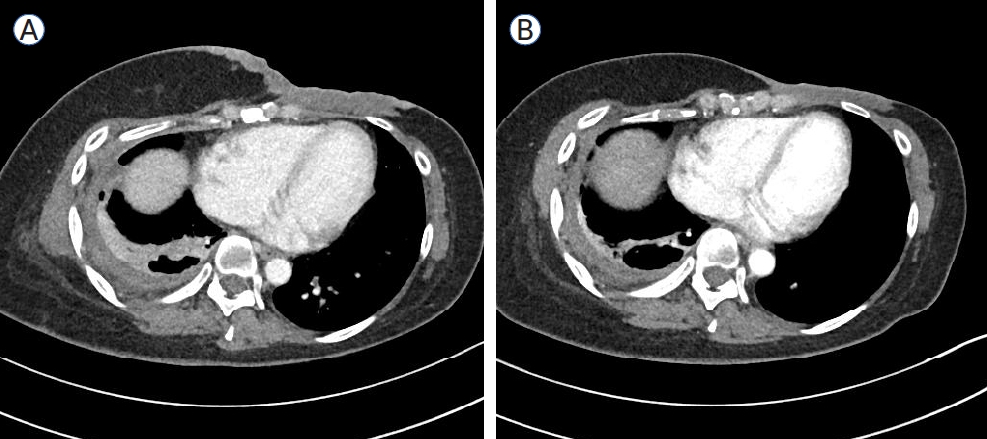
ņ”ØļĪĆ 2: 43ņäĖ ņŚ¼ņ×ÉĻ░Ć 1Ļ░£ņøö ņĀäļČĆĒä░ ņŗ£ņ×æļÉśļŖö ĒśĖĒØĪ Ļ│żļ×Ćņ£╝ļĪ£ ņØæĻĖēņŗżņŚÉ ņÖöļŗż. ĒØēļČĆ ņŚæņŖżņäĀ Ļ▓Ćņé¼ņŚÉņä£ ņśżļźĖņ¬Į ĒØēņłśļĪ£ ņØĖĒĢśņŚ¼ ņóģĻ▓®ņØ┤ ņÖ╝ņ¬Įņ£╝ļĪ£ ļ░Ćļ”¼ļŖö ņåīĻ▓¼ņØ┤ ļ│┤ņśĆĻ│Ā(Fig. 2A) ņŗĀņ▓┤ Ļ▓Ćņé¼ņŚÉņä£ ņÖ╝ņ¬Į Ļ░ĆņŖ┤ ļČĆņ£äņØś ņŚ╝ņ”Øņä▒ ļ│æļ│ĆņØ┤ ĒÖĢņØĖļÉśņŚłļŗż. Ļ│╝Ļ▒░ļĀźņŚÉņä£ 8ļģä ņĀä ņÖ╝ņ¬Į ņ£Āļ░®ņĢöņ£╝ļĪ£ ļČĆļČä ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ļ│┤ņĪ░ ĒśĖļź┤ļ¬¼ ņ╣śļŻīļ¦ī ņŗ£Ē¢ēĒĢśņśĆļŗż. ņśżļźĖņ¬Į ĒØēņłś ļ░░ņĢĪ ņØ┤Ēøä ĒØēļČĆCTņÖĆ ļ│ĄļČĆCT, ļ╝ł ņŖżņ║öņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ņ¢æņĖĪ ņ£Āļ░®ņĢö ļŹ®ņØ┤ņÖĆ ļŗżļ░£ Ļ░ä ņĀäņØ┤, ļŗżļ░£ ļ╝ł ņĀäņØ┤Ļ░Ć ĒÖĢņØĖļÉśņŚłļŗż(Fig. 2B, C). ņ┤łņØīĒīī ņ£ĀļÅäĒĢś ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ ņ╣©ņ£żņä▒ ņ£ĀĻ┤ĆņĢöņØ┤ ņ¦äļŗ©ļÉśņŚłĻ│Ā ER ņ¢æņä▒, PR ņ¢æņä▒, HER2 weak positive (2), Ki-67 40% ņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļ®░ HER2 ņĀ£ņ×Éļ”¼ļČĆĒĢ®ļ▓Ģ(in situ hybridization, ISH) Ļ▓Ćņé¼ņŚÉņä£ ņ¢æņä▒ņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. HER2 ņ¢æņä▒ņØś ņ×¼ļ░£ņä▒ ņĀäņØ┤ņä▒ ņ£Āļ░®ņĢöņ£╝ļĪ£ ņ¦äļŗ©ĒĢśņśĆĻ│Ā 1ņ░© ņ╣śļŻīļĪ£ docetaxel + trastuzumab + pertuzumabņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļČĆļČä ļ░śņØæņØä ņ£Āņ¦ĆĒĢśņŚ¼ 18ņ░©Ļ╣īņ¦Ć 1ļģäņØś ņ╣śļŻīļź╝ ņ£Āņ¦ĆĒĢśļŗżĻ░Ć ņČöņĀü CTņŚÉņä£ ņ£Āļ░® ļČĆņ£äņÖĆ ņśżļźĖņ¬Į ĒØēļ¦ē ņĀäņØ┤, Ļ░ä ņĀäņØ┤Ļ░Ć ņĢģĒÖöļÉśņŚłĻ│Ā(Fig. 3A). 2ņ░© ņ╣śļŻīļĪ£ trastuzumab deruxtecanņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņ╣śļŻī Ēøä ņČöņĀü CTņŚÉņä£ ļČĆļČä ļ░śņØæņØä ļ│┤ņŚ¼ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ╣śļŻī ņżæņØ┤ļŗż(Fig. 3B).
ņ£Āļ░®ņĢöņØĆ ņÜ░ļ”¼ļéśļØ╝ ņŚ¼ņä▒ņŚÉņä£ Ļ░Ćņן ĒØöĒĢ£ ņĢöņ£╝ļĪ£ 2021ļģä ĻĄŁļé┤ ĒåĄĻ│äņŚÉ ņØśĒĢśļ®┤ 10ļ¦ī ļ¬ģļŗ╣ 111ļ¬ģņŚÉņä£ ļ░£ņāØĒĢśĻ│Ā ļ░£ņāØļźĀņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ”ØĻ░Ć ņČöņäĖļź╝ ļ│┤ņØ┤ļŖö ņĢöņóģņØ┤ļŗż[1]. ņ£Āļ░®ņĢöņØĆ ņóģņ¢æņØś ļČäņ×ÉņāØļ¼╝ĒĢÖņĀü ĒŖ╣ņä▒ņŚÉ ļö░ļØ╝ ļäż Ļ░Ćņ¦Ć ņĢäĒśĢ(subtype)ņ£╝ļĪ£ ĻĄ¼ļČäļÉśļ®░ Ļ░ü ņĢäĒśĢņŚÉ ļö░ļØ╝ Ēæ£ņĀüņ£╝ļĪ£ ĒĢśļŖö ņ╣śļŻīņÖĆ ņśłĒøäņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳ļŗż[2]. HER2ļŖö ņŚ╝ņāēņ▓┤ 17q21ņŚÉ ņ£äņ╣śĒĢ£ c-erb-B2ņ£ĀņĀäņ×ÉņŚÉ ņØśĒĢśņŚ¼ ņĢöĒśĖĒÖöļÉśļŖö 185 KdņØś ņäĖĒżļ¦ēņŚÉ ņ£äņ╣śĒĢ£ Ēæ£ļ®┤ ļŗ©ļ░▒ņ£╝ļĪ£ HER2ņ£ĀņĀäņ×ÉņØś ņ”ØĒÅŁ ļśÉļŖö ļŗ©ļ░▒ņ¦łņØś Ļ│╝ļ░£ĒśäņØ┤ ļ░£Ļ▓¼ļÉśļ®┤ HER2 ņ¢æņä▒ ņ£Āļ░®ņĢöņ£╝ļĪ£ ļČäļźśĒĢ£ļŗż. HER2 ņ¢æņä▒ ņ£Āļ░®ņĢöņØĆ ņĀäņ▓┤ ņ£Āļ░®ņĢöņØś ņĢĮ 20%ņØś ļ╣łļÅäļź╝ ļ│┤ņØ┤Ļ│Ā HER2ļź╝ Ēæ£ņĀüņ£╝ļĪ£ ĒĢśļŖö ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņśłĒøäĻ░Ć ļ¦ÄņØ┤ Ē¢źņāüļÉśņŚłļŗż[3].
ļ©╝ņĀĆ ņ£Āļ░®ņĢöņŚÉ ļīĆĒĢ£ ņ¦äļŗ©ņØä ņ£äĒĢśņŚ¼ ņ£Āļ░® ļŹ®ņØ┤ņŚÉ ļīĆĒĢ£ ņ┤łņØīĒīī ņ£ĀļÅäĒĢś ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ļŗż. ņĀłņĀ£ļÉ£ ņ£Āļ░®ņĢö ņĪ░ņ¦üņŚÉ ļīĆĒĢ£ ļ│æļ”¼ĒĢÖņĀü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņ╣©ņ£żņä▒ ņ£ĀĻ┤ĆņĢö(invasive ductal carcinoma)Ļ│╝ ņ╣©ņ£żņä▒ ņåīņŚĮņĢö(invasive lobular carcinoma)ņØä ņ¦äļŗ©ĒĢ£ļŗż. ņ£Āļ░®ņĢöņŚÉņä£ ĒÖĢņØĖĒĢśņŚ¼ņĢ╝ ĒĢĀ ĒĢäņłśņĀüņØĖ ļČäņ×ÉņāØļ¼╝ĒĢÖņĀü Ēæ£ņ¦Ćņ×ÉļĪ£ ER, PRņØä ĒżĒĢ©ĒĢ£ ĒśĖļź┤ļ¬¼ņłśņÜ®ņ▓┤, HER2, Ki-67ņØ┤ ņ׳Ļ│Ā ņØ┤ļź╝ ļ░öĒāĢņ£╝ļĪ£ ņ£Āļ░®ņĢöņØś ņĢäĒśĢņØä Ļ▓░ņĀĢĒĢ£ļŗż.
HER2 ņāüĒā£ļŖö ļ®┤ņŚŁņĪ░ņ¦üĒÖöĒĢÖņŚ╝ņāē(immunohistochemical staining, IHC)Ļ│╝ ISHļź╝ ĒåĄĒĢ┤ ĒÖĢņØĖĒĢ£ļŗż. IHC Ļ▓░Ļ│╝ļŖö 0, 1+, 2+, 3+ļĪ£ ĒīÉļÅģĒĢśĻ│Ā 0Ļ│╝ 1+ņØĖ Ļ▓ĮņÜ░ļŖö ņØīņä▒ņ£╝ļĪ£, 3+ņØĖ Ļ▓ĮņÜ░ļŖö ņ¢æņä▒ņ£╝ļĪ£ Ļ░äņŻ╝ĒĢ£ļŗż. 2+ņØĖ Ļ▓ĮņÜ░ļŖö ļ░śļō£ņŗ£ HER2 ISH Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ĒåĄĒĢ┤ HER2 ņāüĒā£ļź╝ ĒÖĢņØĖĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. 2018ļģä Ļ░£ņĀĢļÉ£ American Society of Clinical Oncology/College of American Pathologists (ASCO/CAP) ņ¦Ćņ╣©ņŚÉ ļö░ļØ╝ HER2/CEP17 ļ╣äņ£© 2 ņØ┤ņāüņØ┤Ļ▒░ļéś ņäĖĒżļŗ╣ ĒÅēĻĘĀ HER2ņ£ĀņĀäņ×É ļ│ĄņĀ£ ņłś 4 ņØ┤ņāüņØä ļ│┤ņØ┤ļ®┤ HER2 ņ¢æņä▒ņ£╝ļĪ£ ĒīÉļŗ©ĒĢ£ļŗż[4].
ĒÖśņ×ÉņØś ļ│æļĀź ņ▓ŁņĘ©, ņŗĀņ▓┤ Ļ▓Ćņé¼ņÖĆ ĒĢ©Ļ╗ś ĒśłņĢĪ Ļ▓Ćņé¼, ĒØēļČĆ ņŚæņŖżņäĀ Ļ▓Ćņé¼, ĒØēļČĆCTņÖĆ ļ│ĄļČĆCT, ļ╝łņŖżņ║ö, ņ”ØņāüņØ┤ ņ׳ļŖö ļ╝łņØś ņŚæņŖżņäĀ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņ£Āļ░®ņĢöņØś ļ│æĻĖ░ļź╝ ĒÖĢņØĖĒĢ£ļŗż. ņŗĀĻ▓Į ņ”ØņāüņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļŖö ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāü(magnetic resonance imaging, MRI) ļśÉļŖö ņ▓ÖņČöMRIļź╝ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳Ļ│Ā ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ 18FDG PET-CTļź╝ ņŗ£Ē¢ēĒĢ£ļŗż.
ņ£Āļ░®ņĢöņØś ļ│æĻĖ░ļŖö AJCC cancer staging manual 8th editionņŚÉ ļö░ļźĖļŗż[5]. ņĪ░ĻĖ░ ņ£Āļ░®ņĢöņØĆ ņóģņ¢æ Ēü¼ĻĖ░ 5 cm ņØ┤ĒĢśņØ┤Ļ│Ā ņøĆņ¦üņØ╝ ņłś ņ׳ļŖö Ļ▓©ļō£ļ×æļ”╝ĒöäņĀł Ēś╣ņØĆ 3Ļ░£ ņØ┤ĒĢśņØś Ļ▓©ļō£ļ×æļ”╝ĒöäņĀłņØ┤ ņ׳ļŖö ņ╣©ņ£żņä▒ ņ£Āļ░®ņĢöņØ┤ļŗż. ĻĄŁņåī ņ¦äĒ¢ēņä▒ ņ£Āļ░®ņĢöņØĆ ņóģņ¢æ Ēü¼ĻĖ░ 5 cm ņ┤łĻ│╝ĒĢśļ®┤ņä£ ļ”╝ĒöäņĀłņØ┤ ņ׳Ļ▒░ļéś Ļ▓©ļō£ļ×æļ”╝ĒöäņĀłņØ┤ Ļ│ĀņĀĢļÉśņ¢┤ 4Ļ░£ ņØ┤ņāü ņ׳Ļ▒░ļéś ļé┤ņ£Āļ”╝ĒöäņĀłĻ│╝ ņćäĻ│©ņ£äļ”╝ĒöäņĀłņØ┤ ņ׳ļŖö ņ╣©ņ£żņä▒ ņ£Āļ░®ņĢöņØ┤ļŗż. ņĀäņØ┤ņä▒ ņ£Āļ░®ņĢöņØĆ ņøÉļ░£ ņ£Āļ░®ņĢöņØś ņ╣śļŻīņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ ņøÉĻ▓® ņןĻĖ░ņŚÉņä£ ļ░£Ļ▓¼ļÉ£ ņ£Āļ░®ņĢöņØ┤Ļ│Ā ņ×¼ļ░£ņĢöņØĆ ņ£Āļ░®ņĢöņŚÉ ļīĆĒĢ£ ĻĘ╝ņ╣śņĀü ņ╣śļŻī Ēøä ņĢöņØ┤ ļŗżņŗ£ ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ĻĄŁņåī ĻĄ¼ņŚŁ ņ×¼ļ░£Ļ│╝ ņĀäņŗĀ ņ×¼ļ░£ņØä ĒżĒĢ©ĒĢ£ļŗż.
ņłśņłĀņĀü ņĀłņĀ£Ļ░Ć ĒלļōĀ ņ£Āļ░®ņĢöņØ┤ļéś ĻĄŁņåī ņ¦äĒ¢ēņä▒ ņ£Āļ░®ņĢöņØĆ ņłśņłĀ ņĀä ĒĢŁņĢö ĒÖöĒĢÖ ņÜöļ▓Ģ(ņäĀĒ¢ē ĒĢŁņĢö ĒÖöĒĢÖ ņÜöļ▓Ģ, neoadjuvant chemotherapy)ņØä ņŗ£Ē¢ēĒĢ£ Ēøä ņłśņłĀņĀü ņ╣śļŻīļź╝ ĒĢśļÅäļĪØ ĻČīņןĒĢ£ļŗż. ļśÉĒĢ£ ņłśņłĀņØ┤ Ļ░ĆļŖźĒĢ£ ņĪ░ĻĖ░ ņ£Āļ░®ņĢöņŚÉņä£ļÅä ņóģņ¢æņØś Ēü¼ĻĖ░ļź╝ Ļ░Éņåīņŗ£ņ╝£ņä£ ņ£Āļ░®ļ│┤ņĪ┤ņłĀņØä ņŗ£ļÅäĒĢśļĀżļŖö ļ¬®ņĀüņØ┤ļéś ņĀäņŗĀ ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņóŗņØä Ļ▓āņ£╝ļĪ£ ņśłņāüļÉśļŖö ņĢäĒśĢņØś Ļ▓ĮņÜ░ ņäĀĒ¢ē ĒĢŁņĢö ĒÖöĒĢÖ ņÜöļ▓ĢņØä Ļ│ĀļĀżĒĢĀ ņłś ņ׳ļŗż. ņØ┤ļĢī ļ│æļ”¼ĒĢÖņĀü ņÖäņĀä Ļ┤ĆĒĢ┤(pathologic complete response, pCR)ļŖö ņןĻĖ░ ņāØņĪ┤ņŚÉ ļīĆĒĢ£ ņóŗņØĆ ņśłĒøä ņØĖņ×ÉņØ┤ļŗż[6]. HER2 ņ¢æņä▒ ņ£Āļ░®ņĢöņØĆ HER2ļź╝ Ēæ£ņĀüņ£╝ļĪ£ ĒĢśļŖö ļŗ©Ēü┤ļĪĀĒĢŁņ▓┤ Ēæ£ņĀü ņ╣śļŻīņĀ£ņØĖ trastuzumabĻ│╝ HER2 ļŗ©ļ░▒ņ¦łņØ┤ ļŗżļźĖ HERņłśņÜ®ņ▓┤(EGFR, HER3, HER4)ņÖĆ ņØ┤ĒĢ®ņ▓┤(dimerization)Ļ░Ć ļÉśļŖö Ļ▓āņØä ļ¦ēņĢäņŻ╝ļŖö ļŗ©Ēü┤ļĪĀĒĢŁņ▓┤ Ēæ£ņĀü ņ╣śļŻīņĀ£ņØĖ pertuzumabņØä ļ│æņÜ®ĒĢ£ ņäĀĒ¢ē ĒĢŁņĢö ĒÖöĒĢÖ ņÜöļ▓ĢņØä ņŗ£Ē¢ēĒĢśņśĆņØä ļĢī pCR ĒÖĢļźĀņØ┤ Ē¢źņāüļÉśņŚłļŗż. Ļ░Ćņן pCR ĒÖĢļźĀņØ┤ ļåÆņĢśļŹś ņÜöļ▓ĢņØĆ TRYPHAENA ņŚ░ĻĄ¼ņŚÉņä£ ņŗ£Ē¢ēĒĢ£ docetaxel + carboplatin + trastuzumab + pertuzumab ņÜöļ▓Ģņ£╝ļĪ£ 66.2%ļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż[7]. ĻĘĖļ”¼Ļ│Ā ņłśņłĀ ņØ┤ĒøäņŚÉļÅä HER2 Ēæ£ņĀü ņ╣śļŻīļź╝ ņ¦ĆņåŹĒĢśņŚ¼ 1ļģäĻ░ä ņ£Āņ¦ĆĒĢśļŖö Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż. ņ”ØļĪĆ 1ņØś Ļ▓ĮņÜ░ HER2 ņ¢æņä▒ņØś ĻĄŁņåī ņ¦äĒ¢ēņä▒ ņ£Āļ░®ņĢöņ£╝ļĪ£ ņ¦äļŗ©ĒĢśņśĆĻ│Ā ņäĀĒ¢ē ĒĢŁņĢö ĒÖöĒĢÖ ņÜöļ▓ĢņØä ņŗ£Ē¢ēĒĢ£ Ēøä pCRņØ┤ ņś© Ļ▓ĮņÜ░ļĪ£ HER2 Ēæ£ņĀü ņ╣śļŻīļź╝ 1ļģäĻ░ä ņŗ£Ē¢ēĒĢ£ ĒÖśņ×ÉņśĆļŗż.
ņäĀĒ¢ē ĒĢŁņĢö ĒÖöĒĢÖ ņÜöļ▓Ģ ņØ┤Ēøä ņ╣©ņŖĄņĀü ņ×öņŚ¼ņĢöņØ┤ ņ׳ļŖö HER2 ņ¢æņä▒ ņ£Āļ░®ņĢöņØś Ļ▓ĮņÜ░ļŖö HER2 Ēæ£ņĀü ņ╣śļŻīļź╝ trastuzumab emtansine (T-DM1)ņ£╝ļĪ£ ļ│ĆĻ▓ĮĒĢśņŚ¼ Ēł¼ņŚ¼ĒĢśļŖö Ļ▓āņØ┤ ņČöņ▓£ļÉ£ļŗż. ņØ┤ļŖö KATHERINE ņŚ░ĻĄ¼ņŚÉņä£ ņłśņłĀ Ēøä trastuzumabĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ 14ņŻ╝ĻĖ░ņØś T-DM1ņØä Ēł¼ņŚ¼ĒĢ£ ĻĄ░ņŚÉņä£ 3ļģä ļ¼┤ļ│æ ņāØņĪ┤ņ£©ņØ┤ 77.0% vs. 88.3%ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśĻ│Ā ļ¼┤ļ│æ ņāØņĪ┤ ĻĖ░Ļ░äņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ē¢źņāüļÉśņŚłĻĖ░ ļĢīļ¼ĖņØ┤ļŗż(hazard ratio [HR], 0.50; p< 0.001) [8].
ņĀäņØ┤ņä▒ ņ£Āļ░®ņĢöņØĆ ņ£Āļ░®ņĢöņŚÉ ļīĆĒĢ£ ņĀäņŗĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśĻ│Ā ņøÉĻ▓® ņĀäņØ┤ņŚÉ ļīĆĒĢ£ ņ”Øņāü ņÖäĒÖöļź╝ ņ£äĒĢśņŚ¼ ĻĄŁņåī ņ╣śļŻīļź╝ ļ│æĒ¢ēĒĢĀ ņłś ņ׳ļŗż. ĒÖśņ×ÉņØś ņéČņØś ņ¦łņØä Ē¢źņāüņŗ£ĒéżĻĖ░ ņ£äĒĢ£ ņÖäĒÖö ņÜöļ▓ĢņØä ņŗ£Ē¢ēĒĢśĻ│Ā ņĢöņØś ņ¦äĒ¢ēņØä ņ¢ĄņĀ£ĒĢśņŚ¼ ņāØņĪ┤ ĻĖ░Ļ░äņØä ņŚ░ņןĒĢśĻ│Ā ņĢöĻ│╝ Ļ┤ĆļĀ©ĒĢ£ ņ”ØņāüņØä ņÖäĒÖöĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż. HER2 ņ¢æņä▒ ņĀäņØ┤ņä▒ ņ£Āļ░®ņĢöņŚÉņä£ļŖö 1ņ░© ņ╣śļŻī ņÜöļ▓Ģņ£╝ļĪ£ docetaxel + trastuzumab + pertuzumabņØś ļ│æņÜ® ņÜöļ▓ĢņØä ĻČīĻ│ĀĒĢ£ļŗż. CLEOPATRA ņŚ░ĻĄ¼ņŚÉņä£ docetaxel + trastuzumab ņÜöļ▓ĢĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ pertuzumabņØä ļ│æņÜ®ĒĢ£ ņÜöļ▓ĢņØ┤ ļ¼┤ņ¦äĒ¢ē ņāØņĪ┤ ĻĖ░Ļ░ä(12.4 vs. 18.5 months; HR, 0.62; p< 0.001)Ļ│╝ ņĀäņ▓┤ ņāØņĪ┤ ĻĖ░Ļ░ä(40.8 vs. 57.1 months; HR, 0.69)ņØä ņ£ĀņØśĒĢśĻ▓ī ņŚ░ņןņŗ£ņ╝░ļŗż[9]. ļČĆņ×æņÜ®ņ£╝ļĪ£ docetaxelņØä ņżæļŗ©ĒĢśļŹöļØ╝ļÅä trastuzumab + pertuzumabņØä ņ£Āņ¦ĆĒĢśļŖö Ļ▓āņØä ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[10]. ņ”ØļĪĆ 2ņØś Ļ▓ĮņÜ░ ņĀäņŗĀ ņ×¼ļ░£ļĪ£ ņ”ØņāüņØ┤ ņ׳ļŖö ņĀäņØ┤ņä▒ ņ£Āļ░®ņĢöņ£╝ļĪ£ ļæÉ Ļ░Ćņ¦ĆņØś HER2 Ēæ£ņĀü ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņ”ØņāüņØ┤ ņÖäĒÖöļÉśņ¢┤ ņéČņØś ņ¦łņØ┤ Ē¢źņāüļÉśņŚłļŗż. ĻĘĖļ¤¼ļéś ņóģņ¢æņØś ļ▓öņ£äĻ░Ć ļäōĻ│Ā ņŚ╝ņ”ØņØä ļ│┤ņśĆļŹś Ļ▓ĮņÜ░ļĪ£ 1ļģäņØś ļ¼┤ņ¦äĒ¢ē ņāØņĪ┤ ĻĖ░Ļ░ä ņØ┤Ēøä ņ¦łļ│æņØ┤ ņ¦äĒ¢ēĒĢśņśĆļŗż.
1ņ░© ņĢĮņĀ£ ņØ┤Ēøä ņ¦äĒ¢ēĒĢ£ HER2 ņ¢æņä▒ ņ£Āļ░®ņĢöņŚÉņä£ļÅä HER2 Ēæ£ņĀü ņ╣śļŻīņØś ņé¼ņÜ®ņØä ĻČīņןĒĢśļŖöļŹ░ HER2ņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤ ņĢĮļ¼╝ ļ│ĄĒĢ®ņ▓┤(antibody-drug conjugate)ņØĖ T-DM1Ļ│╝ trastuzumab deruxtecan (T-Dxd)ņØ┤ ļīĆĒæ£ ņĢĮņĀ£ļōżņØ┤ļŗż. T-DM1ņØĆ trastuzumabņŚÉ ļ╣äņĀłļŗ©ĒśĢ ļ¦üņ╗żļĪ£ microtubule ņ¢ĄņĀ£ņĀ£ņØĖ ĒĢŁņĢöņĀ£ emtansineņØ┤ Ļ▓░ĒĢ®ļÉ£ ņĢĮļ¼╝ņØ┤Ļ│Ā T-DxdļŖö trastuzumabņŚÉ ĒÜ©ņåī ņĀłļŗ©ĒśĢ ļ¦üņ╗żļĪ£ ņāłļĪ£ņÜ┤ topoisomerase 1 ņ¢ĄņĀ£ņĀ£ņØĖ ĒĢŁņĢöņĀ£ deruxtecanņØ┤ Ļ▓░ĒĢ®ļÉ£ ņĢĮļ¼╝ņØ┤ļŗż. EMILA ņŚ░ĻĄ¼ņŚÉņä£ capecitabineĻ│╝ lapatinibņØś ļ│æņÜ® ņÜöļ▓ĢĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ T-DM1ņØ┤ ļ¼┤ņ¦äĒ¢ē ņāØņĪ┤ ĻĖ░Ļ░ä(6.4 vs. 9.6 months; HR, 0.65; p< 0.001)Ļ│╝ ņĀäņ▓┤ ņāØņĪ┤ ĻĖ░Ļ░ä(25.1 vs. 30.9 months; HR, 0.68; p< 0.001)ņØś ņŚ░ņןņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[11]. ņØ┤ ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ņŚÉ ļö░ļØ╝ T-DM1ņØĆ HER2 ņ¢æņä▒ ņĀäņØ┤ņä▒ ņ£Āļ░®ņĢöņØś 2ņ░© Ēæ£ņżĆ ņ╣śļŻīļĪ£ ĻČīĻ│ĀļÉśņŚłļŗż. DESTINY-Breast03 ņŚ░ĻĄ¼ļŖö T-DM1Ļ│╝ T-Dxdļź╝ ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ļĪ£ T-Dxd ĻĄ░ņŚÉņä£ ļ¼┤ņ¦äĒ¢ē ņāØņĪ┤ ĻĖ░Ļ░ä(6.8 vs. 28.8 months; HR, 0.33; p< 0.0001)ņØś ņÜ░ņøöĒĢ£ Ļ▓░Ļ│╝ņÖĆ ņĀäņ▓┤ ņāØņĪ┤ ĻĖ░Ļ░äņØś Ē¢źņāüņØä ļ│┤Ļ│ĀĒĢśņŚ¼ ņāłļĪ£ņÜ┤ 2ņ░© Ēæ£ņżĆ ņ╣śļŻīļĪ£ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[12]. ņ”ØļĪĆ 2ņØś Ļ▓ĮņÜ░, 1ņ░© ņÜöļ▓Ģ ņØ┤Ēøä ņ¦äĒ¢ēĒĢ£ HER2 ņ¢æņä▒ ņ£Āļ░®ņĢöņŚÉņä£ T-DxdļĪ£ ņ╣śļŻīĒĢśņŚ¼ ņĢöņØś ņ¦äĒ¢ēņØ┤ ļ╣Āļź┤Ļ▓ī ņÖäĒÖöļÉśņ¢┤ ņéČņØś ņ¦ł Ē¢źņāüņØä Ļ░ĆņĀĖņÖöļŗż.
T-Dxd ņĢĮņĀ£ļŖö HER2 ņØīņä▒ņØ┤ļØ╝Ļ│Ā ĒīÉļŗ©ĒĢśņśĆļŹś HER2 IHC 1+ ļśÉļŖö 2+/HER2 ISH ņØīņä▒ņØä ļ│┤ņØ┤ļŖö HER2 ņĀĆļ░£Ēśä ņĀäņØ┤ņä▒ ņ£Āļ░®ņĢöņŚÉņä£ļÅä ņØśņé¼Ļ░Ć ņäĀĒāØĒĢ£ ņäĖĒż ļÅģņä▒ ĒĢŁņĢöņĀ£ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ļ¼┤ņ¦äĒ¢ē ņāØņĪ┤ ĻĖ░Ļ░ä(9.9 vs. 5.1 months; HR, 0.5; p< 0.001)Ļ│╝ ņĀäņ▓┤ ņāØņĪ┤ ĻĖ░Ļ░ä(23.4 vs. 16.8 months; HR, 0.64; p= 0.001)ņØś Ē¢źņāüļÉ£ Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż[13]. ĻĘĖļ¤¼ļéś T-Dxd ņé¼ņÜ® ņŗ£ ņżæņÜöĒĢ£ ļÅģņä▒ņ£╝ļĪ£ ĒÅÉļĀ┤(pneumonitis)Ļ│╝ Ļ░äņ¦łņä▒ ĒÅÉņ¦łĒÖś(interstitial lung disease)ņØ┤ 12-15%ņŚÉņä£ ļ│┤Ļ│ĀļÉśņŚłļŗż. ļö░ļØ╝ņä£ ĒÖśņ×Éļź╝ ņäĀĒāØĒĢĀ ļĢī ņŻ╝ņØśĒĢśņŚ¼ņĢ╝ ĒĢśĻ│Ā ņ╣śļŻī ņżæ ĒÅÉņ¦łĒÖś ļ░£ņāØņŚÉ ļīĆĒĢ┤ ņŻ╝ņØśļź╝ ņÜöĒĢśļ®░ ļ░£ņāØ ņŗ£ ņĢĮņĀ£ļź╝ ņżæļŗ©ĒĢśĻ│Ā ņŖżĒģīļĪ£ņØ┤ļō£ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż.
HER2 ņ¢æņä▒ ņ£Āļ░®ņĢöņØĆ ņ£Āļ░®ņĢöņŚÉņä£ ņĢĮ 20%ņØś ļ╣łļÅäļź╝ ļ│┤ņØ┤Ļ│Ā ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ HER2 ļŗ©ļ░▒ņ¦łņØś Ļ│╝ļ░£Ēśä ļśÉļŖö HER2ņ£ĀņĀäņ×ÉņØś ņ”ØĒÅŁņ£╝ļĪ£ ņ¦äļŗ©ĒĢ£ļŗż. HER2ņŚÉ ļīĆĒĢ£ Ēæ£ņĀü ņ╣śļŻīĻ░Ć ņé¼ņÜ®ļÉśļ®┤ņä£ HER2 ņ¢æņä▒ ņ£Āļ░®ņĢöņØś ņśłĒøäļŖö ļ¦ÄņØ┤ Ē¢źņāüļÉśņŚłļŗż. ņĪ░ĻĖ░ ņ£Āļ░®ņĢöĻ│╝ ĻĄŁņåī ņ¦äĒ¢ēņä▒ ņ£Āļ░®ņĢöņŚÉņä£ ņäĀĒ¢ē ĒĢŁņĢö ĒÖöĒĢÖ ņÜöļ▓ĢĻ│╝ ļ│┤ņĪ░ ņÜöļ▓Ģņ£╝ļĪ£ HER2 Ēæ£ņĀü ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśĻ│Ā ņĀäņØ┤ņä▒ ņ£Āļ░®ņĢöņŚÉņä£ ņāłļĪ£ņÜ┤ HER2 Ēæ£ņĀü ņ╣śļŻīņĀ£ļōżņØś ņĀüņĀłĒĢ£ ņé¼ņÜ®ņØ┤ ĻČīņןļÉ£ļŗż. HER2 ņĀĆļ░£Ēśä ņ£Āļ░®ņĢöņŚÉņä£ļÅä ĒĢŁņ▓┤ ņĢĮļ¼╝ ļ│ĄĒĢ®ņ▓┤Ļ░Ć ĒÜ©Ļ│╝ļź╝ ļ│┤ņŚ¼ Ē¢źĒøä HER2 ļ¦×ņČż ņ╣śļŻīņŚÉ ļīĆĒĢ£ ļ│ĆĒÖöĻ░Ć ņśłņāüļÉ£ļŗż.
REFERENCES
1. Park EH, Jung KW, Park NJ, et al. Cancer statistics in Korea: incidence, mortality, survival, and prevalence in 2021. Cancer Res Treat 2024;56:357ŌĆō371.



2. Prat A, Pineda E, Adamo B, et al. Clinical implications of the intrinsic molecular subtypes of breast cancer. Breast 2015;24 Suppl 2:S26ŌĆōS35.


3. Dawood S, Broglio K, Buzdar AU, Hortobagyi GN, Giordano SH. Prognosis of women with metastatic breast cancer by HER2 status and trastuzumab treatment: an institutional-based review. J Clin Oncol 2010;28:92ŌĆō98.



4. Wolff AC, Hammond MEH, Allison KH, et al. Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline focused update. J Clin Oncol 2018;36:2105ŌĆō2122.


5. Giuliano AE, Edge SB, Hortobagyi GN. Eighth edition of the AJCC cancer staging manual: breast cancer. Ann Surg Oncol 2018;25:1783ŌĆō1785.


6. Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 2014;384:164ŌĆō172.


7. Schneeweiss A, Chia S, Hickish T, et al. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol 2013;24:2278ŌĆō2284.


8. von Minckwitz G, Huang CS, Mano MS, et al. Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019;380:617ŌĆō628.

9. Baselga J, Cort├®s J, Kim SB, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Engl J Med 2012;366:109ŌĆō119.



10. Swain SM, Miles D, Kim SB, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. Lancet Oncol 2020;21:519ŌĆō530.

11. Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012;367:1783ŌĆō1791.



A 57-year-old woman with locally advanced breast cancer. (A) Chest CT showing a large mass and thickened skin in the left breast. (B) 18FDG PET-CT showing left breast cancer with satellite nodules, along with multiple lymph node metastases in the left axillary, left supraclavicular, mediastinal and left internal mammary areas. CT, computed tomography; 18FDG PET-CT, 18F-fluorodeoxyglucose positron emission tomography-CT.
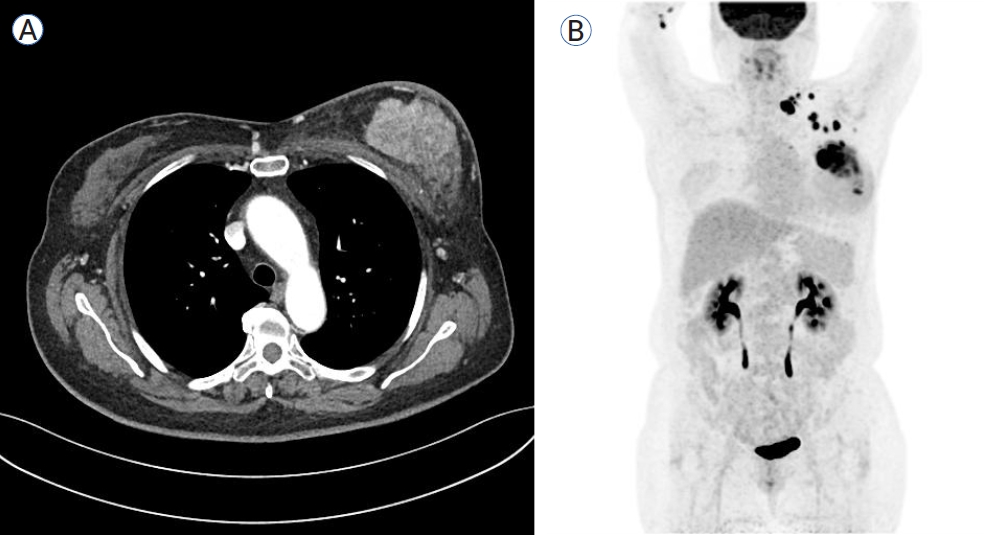
Figure┬Ā1.
A 43-year-old woman with recurrent metastatic breast cancer presented with dyspnea. (A) Chest radiograph revealing that the mediastinum has shifted to the left due to massive pleural effusion on the right side. (B) Chest CT showing tumor site inflammation, masses in the left breast cancer surgical site, and malignant pleural effusion and pleural metastasis in the right hemithorax. (C) Abdominal CT showing multiple liver metastases. CT, computed tomography.
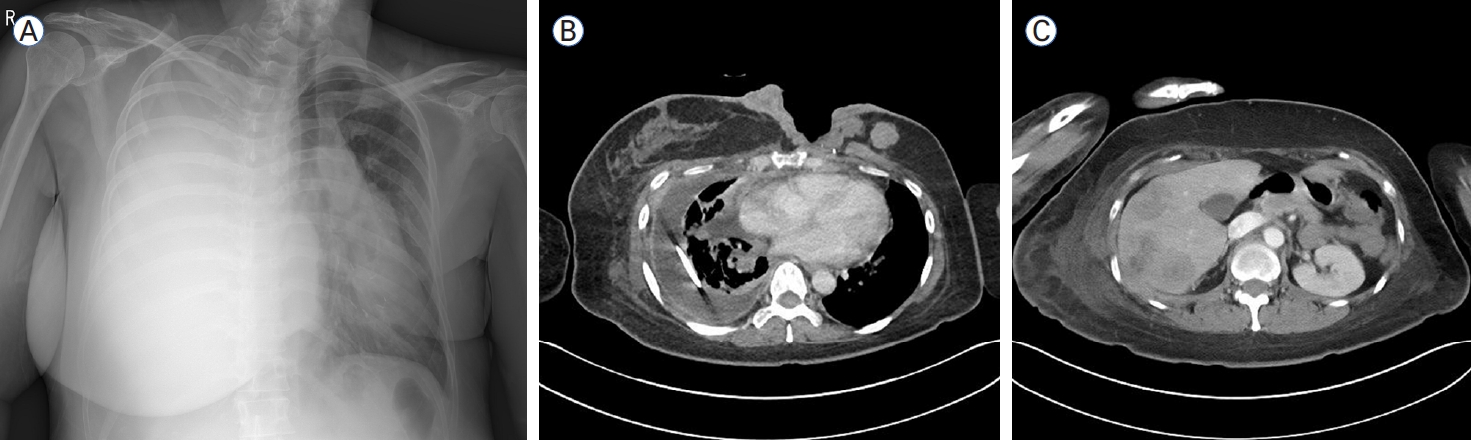
Figure┬Ā2.
Treatment of a 43-year-old woman with metastatic HER2-positive breast cancer. (A) One year after first-line treatment, follow-up CT showing worsening of left breast cancer and right pleural metastases. (B) Trastuzumab deruxtecan was administered as a second-line treatment, resulting in improvement of the left breast cancer and right pleura. HER2, human epidermal growth factor receptor-2; CT, computed tomography.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




