횡파 탄성초음파를 이용한 비침습적 간섬유화 검사
Non-Invasive Liver Fibrosis Test Using Shear Wave Elastography
Article information
Trans Abstract
Noninvasive liver fibrosis assessment is vital for chronic liver disease management. Although liver biopsy remains the gold standard, it is invasive with limited feasibility. Shear wave elastography (SWE) accurately evaluates liver stiffness, detecting liver fibrosis and cirrhosis across etiologies including viral hepatitis and metabolic dysfunction-associated steatotic liver disease. Despite confounders like obesity or elevated liver enzymes, SWE also aids in predicting portal hypertension and hepatocellular carcinoma risk, serving as a key tool in clinical decision-making.
서 론
만성 간질환에서 간섬유화를 평가하는 것은 환자의 예후를 예측하고 치료 방침을 결정하는 데 있어 매우 중요한 요소이므로 간섬유화의 정도를 정확하게 평가하고 추적 관찰하는 것은 치료 전략을 세우는 데 핵심적인 역할을 한다. 간섬유화 평가의 골드 스탠다드는 간생검이다. 간생검을 통해 간조직 내 염증, 지방증, 섬유화를 직접 관찰하고 정량화할 수 있으나 이 방법은 여러 가지 단점을 지닌다. 예를 들어 환자에게 통증, 출혈과 같은 합병증 위험이 동반되고 조직 획득 부위에 따라 표본 오차가 발생할 수 있다. 또한 병리의가 조직 슬라이드를 판독할 때 주관적 판단이 개입될 가능성이 있으며 이는 해석의 표준화 문제를 야기할 수 있다. 검사 비용과 침습성 문제로 간 생검의 반복 시행도 제한된다[1].
이러한 이유로 최근 임상에서는 간생검의 단점을 보완할 수 있는 비침습적 검사법이 적극적으로 도입되고 있다. 혈청학적 검사를 통한 간섬유화 평가(fibrosis-4 index [FIB-4], AST to platelet ratio index [APRI] 등)나 영상 검사(초음파, 전산화단 층촬영, 자기공명영상 등)를 이용한 정성적, 정량적 평가가 대표적이다[2]. 특히 최근에는 여러 초음파 기반 기법이 주목받고 있으며 그중 순간 탄성측정법(vibration-controlled transient elastography, VCTE)이 가장 광범위하게 연구되어 왔다. 그러나 VCTE는 복수가 있거나 늑간 간격이 좁은 환자에서 검사가 어렵고 체질량지수가 높은 환자의 경우 음향 신호가 약해져 측정에 제한이 생기며 검사 결과의 신뢰도가 낮아질 수 있다는 단점이 있다. 반면 횡파 탄성초음파(shear wave elastography, SWE)는 기존의 초음파 장비에 추가 모듈만 탑재하면 검사가 가능하고 무엇보다 해부학적 구조를 실시간으로 확인하면서 원하는 부위를 선택해 측정할 수 있다는 장점으로 인해 현재 개원가에서도 널리 활용되고 있다[1]. SWE는 기술적 발전과 함께 근거 논문의 축적으로 추후 표준화 지침이 마련될 것으로 기대되고, 따라서 보다 널리 사용될 것으로 기대된다. 본고에서는 SWE의 원리와 검사 방법, 다양한 만성 간질환에서의 진단 정확도 및 적용에 대하여 기술하고자 한다.
본 론
SWE의 원리 및 종류
SWE는 초음파를 이용하여 인체 조직에 미세한 힘(방사형 음파)을 가한 뒤 그에 따라 발생하는 횡파(shear wave)의 이동 속도 또는 탄성계수(elastic modulus)를 측정하여 조직의 경직도를 정량화하는 방법이다[1]. 만성 간질환 환자의 경우 간 섬유화가 진행될수록 간실질 내 콜라겐 축적이 증가하여 간이 단단해지고, 그 결과 횡파가 더 빠르게 전파된다. 즉 높은 경직도를 보이는 조직일수록 횡파 속도가 증가하므로 이를 통해 간 섬유화 정도를 예측할 수 있다.
SWE는 크게 point SWE (pSWE)와 2D-SWE로 분류된다[1]. pSWE는 acoustic radiation force impulse (ARFI)를 이용하여 탐촉자에서 좁은 영역에 초점을 맞춰 음파를 발생시킨 후 관심 영역(region of interest, ROI)에 도달하는 횡파의 속도를 측정하는 기법이다. 측정 영역이 상대적으로 작지만 검사 장비가 비교적 간단하고 ROI 설정이 용이하며 반복 측정이 가능하다는 장점이 있다. 반면 2D-SWE는 pSWE와 달리 여러 초점에서 연속적으로 음파를 발생시켜 원뿔 모양으로 확산되는 횡파를 측정하여 더 넓은 범위의 탄성도를 동시에 분석할 수 있다. 이를 통해 2차원 영상에서 간실질 내 탄성 분포를 컬러 맵으로 시각화할 수 있으므로 보다 직관적으로 간의 국소적 섬유화 정도를 파악할 수 있다는 이점이 있다(Fig. 1). 특히 2D-SWE는 다양한 장비 회사와 기법에 따라 cut-off value 범위가 다소 넓게 보고되기도 하지만 전반적으로 pSWE와 유사하거나 더 나은 민감도 및 특이도를 제시하고 있어 실제 임상에서 간편하고 효과적인 방법으로 자리매김하고 있다.
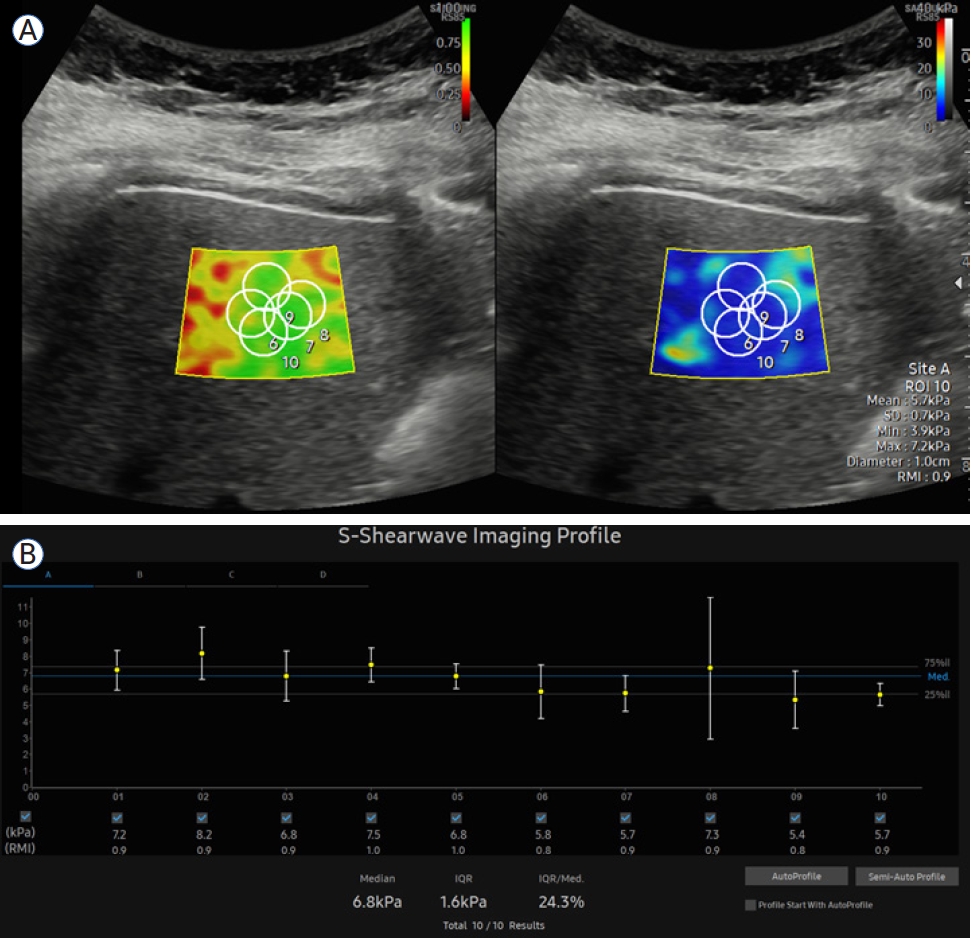
2D-shear wave elastography examination example. (A) A region of interest is set approximately 1.5 cm below the liver surface. The left screen displays the measurement quality, indicated by colors ranging from red to green, representing low to high measurement quality. Measurements are taken 5-10 times within the green area. The right screen shows liver stiffness, indicated by colors ranging from blue to red, representing low to high liver stiffness. (B) The median of the measured values is taken as the final result, and reliability is considered high if the interquartile range divided by the median is less than 30%.
검사 방법
SWE 검사는 일반적인 상복부 초음파 검사와 유사한 자세에서 시행된다. 환자는 주로 누운 자세에서 우측 팔을 들어 간접 접근을 용이하게 한 후 우상복부 부위에 탐촉자를 위치시킨다. 이때 담관, 혈관, 갈비뼈, 공명 등에 의한 음향 간섭을 피하기 위하여 간실질이 비교적 균질한 부위를 선택하여야 한다. 간피막에서는 약 1.5-4.5 cm를 유지하는 것이 재현성이 높고 진단 능력이 우수하다고 알려져 있다[1]. 검사 전 준비 사항으로는 금식이 중요한데, 식후 상태에서는 간혈류 증가 및 담즙 분비 변화 등으로 인하여 간의 탄성도가 일시적으로 높아질 수 있어 최소 4시간 이상 금식 후 검사를 시행하여야 오차를 줄일 수 있다. 또한 검사 도중에는 호기 상태에서 숨을 멈추게 하여 복압의 변화가 최소화되도록 유도한다[1].
결과 해석 및 신뢰도 평가
SWE 측정값은 보통 속도(m/s) 또는 탄성계수(kPa) 단위로 보고된다. 반복 측정 후 중앙값(median)을 대표값으로 사용하며 일반적으로 5-10회 이상의 측정이 권장된다. 측정값의 표준편차(standard deviation)가 중앙값의 30% 미만일 때 검사 결과를 신뢰할 수 있다는 것이 가이드라인에서 제시하는 기준이다(interquartile range, 사분위수 범위/중앙값 < 30%). 검사 결과에 영향을 미치는 인자로는 급성 염증(간효소 상승), 담즙 정체(담관 폐쇄, 황달), 심부전으로 인한 간울혈, 비만 등이 알려져 있으므로 이러한 요인들을 배제하거나 고려한 후 해석하여야 한다. 표 1에서 주요 간질환에서 SWE의 간섬유화 진단을 위한 절단값을 제시하였다.
만성 B형간염에서의 적용
만성 B형간염은 전 세계적으로 간경변증과 간세포암종의 주된 원인이며 우리나라를 비롯한 아시아 지역에서도 상당히 높은 유병률을 보인다. 간섬유화 평가는 만성 B형간염 환자 관리의 핵심인데, pSWE와 2D-SWE 모두 높은 정확도를 보이고 있다. 특히 의미 있는 간섬유화(≥ F2)가 있을 경우 항바이러스제 치료를 고려하게 되는데 몇몇 연구에서 만성 B형간염 환자의 유의한 섬유화 진단을 위한 pSWE 검사의 절단값으로 약 1.23 m/s, area under the curve (AUC)는 약 0.90의 우수한 진단능을 보고하였다[3]. 2D-SWE의 경우 의미 있는 간섬유화 진단에서 6.9-7.1 kPa 근방의 cut-off value가 제시되었고 대체로 AUC는 0.85 이상을 기록하여 높은 진단능을 보여주었다[4]. 진행된 간섬유화(≥ F3), 간경변증(F4) 진단에서도 AUC 0.90 이상의 높은 진단능을 보여[3,4] SWE가 만성 B형간염 환자에서 간섬유화를 평가하는 데 유용하다는 것을 시사하지만 정확한 절단값 및 진단 정확도에 대해서는 더 많은 연구가 필요하다.
만성 C형간염에서의 적용
만성 C형간염의 경우 항바이러스제의 발달로 인하여 최근 완치율이 매우 높아졌음에도 진행된 섬유화나 간경변증을 보이는 환자에서는 간세포암종 발생에 대한 감시 검사가 필요하므로 간섬유화 평가가 필수적이다. pSWE는 만성 C형간염에서 진행된 간섬유화 진단에 AUC 0.85 (절단값, 1.34 m/s), 간경변증 진단에 AUC 0.89 (절단값, 1.55 m/s)를 보였다[5]. 2D-SWE 역시 해외 연구에서 우수한 결과가 보고되었는데 진행된 간섬유화(절단값, 8.7-9.3 kPa), 간경변증(절단값, 11.5-13.4 kPa) 모두 AUC 0.90 이상의 높은 진단 정확도를 보였다[6]. 이들 결과는 SWE가 만성 C형간염 환자에서 간섬유화를 평가하는 데 유용하다는 것을 시사하지만 정확한 절단값 및 진단 정확도에 대해서는 추가 연구가 필요하다.
대사이상 지방간질환에서의 적용
대사이상 지방간질환(metabolic dysfunction-associated steatotic liver disease, MASLD)은 최근 서구화된 식습관과 비만 인구 증가로 인하여 국내에서도 빠른 속도로 유병률이 상승하고 있는 질환이다[7]. 중증도를 결정하는 데 가장 중요한 지표는 진행된 간섬유화 여부이며 이를 정확하게 평가하는 것은 장기 예후 예측과 치료 및 감시 검사 여부를 결정하는 데 중요하다. 특히 고도비만 환자의 경우 피부 두께가 두껍고 간이 심부에 위치해 있어 VCTE로 측정하기가 어려운 경우가 많으나 2D-SWE는 보다 넓은 범위와 다양한 초음파 조사 방식을 통해 상대적으로 검사를 용이하게 진행할 수 있다는 장점이 있다[8]. 다만 지방증 자체가 음향 신호에 영향을 주어 검사 정확도를 떨어뜨릴 수 있으므로 SWE 결과를 해석할 때 이를 감안하는 것이 중요하다. MASLD 환자에서 FIB-4가 1.3 이상이면 VCTE 또는 SWE와 같은 비침습적 간섬유화 검사를 고려하여야 한다[9]. 진행된 간섬유화를 진단하는 pSWE 절단값은 약 1.47-1.77 m/s, 2D-SWE 절단값은 9.2-10.0 kPa로, 전반적인 AUC는 0.80-0.90대를 보이며 VCTE와 동등하거나 그 이상의 진단 성능이 보고된 연구도 있다[10].
간경변증 합병증과 간세포암종 발생 예측
문맥압항진증은 식도정맥류, 복수와 같은 비대상성 간경변증을 유발한다. 간의 탄성도 증가는 문맥압 상승과 밀접한 연관이 있고 SWE를 통한 문맥압항진증 진단 가능성에 대해서도 연구가 진행 중이다. 특히 2D-SWE는 한 메타 분석에서 AUC 0.88, 절단값 15 kPa로 임상적으로 의미 있는 문맥압항진증과 식도정맥류를 예측할 수 있다고 보고되었다[11].
간섬유화의 진행 정도는 간세포암종 발생 위험과 밀접한 관련이 있으며 SWE 검사 결과가 향후 간세포암종 발생을 예측하는 중요한 인자로 연구되고 있다. 한 예로 만성 B형간염 환자를 대상으로 한 연구에서 2D-SWE 측정값이 10 kPa를 초과하는 경우 간세포암종 발생 위험이 유의하게 증가(위험비, 4.08)한다는 결과가 발표되었다[12]. 또한 만성 C형간염 환자 중 직접 작용 항바이러스제 치료 후 지속 바이러스 반응을 달성한 군에서도 SWE 11 kPa을 넘는 경우 간세포암종 발생 위험이 크게 증가(위험비, 28.71)한다는 연구가 보고되었다[13]. 이는 임상 현장에서 SWE 검사를 통해 간경변증의 합병증을 예측할 수 있고 간세포암종 발생 위험을 모니터링할 수 있음을 의미한다.
결 론
SWE는 만성 간질환에서 간섬유화를 평가하는 데 유용한 비침습적 검사법이다. 기존 초음파 장비에 추가 모듈만 탑재하면 검사가 가능하므로 접근성이 높고 동시에 해부학적 구조를 실시간으로 확인하면서 측정 부위를 설정할 수 있다는 장점이 있다. 이는 복수가 있거나 늑간 간격이 좁은 환자에서 검사가 제한되는 VCTE의 단점을 보완하며 검사자의 숙련도에 따라 보다 안정적인 결과를 얻을 수 있다는 장점을 지닌다.
다만 SWE 검사 결과는 alanine aminotransferase 상승, 담즙 정체, 심부전과 같은 간외적 요소나 체질량지수, 호흡 상태 등 여러 인자의 영향을 받을 수 있으므로 이를 충분히 배제하거나 고려한 뒤 결과를 해석하여야 한다. 또한 다양한 병인과 간질환 중증도에 따라 이상적인 절단값이 상이하게 보고되고 있으므로 임상 맥락에 따라 보완적으로 판단하여야 한다. 끝으로 SWE는 간섬유화 평가뿐 아니라 문맥압항진증, 간세포암종 위험 예측과 같은 다양한 유용성이 연구되고 있다. 앞으로는 더 큰 규모의 전향적 연구와 표준화된 프로토콜 마련을 통해 SWE가 만성 간질환 관리를 위한 핵심 도구로 자리매김할 것으로 기대된다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
Ji Won Han wrote and reviewed the manuscript.
Acknowledgements
None.
