이차성 이상지질혈증에 대한 한국지질동맥경화학회 2024년 합의안
2024 KSoLA Consensus on the Management of Secondary Dyslipidemia
Article information
Trans Abstract
Secondary dyslipidemia, characterized by elevated blood cholesterol and triglycerides, arises from various underlying conditions. The identification and appropriate handling of these causes is crucial for effective treatment. Major contributors include unhealthy diets, diseases impacting lipid metabolism, and medication side effects. Prioritizing the correction of secondary causes before initiating conventional lipid-lowering therapies is essential. Subsequent lipid profiles guide the selection of appropriate guideline-based lipid-lowering interventions.
서 론
약물을 통한 지질 강하는 현대 의학에서 심혈관 질환 예방을 위한 필수적인 방법이다[1,2]. 혈중 콜레스테롤과 중성지방은 흔히 이차성 원인에 의해 올라간다[3]. 이런 이차성 이상지질혈증이 의심된다면 지질 수치를 모니터링하며 유발 요인을 진단하고 처치하는 것이 중요하다. 그러므로 식사나 기저 질환의 영향, 약물에 의한 지질 변화를 선별하는 과정이 임상의에게 중요하다. 하지만 자주 처방하지 않는 약물의 부작용에 대해서는 많은 의사들이 잘 알지 못하기 쉽다[4]. 따라서 해당 약물에 대한 지식이 이차성 이상지질혈증 감별에 도움이 될 수 있다.
지질 강하 치료에 대한 많은 지침이 이차성 이상지질혈증에 대해 언급하고 있다[5,6]. 이런 지침에서 이차성 이상지질혈증의 원인, 선별, 치료의 중요성이 기술되어 있지만 아주 간략한 수준이다. 이상지질혈증은 현대 임상의학에서 핵심적인 분야인데[7,8] 그중 이차성 원인은 다양하다. 따라서 이에 대한 자세한 자료 수집과 요약, 의심되는 사례에서의 접근법에 대한 권고안이 필요하여 저자들은 이차성 이상지질혈증에 대한 합의안을 도출하게 되었다. 본 합의안에서는 임상의들이 실용적으로 사용할 수 있도록 고콜레스테롤혈증과 고중성지방혈증을 분리하여 기술하였다. 또한 고콜레스테롤혈증과 고중성지방혈증의 세 가지 주요 원인인 식사, 질환, 약물을 설명하였고 각각에 대한 권고안을 제안하였다. 이차성 이상지질혈증의 각 원인이 지단백 합성과 제거에 미치는 영향을 그림 1에 정리하였고 환자들에 대한 치료적 접근은 그림 2에 소개하였다.
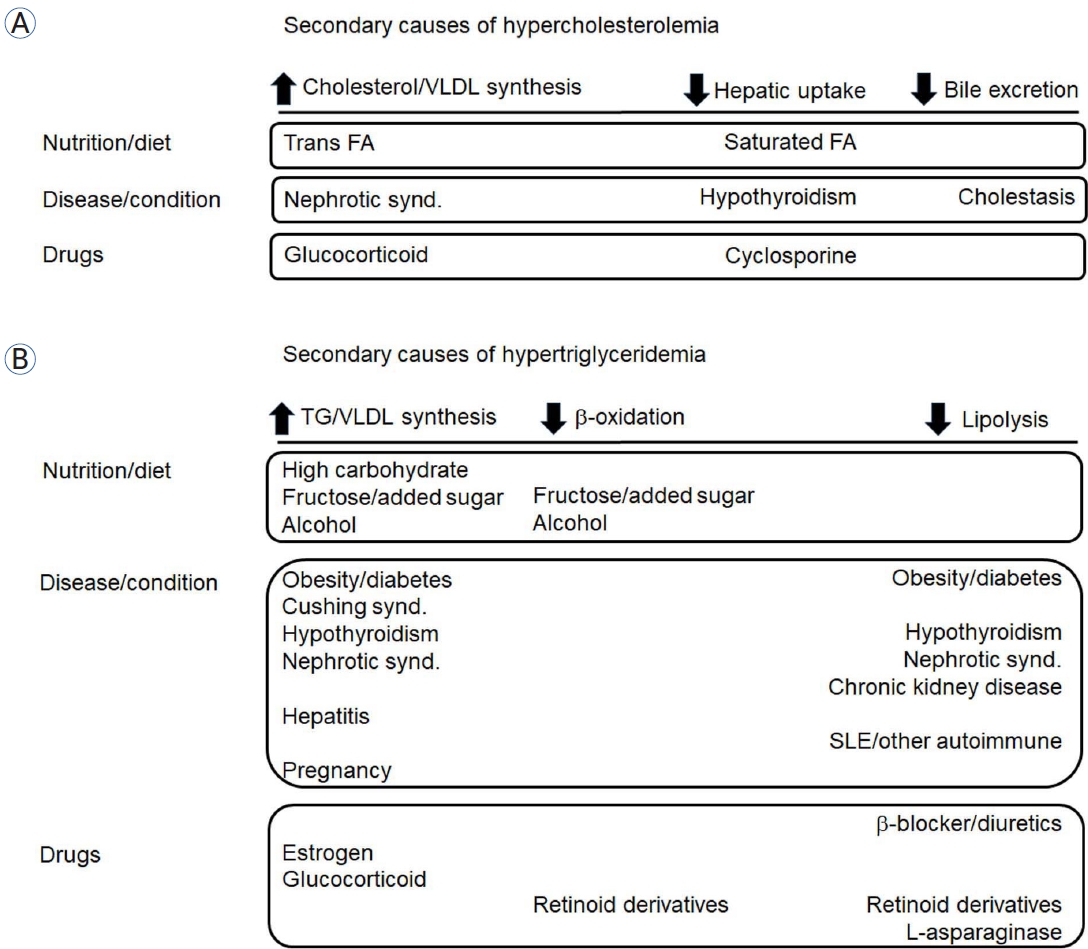
Secondary causes of (A) hypercholesterolemia and (B) hypertriglyceridemia based on their impact on lipoprotein synthesis and clearance. VLDL, very low-density lipoprotein; FA, fatty acid; TG, triglyceride.
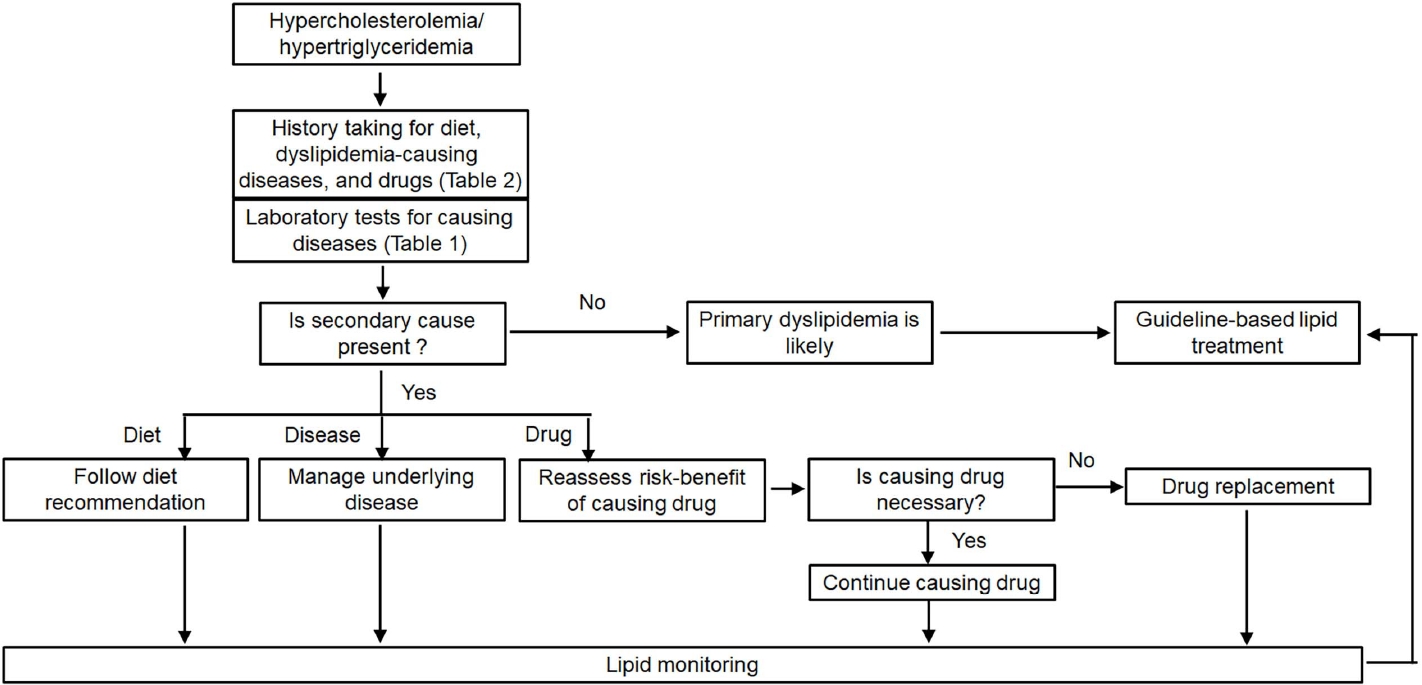
Management strategy for patients with suspected secondary hypercholesterolemia or hypertriglyceridemia.
영양, 식품, 식사 패턴과 관련된 고콜레스테롤혈증과 고중성지방혈증
과도한 열량 섭취와 적은 신체 활동 등 비만을 가속화하는 생활 양식은 고중성지방혈증을 악화시킨다[9].
영양
과도한 에너지 섭취
비만, 특히 복부비만은 이차성 이상지질혈증의 주요 원인이다. 따라서 열량을 적절한 정도로 섭취하는 것이 중요하다. 하루 중 에너지 섭취 시간도 총 콜레스테롤과 저밀도지단백콜레스테롤(low-density lipoprotein-cholesterol, LDL-C) 수치에 영향을 줄 수 있다. 대만의 한 연구에 따르면 열량 100 kcal를 섭취하는 시간을 밤에서 아침이나 점심 시간으로 바꾸면 LDL-C가 1.5 mg/dL 내려갈 수 있다고 한다[10]. 이는 사람에서 콜레스테롤 합성은 저녁과 밤에 늘어나는데 3-hydroxy-3-methyl-glutaryl-coenzyme A reductase 활성이 그 시간에 최고조이기 때문일 수 있다.
포화지방산
포화지방산은 LDL-C 수치를 올리는 핵심 요인이다. 포화지방산은 총 열량 중 10% 이상이 포화지방산인 식사를 할 때 생기는 이상지질혈증과 관련이 있다[11]. 탄소 원자가 12-16개인 포화지방산이 LDL-C를 높이는 경향이 있다[12]. 팔미트산을 포함한 팜유는 다른 식물성 기름보다 LDL-C를 9 mg/dL 더 높인다[13]. 포화지방산이 LDL-C을 높이는 것은 LDL 수용체 활성에 영향을 주기 때문일 가능성이 크다[14]. 다불포화지방산은 LDLR유전자의 mRNA와 단백질 발현을 높이며 지방산 합성을 낮춘다. 한편 단불포화지방산은 apoC3와 apoB100 합성을 감소시킨다. 이로써 불포화지방산이 혈중 지질 수치를 내리게 된다[15].
트랜스지방산
트랜스지방산을 섭취하면 열량이 같은 포화지방산을 섭취할 때보다 혈중 LDL-C와 중성지방 수치가 더 높아진다[16]. 제일 흔한 트랜스지방산인 elaidic acid는 사람 세포에서 콜레스테롤과 지방산 합성에 관여하는 효소 발현을 촉진시킨다[17].
고탄수화물
탄수화물이 많이 포함된 식사는 혈중 중성지방을 높이며 고밀도지단백콜레스테롤(high-density lipoprotein-cholesterol, HDL-C)을 낮춘다. 고탄수화물 섭취에 의하여 인슐린 농도가 높아지면 malonyl-CoA가 많아져서 지방 합성을 자극하는 데, 결과적으로 지방산이 산화되기보다 중성지방 합성의 재료로 쓰이게 된다[18]. 저탄수화물 식사는 저지방 식사에 비해 혈중 중성지방과 HDL-C 수치 개선폭이 크다[19]. 저탄수화물 식사는 탄수화물 양이 중간인 식사에 비해 중성지방 수치를 더 많이 낮춘다[20]. 탄수화물 섭취가 줄어들면 LDL-C 수치는 높아진다[21]. 이 결과로부터 저탄수화물 식사에 따른 득실을 알 수 있는데 탄수화물 제한보다 탄수화물 변경의 이득이 더 강조되고 있다.
식품
적색육
포화지방산의 주 공급원인 적색육을 과다 섭취하면 이상지질혈증 위험도가 올라간다. 국내 코호트 연구에서 적색육 섭취가 1회 제공량(60 g)만큼 늘어나면 남녀 모두에서 고콜레스테롤혈증 위험과 관계가 있다는 것이 보고되었다[23].
첨가당(added sugar)과 가당 음료(sugar-sweetened |beverages)
미국 국립보건원 조사에 따르면 첨가당으로부터 섭취하는 열량 비중이 높으면 고중성지방혈증 위험이 늘어난다고 한다[24]. Framingham Offspring 연구에서 하루에 가당 음료 1회 제공량 이상 섭취하면 1회 제공량 미만 섭취에 비해 중성지방 상승 위험도를 1.52배 높인다고 보고하였다[25]. 당류를 많이 섭취하면 과당 대사가 촉진되는데 이것은 대개 간에서 일어난다. 과당 축적이 늘면 신규 지방 합성이 많아지고 지방산 산화가 억제되어 결과적으로 간에 지질 공급이 늘어난다. 이에 따라 결국 VLDL 분비가 촉진된다[26].
한편 비영양 감미료가 설탕 대용으로 사용되고 있으나 세계보건기구는 이 감미료를 장기간 섭취하면 만성 질환의 위험이 높아질 수 있다고 발표하였다[27].
식사 패턴(dietary pattern)
식습관 면에서 정제 곡류, 포화지방산, 염분을 과섭취한다면 지질 대사에 부정적 영향을 준다. 2023년에 미국심장협회는 심혈관 위험도를 높이는, 한국을 비롯한 동북아시아의 식사 패턴에 주목하였다. 이는 예컨대 식이섬유가 없는 백미와 같은 정제 곡류, 동물성 단백질과 내장육에서 유래한 고포화 지방산과 식이 콜레스테롤, 고염분 섭취를 뜻한다[31]. 국립암센터의 암 선별 자료에 따르면 빵, 간식, 국수, 고기, 피자, 햄버거, 설탕, 기름, 지방으로 대표되는 서양식 식사 패턴이 총 콜레스테롤과 LDL-C 상승과 관련되어 있었다[32].
권고사항
건강에 도움이 되는 체중을 유지하기 위하여 열량을 적당히 섭취하기
필요 열량은 개인의 나이, 성별, 신체 크기, 활동량에 따라 다르다[33]. 체중이 감소하면 콜레스테롤과 중성지방 수치가 낮아진다[34]. 체지방이 많을 때 체중을 5% 감량하면 LDL-C가 3% 줄어든다[35]. 체중을 줄일 수 있는 식사를 하면 식사의 영양 구성에 관계없이 혈중 중성지방이 낮아진다. 지방, 단백질, 탄수화물로부터 얻는 열량이 각각 20-40%, 15-25%, 35-65% 범위 내에서 영양 구성이 서로 다른 네 가지 식사를 비교한 연구에서 네 가지 식사 모두 중성지방과 체중을 비슷한 정도로 낮추었다[36]. 과체중과 고중성지방혈증이 있을 때 체중을 5-10% 감량하는 것이 합리적이며, 이렇게 하면 중성지방 수치가 20% 낮아지는 것을 기대할 수 있다[9]. 비영양 감미료는 체중을 조절할 목적으로는 권장되지 않는다.
포화지방산을 총 열량 섭취 중 7% 미만으로 하고 트랜스지방산 섭취 제한하기
2020년 한국인을 위한 dietary reference intakes는 포화지방산과 트랜스지방산을 각각 총 열량 섭취 중 7% 미만, 1% 미만으로 할 것을 권고한다[37]. 단불포화지방산(견과류, 올리브유 등)과 해양 오메가-3 다불포화지방산 섭취를 늘리는 것이 권장된다[9]. 포화지방산을 불포화지방산으로 대체하면 지질 수치와 심혈관 위험도가 낮아지며[38,39] 불포화지방산과 탄수화물로 대체하면 LDL-C가 3 mg/dL 낮아진다[40]. 또한 적색육을 콩류와 같은 고품질 식물성 단백질로 대체하면 총 콜레스테롤과 LDL-C가 낮아진다[41].
식이섬유가 많은 식품을 섭취하며 하루 섭취량을 25 g 이상으로 하기
한 메타 분석에 따르면 식이섬유를 많이 섭취하면 적게 섭취할 때보다 총 콜레스테롤을 낮출 수 있는데 하루 25-29 g이면 건강에 이득이 있다[42]. 식이섬유, 특히 수용성 섬유는 장에서 지방 흡수를 줄이고 간에서 LDL 수용체를 높이며 VLDL 분비를 낮추어 혈중 콜레스테롤을 낮춘다[43]. 세계보건기구는 식이섬유 섭취를 위하여 과일과 야채를 하루에 최소 400 g 소비할 것을 권고한다[44]. 같은 맥락으로 2020년 한국인을 위한 dietary reference intakes는 남녀에서 각각 하루 30 g과 20 g 이상의 식이섬유 섭취를 권장한다[37].
통곡류, 과일, 야채, 콩류, 생선 섭취를 늘리고 적색육과 가공육 섭취
세계보건기구는 만성 질환 예방을 위하여 통곡류, 과일, 야채, 콩류, 견과류를 섭취할 것을 강조한다[44]. 이 식품들은 LDL-C 조절과 심혈관 건강에 대한 국제적인 지침에서도 권장되고 있다[45]. 탄수화물 대체는 탄수화물 제한 이상으로 그 이득이 강조되어 왔다. 이차성 이상지질혈증 환자에서 식사 원칙 개선과 영양 권고사항 개별화를 위해서는 영양사인 영양학자에게 의뢰하는 것이 권고되기도 한다[46]. 중성지방이 높은 사람에서 최적의 식사는 식이섬유가 풍부하고 탄수화물 비중이 50-60% 미만이며 주로 통곡류로 구성되고 과일과 야채를 포함하는 것이다[9].
이차성 고콜레스테롤혈증을 유발하는 질환과 대사성 원인
갑상선기능저하증
갑상선기능저하증에서는 흔히 혈중 LDL-C이 올라가고 때때로 중성지방이 약간 올라간다. 갑상선호르몬은 콜레스테롤 합성과 제거에 상반된 효과가 있다. 이 호르몬은 간에서 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) 환원효소 발현을 유도하며 스테롤 조절인자 결합 단백질 2 (sterol regulatory element-binding protein 2)를 활성화한다. 이 단백질은 LDLR촉진유전자 (promoter)에 있는 스테롤 조절인자와 결합하며 간의 LDL수용체 발현을 유도한다. 또한 갑상선 호르몬은 LDLR유전자의 thyroid response element에 결합함으로써 LDL 수용체 발현을 높인다[48]. 따라서 갑상선기능저하증에서 고LDL콜레스테롤혈증은 간의 LDL수용체 감소와 이에 따라 LDL 제거가 지연되는 것에 주로 기인한다[30]. 또한 갑상선기능저하증이 있으면 지방산 산화가 줄어들 수 있고 VLDL 생산이 늘어난다. 최근 갑상선자극호르몬도 지질 대사에 영향을 준다는 것이 보고되었다. 이 호르몬은 콜레스테롤 합성을 촉진하고 LDL 제거를 억제할 수 있으며 중성지방 합성도 늘릴 수 있다[48].
간 질환과 원발성 담즙성 담관염
지단백 대사의 주 무대가 간이기 때문에 간 질환은 다양한 경로를 통해서 혈중 지질 수치에 영향을 줄 수 있다. 담즙 정체(cholestasis)는 고콜레스테롤혈증과 관계가 있는데 콜레스테롤이 주로 담즙을 통해서 배설되며 담즙 정체는 이 경로를 차단하기 때문이다. 이럴 경우 유리 콜레스테롤이 인지질에 결합하고 X 지단백이라 불리는 입자 형태로 혈중으로 이동할 수 있다. X 지단백 입자는 특징적으로 아포단백질 B가 없다[30,49].
월발성 담즙성 담관염은 자가면역 간 질환인데 X 지단백과 고밀도지단백 수치가 올라가고 LDL-C 수치가 낮은 것이 특징이다. 하지만 이 질환에서 생기는 지질 대사 변화는 심혈관 위험도와는 관계가 없다[49].
신증후군
신증후군에서 지질 대사 이상은 단백뇨와 상관관계가 있으며 혈중 콜레스테롤, 중성지방 VLDL, 중간밀도지단백, 지단백(a)가 높아진다. 이런 변화는 주로 VLDL 생산 증가 때문이다. 기전은 불확실하지만 저알부민혈증과 관련된 단백질 과생산 때문일 수 있다[30]. 신증후군에서 이상지질혈증은 죽상동맥경화증 위험도를 높일 것으로 추정된다. 한편 이상지질혈증은 신장 손상과 만성 신질환 진행을 초래할 수 있다[50]. 투석하지 않고 있는 만성 신질환에서는 스타틴이 심혈관 위험도를 낮춘다고 알려져 있으나 신증후군에서 스타틴 효과에 대한 자료는 없다[50].
권고사항
LDL-C가 높은 모든 환자에서 다른 임상적 원인이 불명확 할 때는 갑상선기능저하증 선별 검사를 해야 한다. 갑상선기능 저하증에서 호르몬 치료는 대개 고콜레스테롤혈증을 개선한다[30,51]. 이차성 고콜레스테롤혈증과 고중성지방혈증을 유발하는 질환에 대한 검사실 선별 검사는 표 1에 열거하였다.

Screening laboratory tests to identify secondary causes of hypercholesterolemia and hypertriglyceridemia
간 질환 환자는 다른 심혈관 질환 위험 요인이 있을 수 있으며 이에 따라 지질 강하 치료가 필요할 수 있다. 의사들이 간 질환 환자에서 지질 강하 치료를 해야 할 때 이에 따른 간독성에 대해 걱정할 수 있다. 원발성 담즙성 담관염에서 apoB 수치가 지질 강하 치료를 결정하는 데 참고가 될 수 있다. 이런 치료가 필요한 환자에서 일차 약제는 스타틴인데, 약물 치료를 할 경우 비보상성 간경변 환자에서는 주의해야 한다[49].
이차성 고콜레스테롤혈증을 유발하는 약물
이차성 고콜레스테롤혈증과 고중성지방혈증을 유발하는 약물은 표 2에 정리되어 있다.
심혈관계 약물
심혈관계 약물에는 대표적으로 thiazide와 고리 이뇨제(loop diuretics)가 있다. Thiazide계 이뇨제는 LDL-C를 5-15% 높이며 이 효과는 단기간 지속된다. 고리 이뇨제도 지질 수치에 비슷한 영향을 주는데 indapamide는 그렇지 않다[52].
스테로이드 호르몬
스테로이드 호르몬에는 프로게스토젠, 남성화 스테로이드(androgenic anabolic steroid), 당질 코르티코이드 등이 있다. 스테로이드 호르몬은 에스트로겐, 프로게스틴, 선택적 에스트로겐수용체조절제(estrogen receptor modulator), 당질 코르티코이드를 포함한다. Original 프로게스틴은 테스토스테론 유도체인데 LDL-C 수치를 높인다. 그러나 남성화 효과가 다양한 새로운 세대의 프로게스틴 중에는 dl-norgestrel만 LDL-C 수치를 높이고 다른 호르몬은 중성지방 수치를 높인다[53]. 이와 달리 에스트로겐/프로게스테론 병합 치료는 LDL-C를 낮춘다. 2세대 프로게스토젠이 포함된 levonorgestrel 같은 경구 피임제는 LDL-C을 약간 높이는데 반해 desogestrel을 포함한 3세대 프로게스토젠을 포함한 호르몬은 이런 효과가 없다. 다나졸(danazol)은 자궁내막증, 섬유낭성(fibrocystic) 유방 질환, 유전성 혈관부종에 처방하는 합성 스테로이드인데 LDL-C 수치를 10-40% 높인다. 하지만 이는 약물을 중지하면 회복된다[52].
남성화 스테로이드나 이의 내인성 형태를 높이는 약물은 운동선수의 능력 향상을 위해서 혹은 안녕감(sense of well-being) 유도를 위해서 사용된다. 이 약물들은 LDL-C 수치를 높이는데 lipoprotein lipase (LPL) 활성을 낮추고 VLDL 분해를 억제할 수 있다[53].
당질 코르티코이드는 다양한 조건에서 사용된다. 프레드니손은 이식 환자에서 용량 의존적으로 LDL-C 수치를 높인다. 또한 전신성 홍반성 루푸스 환자에서 LDL-C를 최대 20% 높인다. 당질 코르티코이드는 지질 대사에 용량과 기간 의존적인 영향이 있다. 이 약물은 몇몇 연구에서 인슐린 저항성을 유발하였는데 이 효과는 스테로이드가 지질 수치에 미치는 영향에 혼동을 일으킬 수 있다. 헤파린 투여 후 측정하는 LPL 활성에 당질 코르티코이드가 미치는 영향은 다양하다[53]. 또한 이 약물은 속도 제한 효소 활성을 촉진하여 간에서 VLDL 생산을 늘린다[54].
피부 질환 약물
피부 질환 약물에는 이소트레티노인이 있다. 이스트레티노인은 여드름에서 처방하는 합성 레티노이드로 LDL-C 수치를 약간 높인다. 이것은 레티노이드에 의하여 VLDL 회전율이 높아졌기 때문일 수 있다[53].
면역억제제
면역억제제에는 싸이클로스포린, 라파마이신이 있다. 이식 수술 후에 면역억제제를 쓰고 있는 환자는 이상지질혈증이 생길 수 있다. 이 약물들은 LDL-C 수치를 0-50% 올릴 수 있는데, 싸이클로스포린의 영향이 제일 크며 여자에서 더 크게 나타난다. 한편 면역 억제가 되면 작고 조밀한 LDL 입자가 늘어난다. 라파마이신은 콜레스테롤 수치에 대한 효과가 명확하다[52]. 지질대사에 대한 면역억제제의 작용 기전은 불분명하지만 싸이클로스포린은 LDL 수용체 합성을 억제하여 LDL 제거를 줄일 수 있으며[55] 담즙산 합성을 낮추어 영향을 줄 수도 있다[53].
항감염제-단백질분해효소억제제
항감염제-단백질분해효소억제제에는 ritonavir, indinavir, nelfinavir 등이 있다. 앞의 항레트로바이러스 약물은 인간면 역결핍바이러스 감염에 사용된다. 이 중 여럿은 지금은 덜 사용하고 있지만 LDL-C 수치를 15-30% 높인다[52,56]. 이 효과는 해당 약물을 1년 이상 길게 쓸 때 생기고 용량 의존적이다[57].
항경련제
항경련제에는 carbamazepine, phenytoin, phenobarbital 등이 있다. 이 약물들은 총 콜레스테롤을 0-15% 높인다고 알려져 있다. 발프로산(valproic acid)을 제외한 항경련제는 간에서 microsomal cytochrome P 경로 내의 효소를 유도하는 데, 이 경로를 통한 콜레스테롤 대사와 경쟁한다[52].
기타
예를 들어 sodium-glucose cotransporter-2 (SGLT2)억제제가 있다. SGLT2억제제는 단독으로 사용하면 LDL-C를 2-4% 정도 미미하게 올린다. 지단백 합성 증가와 분해 감소 때문이다. 그러나 지질 수치에 대한 이 약물의 효과는 스타틴이나 다른 당뇨병 치료제와 함께 쓸 때는 흔히 달라진다[58].
권고사항
고콜레스테롤혈증을 유발하는 약물을 쓰고 있다면 효과가 동등한 다른 약물로 대체하는 것이 바람직하다. 예컨대 고혈압 환자에서 심혈관계 약물에 의해 이상지질혈증이 생겼다면 레닌-안지오텐신계 차단제를 대체 약물로 사용할 수 있다. 하지만 적절한 대체 약물을 찾는 것이 어려울 때가 많다. 만약 해당 약물이 꼭 필요하고 대체하기 어렵다면 주기적으로 지질 수치를 모니터해야 한다. 이때 원인 약물의 필요성, 이상지질혈증 지속에 따른 위험과 원인 약물 사용에 따른 이득에 대한 재평가를 해야 한다. 원인 약물을 장기적으로 써야 한다면 치료 지침에 따라 비약물 또는 약물을 통한 지질 강하 치료를 해야 할 수 있다. 만약 원인 약물을 써야 하는 기간이 짧다면 지질 강하 치료는 불필요하다[52].
이식 후 발생한 고콜레스테롤혈증에서 스타틴을 사용할 때는 약물 상호작용에 대해 주의해야 한다. 특히 싸이클로스포린과 스타틴을 같이 사용하면 근육병증 위험도가 높아질 수 있는데 이때는 fluvastatin이나 pravastatin 같이 CYP3A4 경로를 통하지 않는 스타틴이 선호된다. 싸이클로스포린은 이차 지질 강하 약물인 에제티미브의 혈중 농도를 높인다고 보고되었다[5].
단백질분해효소억제제에 의한 이상지질혈증 연구는 많지 않지만 해당 약제 처방을 변경하거나 지질 강하 치료를 통해 대처할 수 있다. 그러나 처방 변경이나 단백질분해효소억제제스타틴 간의 약물 상호작용에 따른 위험/이득에 대해서 검토하여야 한다. Lovastatin과 simvastatin은 CYP3A4를 통해 대사되는데 이는 단백질분해효소억제제를 사용하는 환자에서는 금기이다. Atorvastatin은 이 경로로 대사되는 비중이 더 작지만 용량을 줄여야 할 때가 있다. 이런 환자들에서는 fluvastatin, pravastatin, pitavastatin, rosuvastatin을 사용할 수 있다[56].
이차성 고중성지방혈증을 유발하는 질환과 대사성 원인
비만 혹은 조절되지 않는 당뇨병
중성지방을 높이는 의학적 상태 중 제일 흔한 것은 비만과 잘 조절되지 않는 당뇨병이다. 이 두 상태에서는 중성지방 수치가 올라가고 HDL-C 수치가 감소하며 LDL-C 수치는 다양하게 나타나고 작고 조밀한 LDL 입자가 늘어난다. 당뇨병에서 지단백의 정성적 특징은 VLDL 입자 크기 증가, LDL과 HDL 입자에서 중성지방 증가, 아포지단백의 당화, LDL의 높은 산화 감수성이다. 혈중 LDL 농도가 정상이라 할지라도 LDL의 혈중 순환 시간은 당뇨병에서 더 길다. VLDL 생산은 늘고 분해는 줄어드는 데 반해 HDL 분해는 항진되고 식후 고지혈증(postprandial hyperlipidemia)이 흔하다[59]. 지방세포 양이 늘고 hormone sensitive lipase의 인슐린 감수성이 낮아져서 혈중 유리 지방산이 많아짐에 따라 간에서 VLDL 생산이 늘어난다[9,30]. 여기에 인슐린 농도가 높아져 간에서 지방산 합성이 촉진된다. 또한 인슐린 저항성은 LPL 활성을 약화시키고 킬로미크론과 VLDL 분해를 억제한다[9,30,60]. 인슐린 저항성이 높아지고 이와 함께 LPL 전사(transcription)가 줄어들며 LPL 억제 분자가 증가하면 지방 분해가 억제될 수 있다[30]. 한편 2형 당뇨병에서는 LPL 활성과 상관없이 혈중에서 중성지방이 풍부한 지단백(triglyceride-rich lipoprotein) 제거가 덜 되는 것이 보고되었다. 또한 인슐린을 주입하면 지방세포에 LPL 발현이 촉진된다[9].
쿠싱증후군
이 질환에서는 흔히 중성지방이 상승하고 HDL-C 수치가 낮아진다[30]. 당질 코르티코이드가 과다해지면 VLDL 합성이 늘어나고 고중성지방혈증이 초래된다.
갑상선기능저하증
갑상선기능저하증은 중성지방 대사에 영향을 주어 중성지방 수치를 높인다. 갑상선호르몬이 낮으면 간에서 VLDL에 탑재되는 중성지방 생산이 많아진다. LPL 활성이 낮아지며 중성지방이 풍부한 지단백 분해가 줄어든다. 또한 hepatic lipase 활성이 약화되어 이 지단백들이 축적된다. 한편 갑상선자극호르몬은 지방세포와 간세포에서 중성지방 합성을 촉진한다[48].
신증후군
신증후군에서는 지질 대사가 바뀐다. 특히 혈중 콜레스테롤, 중성지방, apoB 함유 지단백이 높다. 또한 hepatic lipase나 LPL 같은 분해효소, VLDL 수용체가 적어져 VLDL과 킬로미크론 제거가 억제된다. 저알부민혈증에 의해 간에서 단백질 합성이 늘어나 이와 같은 지단백 대사 변화를 유도할 수 있다[61].
만성 신질환
이 질환에서는 흔히 중성지방이 약간 상승할 수 있다. 지방 분해가 줄어들며 잔여 지단백이 덜 제거되고 LPL 발현과 활성 역시 줄어든다. 또한 부갑상선호르몬 혹은 다른 조건에 의해 인슐린 저항성이 유발되어 지질 수치에 영향을 줄 수 있다. 요독증이 있으면 VLDL 입자 제거가 억제되는데 VLDL 수용체가 줄어들기 때문이다. 한편 만성 신질환에서는 중성지방을 합성하는 효소 발현이 증가한다[62].
간 질환
감염, 약물, 알코올에 의한 간염에서 흔히 VLDL 생산이 증가하고 중성지방이 경도-중등도로 증가한다. 반면 간부전과 같은 심한 상태에서는 혈중 콜레스테롤과 중성지방이 극적으로 낮아질 수 있다[30].
전신성 홍반성 루푸스를 포함한 자가면역 질환
전신성 홍반성 루푸스 환자는 LPL 활성이 낮고 일부는 항 LPL항체를 생산한다[63]. 다발성 근염(polymyositis)/피부근육염(dermatomyositis), 류마티스관절염, 쇼그렌증후군 등 다양한 다른 자가면역 질환에서 고킬로미크론혈증이 보고되었는데 이 환자들은 항LPL항체가 양성이었다[64]. 항LPL항체 측정이 난해하다는 주장이 있으며 이 문제가 항LPL항체에 의한 고중성지방혈증 진단에 제한점이 될 수 있다. 한편 일부 환자들은 항glycosylphosphatidylinositol anchored high density lipoprotein binding protein 1항체가 있는데 이 항체에 의해 LPL 기능이 약해져서 고중성지방혈증이 유발될 수 있다[65]. 스테로이드 치료로 고중성지방혈증이 호전되면 자가면역 관련 고중성지방혈증으로 진단하는 데 도움이 된다.
패혈증과 중증 질환
중성지방은 상승하고 HDL-C와 LDL-C는 낮아지며 유리지방산 수치는 높아진다. 이는 조직의 지방 분해가 항진된 것을 시사하는데 패혈성 쇼크 환자에서 더 뚜렷하게 나타난다[66].
임신
임신 3기에 혈중 중성지방은 4배까지 올라갈 수 있다. 그러나 보통 < 250 mg/dL 수준이며 임상적으로 문제를 일으키지 않는다. 이 시기에 에스트로겐과 인간 태반성 락토겐(human placental lactogen) 수치가 상승하는 것이 인슐린 저항성과 중성지방 상승에 영향을 준다. 에스트로겐은 VLDL 합성을 높이고 지방 분해를 억제하며 인간 태반성 락토겐 역시 지방 분해를 억제한다[67].
권고사항
중성지방을 낮추는 목적은 급성 췌장염과 죽상동맥경화성 심혈관 질환의 예방이다. 킬로미크론이 췌장염 위험을, 더 작은 잔여 입자는 후자의 위험을 높일 수 있다[9]. 중성지방 강하를 위하여 다른 치료 방법을 쓰기 전에 고중성지방혈증의 이차성 요인을 교정하는 것이 필수적이다. 예컨대 열량을 제한하여 체중을 감량하면 중성지방 수치를 약 10% 낮출 수 있다[9]. 신체 활동과 운동은 중성지방 수치를 최고 30% 낮춘다고 알려져 있다. 환자를 치료할 때는 원인 가운데 기여도가 제일 큰 것을 중심으로 하는 것이 중요하다[46].
자가면역 질환에서 항LPL항체의 존재가 의심될 때 이를 측정하는 것은 대부분의 진료 환경에서 불가능하다. 이 항체는 보통 헤파린 정맥 주사 후 채취한 혈액에서 LPL을 immunoblotting 혹은 효소면역측정법(enzyme-linked immunosorbent assay)으로 측정한다. 그렇지만 이 방법들도 일부 기술적인 한계가 있다[63].
만약 임신 중에 중성지방 수치가 225 mg/dL를 초과한다면 주기적으로 모니터링하고 생활 습관을 교정한다. 비약물 치료를 함에도 불구하고 임신 중 중성지방 수치가 500 mg/dL를 초과하면 오메가-3 지방산 투여를 시작할 수 있다[67].
이차성 고중성지방혈증을 유발하는 약물
어떤 약물은 혈중 중성지방 수치에 약간의 변화를 일으키고, 어떤 약물은 심한 변화를 일으킨다(Table 2) [46].
심혈관계 약물
심혈관계 약물에는 베타 차단제, thiazide, 고리이뇨제 등이 있다. 베타차단제, 특히 비선택적 차단제(atenolol, propranolol, metoprolol)는 중성지방을 경도-중등도로 높인다. Thiazide와 고리이뇨제도 중성지방 수치를 약간 올린다[9,52]. 이에 대한 기전은 불확실하지만 교감신경 작용이 없는 베타차단제와 이뇨제는 반사적 알파 아드레날린 활성을 높이고 이것이 LPL을 억제하여 중성지방 수치를 높일 수 있다. 이뇨제는 인슐린 저항성을 높이는데 이 또한 지질 수치에 영향을 줄 수 있다[53].
스테로이드 호르몬
스테로이드 호르몬에는 에스트로겐, 경구피임제, 타목시펜, 당질 코르티코이드 등이 있다. 경구 호르몬 대체 요법으로 쓰이는 비길항성 에스트로겐은 중성지방 수치를 용량 의존적으로 30-40% 높이는데 이것은 VLDL 생산 증가와 관계가 있다[9,52,53]. 반면 초회 통과 효과(first-pass effect)가 없는 경피 에스트로겐은 중성지방에 대한 영향이 미미하다. 에스트로겐/프로게스토젠 병합 치료는 중성지방 수치에 대한 영향이 일정하지 않다. Levonorgestrel을 포함한 2세대 프로게스토젠을 포함하거나 desogestrel 같은 3세대 프로게스토젠을 포함한 경구피임제는 중성지방을 최고 50-75% 높인다. 선택적 에스트로겐수용체조절제인 타목시펜은 중성지방을 0-30% 높일 수 있지만 심한 상승은 드물다[9,52]. 타목시펜의 효과는 lipase 억제에 따른 것으로 생각된다.
이식 후에 프레드니손 치료는 중성지방을 높이지만 용량 의존적인 효과는 아니다. 당질 코르티코이드는 건강인과 루푸스 환자에서 중성지방 수치를 최고 40%까지 높인다[53]. 이 효과는 VLDL 생산 증가와 고인슐린혈증에 기인한다[54].
피부 질환 치료제
피부 질환 치료제에는 이소트레티노인, acitretin 등이 있다. 레티노이드유도체인 이소트레티노인 사용 후에 다양한 수준의 중성지방 상승(35-144%)이 보고되었다. 이것은 지방산 산화 억제와 apoC3 상승에 의거한다[9]. 심한 건선에 사용하는 acitretin은 중성지방 수치를 최고 60%까지 올릴 수 있다[52].
면역억제제
면역억제제에는 싸이클로스포린, 라파마이신 등이 있다. 이 약물들은 장기 이식 후에 흔히 쓰이는데 중성지방 수치를 0-70% 높일 수 있다[52]. 중성지방에 대한 싸이클로스포린의 효과는 LDL-C에 대한 효과보다 일정하지 않다.
항감염제-단백질분해효소억제제
항감염제-단백질분해효소억제제에는 ritonavir, indinavir, nelfinavir 등이 있다. Ritonavir는 중성지방 수치를 200-300% 높일 수 있고 indinavir와 nelfinavir는 0-55% 올릴 수 있다[52].
항암제
항암제에는 L-asparaginase, cyclophosphamide 등이 있다. L-asparaginase는 심한 고중성지방혈증을 유발할 수 있으며 이 효과는 LPL 억제와 관계가 있다[9].
결 론
식사, 질환, 약물을 포함한 다양한 원인이 혈중 콜레스테롤과 중성지방의 이차성 상승에 기여할 수 있다. 가능성 있는 원인에 대해 선별 검사하고 확인하는 것이 이차성 이상지질혈증 치료의 첫걸음이다. 기여도가 제일 큰 이차성 원인에 중점을 두고 처치하는 것이 추가적인 지질 치료 전에 선행되어야 한다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
This work was supported by the Korean Society of Lipid and Atherosclerosis. The funder had no role in study design, data collection and analysis, decision to publish, or preparation of the manuscript.
AUTHOR CONTRIBUTIONS
HW, JHB, HL, BJK, SHC, IKJ, and SHL contributed to drafting and revising the manuscript. All authors reviewed and approved the manuscript.
Acknowledgements
None.

