급성 신우신염에 의한 양측 신피막하혈종 1예
A Rare Case of Acute Pyelonephritis Leading to Bilateral Subcapsular Renal Hematoma: A Case Report
Article information
Abstract
SCH는 주로 낭종, 출혈 경향, 암, 혈관질환에 의해 발생하나 드물게 감염에 의해 발생할 수 있다. 본 증례는 기저질환으로 조절되지 않는 당뇨, 음주력이 있는 환자에서 급성 신우신염의 합병증으로 양측 SCH가 발생한 국내 첫 보고이다. CT를 통하여 양측 SCH를 진단하였고 원인 감별을 위한 검사 진행 후 감염이 원인임을 확인하였다. 항생제 치료와 더불어 패혈증, 파종성 혈관 내 응고에 대해 신대체 요법 진행 후 신기능 및 감염 소견이 호전되어 중단하였고 이후 양측 PCD를 통하여 혈성, 농양 배액을 30일간 유지한 뒤 제거 후 퇴원하였다. 본 사례는 양측 SCH의 드문 원인으로서 급성 신우신염이 가능함을 확인한 국내 첫 사례 보고라는 점에서 의의가 있다.
Trans Abstract
This case underscores the rarity of bilateral subcapsular renal hematoma (SCH) as a complication of acute pyelonephritis, and this is the first reported case in South Korea. SCH can have various underlying causes, including cysts, bleeding tendencies, cancer, vascular diseases and, less commonly, infections. A patient with uncontrolled diabetes mellitus and alcohol dependency presented with weakness. Bilateral SCH from acute pyelonephritis was diagnosed and treated with antibiotics and renal replacement therapy. Despite improved renal function, 30-day bilateral percutaneous drainage was necessary due to a persistent fever and elevated infection markers, resulting in a bloody, pus-like discharge. This case report sheds light on the rare etiology of bilateral SCH as a result of acute pyelonephritis. It serves as a reminder of the critical importance of timely intervention, to prevent deteriorating outcomes.
서 론
급성 신우신염은 콩팥이 세균에 감염되어 발생하며 주로 항생제 치료를 통하여 호전되는 임상 경과를 보인다. 신피막 하혈종(subcapsular renal hematoma, SCH)은 외상, 출혈 경향, 악성 종양, 동정맥 기형, 혈관염, 드물게 기종성 신우신염 등에서 발생할 수 있다[1]. 편측 SCH가 급성 신우신염의 합병증으로 발생한 보고는 2, 3예 있으나 양측 SCH가 급성 신우신염 합병증으로 발생한 사례는 국외 보고 1예, 국내 보고는 없는 상태이다. 이에 저자들은 드물게 급성 신우신염의 합병증으로 발생한 양측 SCH 증례를 보고하는 바이다.
증 례
환 자: 61세 여자
주 소: 전신 쇠약감
현병력: 1달 전부터 식이량 감소, 10일 전부터 발생한 전신 쇠약감으로 응급실에 내원하였다.
과거력: 특이 사항 및 항혈전제를 포함한 약물 복용력은 없었다.
사회력: 만성적인 알코올 중독 상태였다.
신체 진찰: 혈압 149/74 mmHg, 맥박수 85회/분, 체온 38.4℃였고 경부 림프절 종대는 없었으며 흉부 진찰상 호흡음은 정상이었고 심잡음도 들리지 않았다. 복부는 부드러웠으나 양측 옆구리의 심한 압통을 호소하였으며 부종 및 피부 발진은 없었다.
검사실 소견: 말초혈액 검사에서 백혈구 21,490/mm3 (호중구 92.8%), 혈색소 10.5 g/dL, 혈소판 94,000/mm3로 백혈구 증가 및 빈혈과 혈소판 감소 소견을 보였다. 프로트롬빈 시간 1.3초, 활성화 부분 트롬보플라스틴 시간 28.5초였고 적혈구 침강 속도(erythrocyte sedimentation rate, ESR) 91 mm/h, C-반응성 단백질(C-reactive protein, CRP) 31.65 mg/dL, 프로칼시토닌 68.92 mg/mL로 증가하였다. 혈청 생화학 검사에서는 혈액요소 질소 102 mg/dL, 크레아티닌 3.50 mg/dL로 고질소혈증과 신기능 저하 소견을 보였다. 아스파테이트아미노전이효소 48 IU/L, 알라닌전이효소 37 IU/L, 총 빌리루빈 0.69 mg/dL, 단백질 5.8 g/dL, 알부민 2.3 g/dL였다. 혈당 검사에서 공복 혈당 325 mg/dL, 당화 혈색소 8.2%로 조절되지 않는 당뇨병을 새로 진단받았다. 동맥혈 기체 분석에서 pH 7.44, 중탄산 14.9 mEq/L, 음이온차 19.1 mmol/L, 젖산 1.9 mmol/L, 소변 케톤 음성으로 요독산증 및 젖산산증에 의한 고음이온차 대사산증이 의심되었다. 요 검사는 pH 5.5, 요비중 1.011, 단백질(2+), 잠혈(3+), 적혈구 10-29/high-power field (HPF), 백혈구 > 30/HPF, 다수의 세균이 관찰되었다.
방사선 소견: 흉부, 복부 단순 엑스선 촬영에서는 특이 소견이 없었다. 신기능 저하 때문에 초기에 조영제를 투여하지 않았고 6월 25일 복부 컴퓨터단층촬영(computed tomography, CT)을 시행하였다. 검사 결과 우측 SCH와 양측 신우신염 의심 소견이었고 기종성 소견은 없었다(Fig. 1A). 지방간이 의심되었고 그 외 간경화 등은 없었다(Fig. 1B).
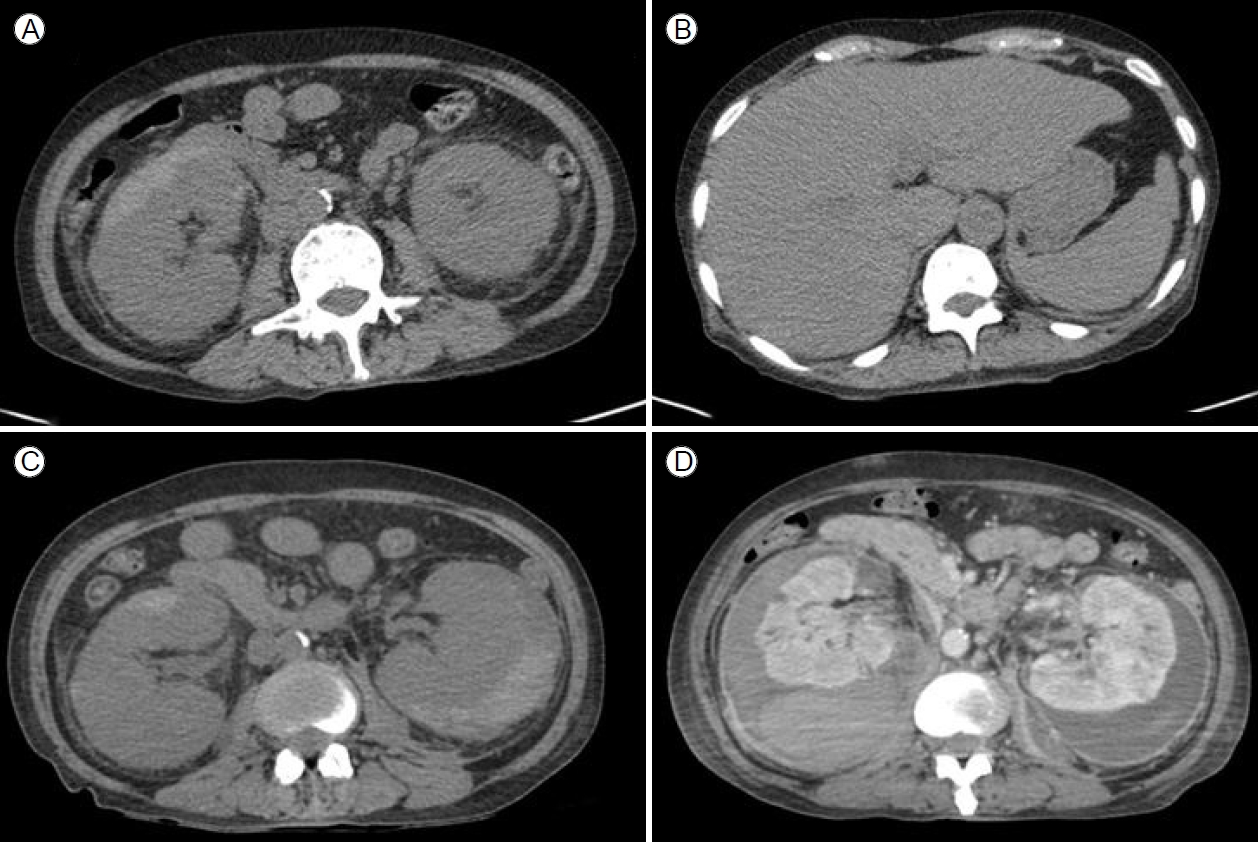
(A) Initial non-contrast abdominal computed tomography (CT) scan. Crescenteric high-density fluid surrounding the right kidney was noted. (B) Initial CT showing a fatty liver. (C) Follow-up non-contrast abdominal CT scan on hospital day 1 (4 days after A). A new collection of high-density fluid surrounding the left kidney consistent with subcapsular renal hematoma was noted, as well as a subcapsular hematoma in the right kidney. (D) Follow-up contrast-enhanced CT scan on hospital day 12. This scan shows increased subcapsular hematomas without air shadows.
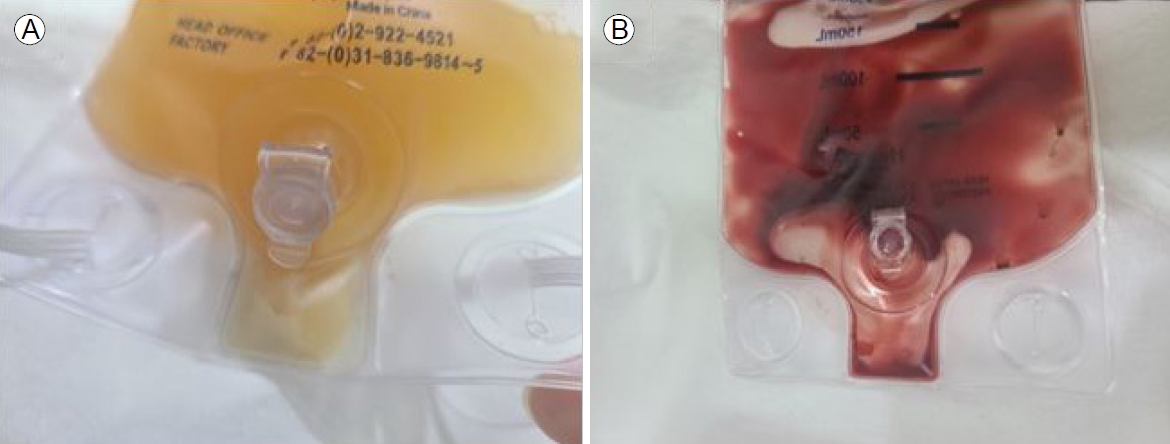
임상 치료 및 경과: 환자는 신우신염으로 인한 신기능 저하가 의심되어 중환자실 입원을 권유하였으나 입원 거부로자의 퇴원하였다. 이후 4일 뒤인 6월 29일 옆구리 통증 악화로 다시 내원하였고 혈액요소질소 200 mg/dL, 크레아티닌 5.49 mg/dL, 복부 CT에서 양측 SCH가 진행된 소견을 보였다(Fig. 1C). 양측 SCH의 원인 감별을 위해 시행한 3차원 혈관 조영 CT 검사(CT angiography)에서 혈관염의 증거는 없었고 자가면역항체 검사상 보체 3/4 각각 119/44 mg/dL, 항스트렙토리신(-), 한랭글로불린(-), 항호중구 세포질항체(-), 항핵항체(-), 이중나선 DNA항체(-)로 모두 음성 소견을 보였다. 혈청 및 소변 단백질, 면역글로불린 전기 영동 검사에서 특이 소견은 없었다. 이에 양측 SCH 원인은 양측 급성 신우신염 진행으로 인한 파종성 혈관 내 응고 및 패혈증 진행으로 임상적으로 판단하였다. 균이 동정되기 전 경험적 항생제로 ceftriaxone 2 g 1일 1회 투여하였고 혈액 배양, 소변 배양 검사에서는 폐렴막대균(Klebsiella pneumoniae)이 배양되었다. 이후 소변 배양 검사 추적 관찰에서 광범위 베타락탐 분해효소(extended-spectrum beta-lactamase, ESBL) 폐렴막대균이 배양되어 항생제 meropenem 500 mg 1일 2회로 변경하여 투여하였다. 입원 후 신기능 저하로 인한 양측 흉막삼출 및 파종성 혈관 내 응고에 대해 입원 6일째에 지속적 신대체 요법을 시작하여 9일간 유지하였다. 이후 투석 중단하였으며 소변량 회복 및 신기능 혈액요소질소 39 mg/dL, 크레아티닌 2.51 mg/dL, CRP 16.39 mg/dL로 호전되는 추세를 보였다. 그러나 7월 10일 입원 12일째 복부 CT 추적 검사에서 양측 SCH가 지속적으로 관찰되었고(Fig. 1D) 이후 발열 및 CRP가 호전되지 않아 입원 19일째 양측 경피적 도관 배액술(percutaneous catheter drainage, PCD)을 시행하였고 혈성의 고름 같은 배액이 확인되었다(Fig. 2). 배액 액체에서 나간 성분 검사에서 적혈구 67,000/mm3, 백혈구 134,495/mm3였고 배액에서 나간 균 배양 검사에서는 균이 동정되지 않았으며 이후 양측 경피적 도관 유지 후 배액량 감소, CRP 5.72 mg/dL, 크레아티닌 1.34 mg/dL까지 호전되었다. 양측 경피적 도관은 30일간 유지 후 8월 16일 복부 CT 추적 검사에서 양측 SCH가 호전되어 도관을 제거하고 퇴원하였다(Fig. 3). 환자는 이후 외래 추적 검사에서 CRP 1.79 mg/dL, 크레아티닌 1.22 mg/dL로 유지되고 있어 치료 종결 후 경과 관찰 중이다(Fig. 4).
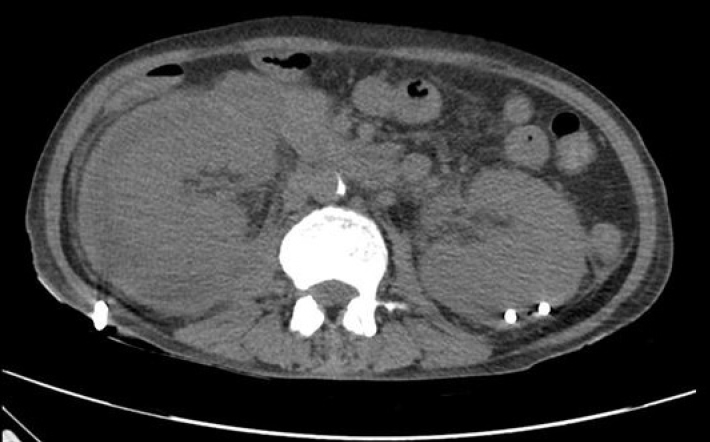
Follow-up non-contrast computed tomography (CT) scan on hospital day 49. This scan shows a decrease in subcapsular hematomas in which a catheter has been placed.
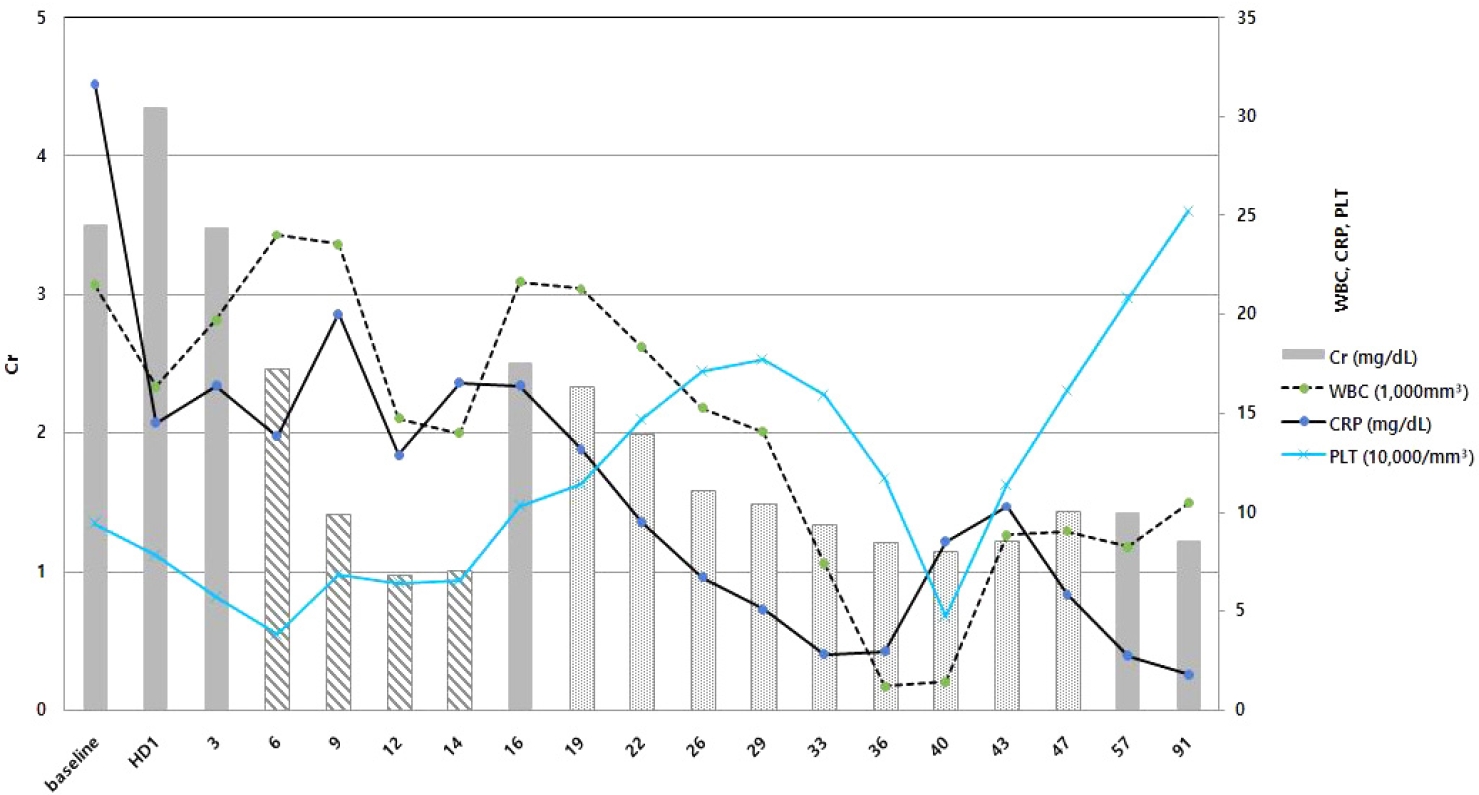
Patient’s clinical progression. The patient’s clinical journey is illustrated based on hospital days (HD) and tracking changes in renal function and infection markers, including creatinine (Cr), white blood cell count (WBC), C-reactive protein (CRP), and platelet (PLT) count. The patient underwent continuous renal replacement therapy from HD 6 to 14 (indicated by the striped pattern). Subsequently, after recovering renal function, percutaneous catheter drainage was performed for both subcapsular renal hematomas from HD 19 to 49 (dotted pattern), prompted by a persistent fever and elevated infection markers. Upon initial presentation, the PLT count was 94,000/mm3. But 4 days later, it dropped to 38,000/mm3 due to disseminated intravascular coagulation. PLT recovered following the resolution of sepsis. Meropenem-induced thrombocytopenia led to a decrease of PLT to 47,000/mm3 on HD day 40, but the count rebounded to 252,000/mm3 at the final outpatient visit after discontinuing the meropenem.
고 찰
SCH는 환자가 갑작스러운 옆구리 통증을 호소할 시에 CT와 같은 영상 검사를 통해 진단된다[2]. 영상 검사에서 혈종이 확인되면 최근 외상, 시술 병력을 확인하고 영상에서 낭종이나 암의 근거가 없다면 혈관염, 혈관질환 평가를 위해 혈관 조영술을 시행하게 된다[3]. 혈관 조영술에서도 혈종의 원인이 드러나지 않으면 감염이나 기타 자발적으로 발생한 혈종 원인을 평가하게 된다. 81명을 대상으로 한 후향적 연구에 따르면 외상이나 의료 시술과 무관하게 발생하는 자발성 콩팥 주위 출혈(spontaneous perirenal hemorrhage, SPH)은 일반적으로 I, II, III 세 가지 유형으로 분류되며 type I이 SCH에 해당한다[1]. SPH의 원인으로 총 9가지가 제시되었고 원인을 모두 찾지 못하면 특발성으로 정의하였는데 빈도에 따라 응고병증, 단순 신낭종, 신장세포암, 대동맥류, 부신 종양, 다낭콩팥병, 콩팥혈관근지방종, 콩팥혈관질환 순이었고 감염으로 인한 경우는 1건(1.2%)만 보고되었다[1].
본 증례는 병력에서 외상 및 시술력이 없었고 3차원 CT에서 낭종, 암, 혈관질환, 혈관염의 근거가 없었으며 지방간 외에 간경화 등의 출혈 경향을 유발할 수 있는 기저질환 및 항혈전제 복용력이 없었다. 환자는 1달 전부터 다음과 다뇨 증상을 보였고 10일 전부터 전신 쇠약감의 조절되지 않는 당뇨 증상을 보였다. 첫 내원 시부터 혈종은 편측이었으나 양측 콩팥 주위에 침윤이 동반되어 양측 신우신염이 의심되는 CT 검사 소견이었다. 따라서 고혈당으로 인한 요로 감염이 발생하고 이로 인해 신우신염이 선행된 후에 이차적으로 혈종이 발생한 것으로 추정된다.
첫 내원 시부터 혈종과 감염이 동시에 확인되었기 때문에 혈종과 감염 간의 인과관계는 임상적으로 판단하였다. 분류 체계에 따라 모든 가능한 원인이 배제될 때 특발성 SCH로 진단되므로 감염을 우선적 원인으로 보았다. 선행 연구에서 원인에 따른 혈종 용적 차이에 대해 통계적으로 유의하지는 않으나 특발성이 평균 용적 41.2 mm3 (1-122)로 가장 적었고 감염은 143 mm3, 응고병증은 578.5 mm3 (10-2,681)였는데 본 증례 환자에서 혈종 용적은 411.95 mm3로 평균 용적이 가장 적은 특발성일 가능성은 적다고 사료된다[1]. 따라서 임상적으로 급성 신우신염으로 인한 양측 SCH로 진단되었다. 혈액 및 소변 배양 검사에서 동정된 폐렴막대균은 한국 여성에서 발병한 급성 신우신염의 2번째로 흔한 원인균이었다[4].
급성 신우신염의 합병증으로 양측 SCH가 발생한 사례는 국내에서는 아직 보고된 바가 없는 것으로 확인된다. 급성 신우신염에서 발생한 양측 SCH는 1건의 국외 보고가 있는데 양측 요관 스텐트 삽입술과 오토바이 사고로 인한 이차성 편측 콩팥 파열 병력이 있는 환자에서 당뇨병성 케톤산증, 급성 신우신염과 함께 확인된 양측 SCH 사례이다. 증례의 환자는 편측 신동맥색전술과 신절제술까지 시행한 바 있다[5]. 그 외에 급성 신우신염으로 인한 편측 SCH에 대해 경피 배액술을 시행한 2건의 증례 보고와 시술 없이 항생제 투여로 혈종이 호전된 1건의 증례 보고가 있었다[6-8]. 또한 기종성 신우신염에서 몇 건의 양측 SCH 보고가 확인되었다[3]. 그러나 급성 신우신염 단독으로 인하여 양측 SCH가 발생하고 중환자실 치료, 신대체 요법을 필요로 하는 급성 경과를 거치는 사례는 저자들이 찾은 바로는 보고가 없었다.
본 증례의 환자는 6월 25일 내원 후 자의 퇴원하여 6월 29일 재내원 시점에는 패혈증으로 인한 파종성 혈관 내 응고가 발생하였다. 따라서 편측 혈종이 4일 만에 빠르게 양측 혈종으로 악화된 데에는 급성 신우신염과 조절되지 않는 패혈증으로 인한 파종성 혈관 내 응고가 함께 작용하였다고 판단된다. 최근에는 감염 치료를 적기에 받을 경우 양측 SPH로 악화되는 경우가 드물 것으로 사료되지만 본 사례는 환자가 치료를 거부하거나 적절한 시기에 치료를 받지 않으면 부정적인 결과를 초래할 수 있음을 시사한다. 또한 본 증례의 환자는 당뇨병이 효과적으로 조절되지 않았고 만성적인 음주력을 가지고 있었다. 이러한 환자의 기저 숙주 요인이 임상 경과에 영향을 미쳤을 것으로 사료된다.
사례의 한계점으로는 처음 내원 시 SCH 원인으로 응고병증, 파종성 혈관 내 응고 감별을 위해 일부 검사는 진행하였으나 C 단백질, S 단백질, 항트롬빈 III, 응고인자 V, X, 섬유소원, 섬유소 분해 산물, D 이합체 등의 검사를 시행하지 못하였다는 점이 있다. 또한 신조직 검사를 진행하지 못하였다는 것과 PCD 시점이 늦어졌다는 점이 있다. 이는 패혈증으로 인한 파종성 혈관 내 응고로 출혈 경향을 보여 초기 침습적 시술을 하기 어려웠기 때문이다. 본 증례는 영상적으로 SCH를 감별할 시 낭종, 암, 출혈 경향, 혈관 문제 외에 감염에 대한 감별이 필요함을 확인하였고 빠른 항생제 투여가 환자 예후에 중요함을 재확인하는 증례라고 하겠다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
Hae Won Park wrote and edited the manuscript. Chung Sik Lee and Minsuk Seo reviewed the manuscript.
Acknowledgements
None.