 |
 |
| Korean J Med > Volume 99(1); 2024 > Article |
|
Abstract
Lymphangioleiomyomatosis (LAM) is a rare condition that exclusively affects women and is characterized by lung parenchymal destruction and the formation of cysts due to infiltration by LAM cells. It can also impact the lymphatic system, leading to the development of fluid-filled cystic structures and abdominal involvement, including renal angiomyolipomas (AML) or lymphangioleiomyoma. LAM can occur sporadically or be associated with tuberous sclerosis complex. Common symptoms include respiratory issues such as dyspnea, pneumothorax, chylothorax, along with other manifestations like renal AML and lymphatic involvement. The diagnosis of LAM relies on a combination of clinical, radiological, and laboratory findings, and treatment options vary depending on symptoms and patient status, with mTOR inhibitors being considered as a treatment option. This case outlines the diagnostic journey and clinical course of a 32-year-old female patient with LAM.
мҰқлЎҖ: 32м„ё м—¬мһҗк°Җ нқүл¶Җ м»ҙн“Ён„°лӢЁмёөмҙ¬мҳҒ(computed tomography, CT) кІҖмӮ¬м—җм„ң мҡ°м—°нһҲ л°ңкІ¬лҗң лӢӨл°ңм„ұ лӮӯм„ұ нҸҗлі‘ліҖ(multiple cystic lung lesion)мңјлЎң лӮҙмӣҗн•ҳмҳҖлӢӨ. нҷҳмһҗлҠ” 1л…„ м „ мҶҢнҷ”кё°лӮҙкіјм—җм„ң м§ҒмһҘмқҳ м•…м„ұ carcinoid neuroendocrine мў…м–‘мқ„ 진лӢЁл°ӣм•„ лӮҙмӢңкІҪм Ғ м җл§ү м Ҳм ңмҲ мқ„ мӢңн–үл°ӣм•ҳкі , мЈјмң„ мЎ°м§Ғ м№ЁмңӨмқҙлӮҳ мӣҗл°ң м „мқҙ мҶҢкІ¬мқҙ нҷ•мқёлҗҳм§Җ м•Ҡм•„ 추к°Җ м№ҳлЈҢ м—Ҷмқҙ кІҪкіј кҙҖм°° мӨ‘мқҙм—ҲлӢӨ. мў…м–‘ 진лӢЁ лӢ№мӢң лі‘кё° нҷ•мқёмқ„ мң„н•ҙ мӢңн–үн•ң ліөл¶Җ CTм—җм„ң нҸҗн•ҳл¶Җмқҳ лӮӯм„ұ нҸҗлі‘ліҖмқҙ мҡ°м—°нһҲ нҷ•мқёлҗҳм—Ҳкі , мқҙм—җ лҢҖн•ң м •л°Җ кІҖмӮ¬лҘј мң„н•ҳм—¬ лӮҙмӣҗн•ҳмҳҖлӢӨ.
нҷҳмһҗлҠ” 비нқЎм—°мһҗмқҙл©°, к°ҖмЎұл ҘмқҙлӮҳ нҠ№мқҙн•ң л…ём¶ңл ҘмқҖ кё°лЎқлҗҳм§Җ м•Ҡм•ҳлӢӨ. нҷҳмһҗлҠ” лҜёнҳјмқҙм—Ҳмңјл©° м¶ңмӮ° л°Ҹ мһ„мӢ кІҪн—ҳмқҙ м—Ҷм—Ҳкі лӮҙмӣҗ лӢ№мӢң ліөмҡ© мӨ‘мқҙкұ°лӮҳ мөңк·јм—җ ліөмҡ©н•ң м•Ҫл¬јмқҙ м—Ҷм—ҲлӢӨ. лҳҗн•ң нҳёнқЎкё° мҰқмғҒмқ„ нҸ¬н•Ён•ң лӢӨлҘё мҰқмғҒмқ„ нҳёмҶҢн•ҳм§Җ м•Ҡм•ҳлӢӨ. лӮҙмӣҗ лӢ№мӢң мӢңн–үн•ң мӢ мІҙ진찰 л°Ҹ нҷңл Ҙ징нӣ„, нҳҲм•Ў кІҖмӮ¬м—җм„ң мқҙмғҒ мҶҢкІ¬мқҖ нҷ•мқёлҗҳм§Җ м•Ҡм•ҳлӢӨ. нҸҗкё°лҠҘ кІҖмӮ¬ кІ°кіј 1мҙҲк°„ нҳёкё°лҹүмқҳ нҸҗнҷңлҹү
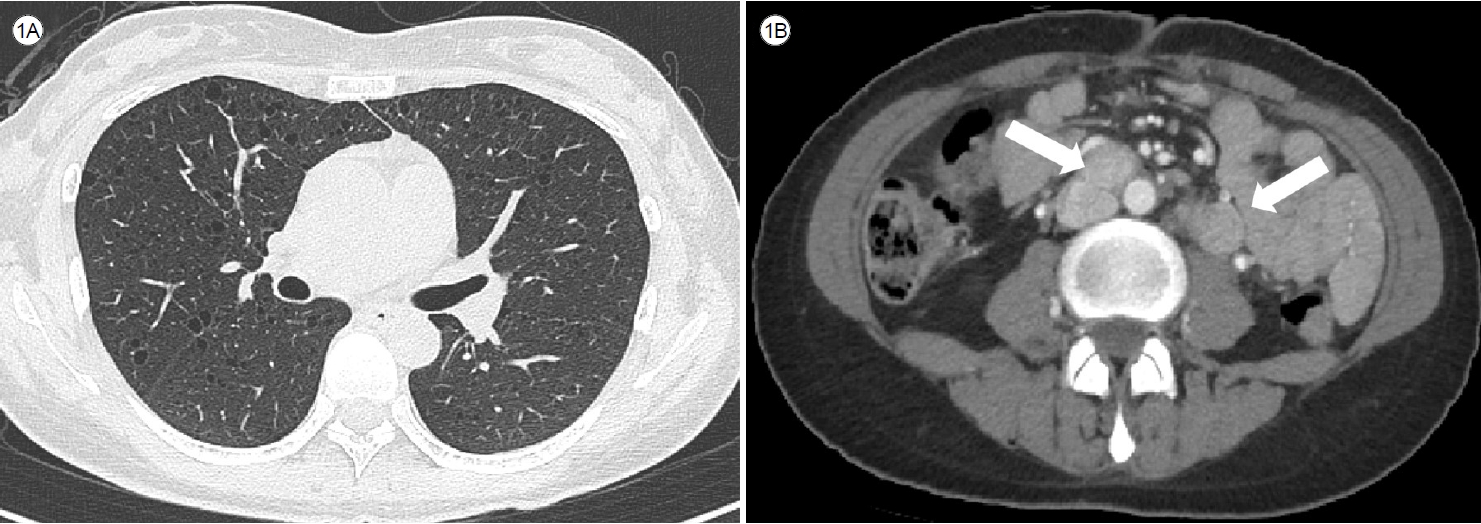
(forced expiratory volume in the first second, FEV1)мқҖ 96%, л…ёл Ҙм„ұ нҸҗнҷңлҹү(forced vital capacity, FVC)мқҖ 97%лЎң м •мғҒ лІ”мң„мҳҖмңјлӮҳ, нҸҗнҷ•мӮ°лҠҘ(diffusing capacity for carbon monoxide, DLCO)мқҖ 63%лЎң лӢӨмҶҢ к°җмҶҢлҗҳм—ҲлӢӨ. нқүл¶Җ кі н•ҙмғҒ CT (high resolution CT, HRCT)м—җм„ң м–‘ нҸҗ м „л°ҳм ҒмңјлЎң нҒ¬кё°к°Җ 2 mm лӮҙмҷёмқҳ мһ‘кі л‘ҘкёҖл©° м–ҮмқҖ лІҪмқ„ к°Җ진 лӮӯм„ұ лі‘ліҖл“Өмқҙ л„“мқҖ лІ”мң„лЎң 분нҸ¬н•ҳмҳҖлӢӨ(Fig. 1A). лҳҗн•ң ліөл¶Җ CTм—җм„ң 1л…„ м „кіј 비көҗн•ҳм—¬ лҢҖлҸҷл§Ҙм •л§Ҙ(aortocaval), лҢҖлҸҷл§ҘмЈјмң„(para-aortic) л°Ҹ мҡ°мёЎ мҷёмһҘкіЁл°ҳ(right external iliac) л¶Җмң„мқҳ мһ‘кі лӢӨл°ңм„ұмқё лҰјн”„м Ҳ비лҢҖк°Җ мғҲлЎӯкІҢ нҷ•мқёлҗҳм—ҲлӢӨ(Fig. 1B). м•…м„ұ мў…м–‘мңјлЎң мқён•ң лҰјн”„м Ҳ м№ЁлІ”мқ„ кі л Өн•ҳм—¬ 추к°ҖлЎң мӢңн–үн•ң м–‘м „мһҗл°©м¶ңлӢЁмёөмҙ¬мҳҒ(positron emission tomography)м—җм„ң н•ҙлӢ№ л¶Җмң„ лҰјн”„м Ҳ비лҢҖк°Җ кҙҖм°°лҗҳм—ҲмңјлӮҳ, лҢҖл¶Җ분мқҳ кІҪмҡ° F-fluorodeoxyglucose м„ӯм·Ёк°Җ к°җм§Җлҗҳм§Җ м•Ҡкұ°лӮҳ мқјл¶Җм—җм„ңлҠ” л§Өмҡ° лҜёлҜён•ң мҰқк°Җл§Ң кҙҖм°°лҗҳм—ҲлӢӨ.
нҷҳмһҗлҠ” нқүл¶Җ CTм—җм„ң лҰјн”„кҙҖнҸүнҷңк·јмў…мҰқ(lymphangioleiomyomatosis, LAM)мқҙ мқҳмӢ¬лҗҳм—ҲмңјлӮҳ LAMмқҳ лҸҷл°ҳлҗң н•©лі‘мҰқмқҙ лӘ…нҷ•н•ҳм§Җ м•Ҡм•„ 진лӢЁмқ„ мң„н•ҙ мЎ°м§Ғ кІҖмӮ¬лҘј кі л Өн•ҳмҳҖмңјл©°, мҲҳмҲ м Ғ нҸҗмЎ°м§Ғ кІҖмӮ¬лҘј мӢңн–үн•ҳкё° м „ лҚң м№ЁмҠөм Ғмқё кІҪкё°кҙҖм§ҖнҸҗмЎ°м§Ғ кІҖмӮ¬(bronchoscopy-transbronchial lung biopsy, BFS-TBLB)лҘј мӢңн–үн•ҳмҳҖлӢӨ.
BFS-TBLBм—җм„ң cystic lesionмқҙлӮҳ nodule л“ұ лӘ…нҷ•н•ң мқҙмғҒ мҶҢкІ¬мқҖ кҙҖм°°лҗҳм§Җ м•Ҡм•ҳмңјлӮҳ, нҡҚл“қн•ң нҸҗмЎ°м§Ғм—җм„ң HMB45 м–‘м„ұ spindle cellмқҙ нҷ•мқёлҗҳм–ҙ LAM cellмқҳ м№ЁлІ”мқҙ мқҳмӢ¬лҗҳм—ҲлӢӨ. л”°лқјм„ң LAM 진лӢЁмқҙ нғҖлӢ№н•ҳлӢӨкі нҢҗлӢЁн•ҳмҳҖмңјл©°, ліөл¶Җмқҳ лҰјн”„м Ҳ비лҢҖлҠ” LAMмқҳ лҰјн”„м Ҳ м№ЁлІ” л•Ңл¬ёмқј к°ҖлҠҘм„ұмқҙ лҶ’лӢӨлҠ” кІ°лЎ мқ„ лҸ„м¶ңн•ҳмҳҖлӢӨ. нҷҳмһҗлҠ” DLCOк°Җ лӢӨмҶҢ м Җн•ҳлҗҳм—ҲмңјлӮҳ FVCмҷҖ FEV1мқҖ м •мғҒлІ”мң„ лӮҙ мһҲм—Ҳмңјл©°, нҠ№мқҙн•ң нҳёнқЎкё° мҰқмғҒмқҙлӮҳ н•©лі‘мҰқмқ„ нҳёмҶҢн•ҳм§Җ м•Ҡм•ҳлӢӨ. л”°лқјм„ң нҳ„мһ¬ н•©лі‘мҰқ, нҸҗкё°лҠҘ к·ёлҰ¬кі ліөл¶Җ лҰјн”„м Ҳ비лҢҖм—җ лҢҖн•ң мҷёлһҳ 추м Ғ мӨ‘мқҙлӢӨ.
LAMмқҖ мЈјлЎң к°Җмһ„кё° м—¬м„ұм—җкІҢ л§Өмҡ° л“ңл¬јкІҢ л°ңмғқн•ҳлҠ” м§ҲнҷҳмңјлЎң, л№„м •мғҒм Ғмқё smooth muscle м„ёнҸ¬мҷҖ мң мӮ¬н•ң LAM м„ёнҸ¬мқҳ м№ЁмңӨкіј мҰқмӢқмңјлЎң мқён•ҙ нҸҗмӢӨм§Ҳ нҢҢкҙҙмҷҖ нҸҗлӮӯмў… нҳ•м„ұмқ„ нҠ№м§•мңјлЎң н•ңлӢӨ[1]. лҚ”л¶Ҳм–ҙ мӨ‘추лҰјн”„кҙҖ(axial lymphatics)м—җ LAM м„ёнҸ¬мқҳ м№ЁмңӨмңјлЎң мқён•ҙ лҰјн”„кҙҖнҸүнҷңк·јмў…кіј к°ҷмқҖ мң мІҙк°Җ к°Җл“қн•ң(fluid-filled) лӮӯм„ұ кө¬мЎ°л¬јмқҙ нҳ•м„ұлҗҳл©°, ліөл¶Җ м№ЁлІ”мңјлЎң мқён•ң мӢ мһҘ нҳҲкҙҖк·јмңЎм§Җл°©мў…(angiomyolipomas, AML)кіј к°ҷмқҖ нҸҗмҷё м№ЁлІ”лҸ„ л°ңмғқн• мҲҳ мһҲлӢӨ[2]. LAMмқҖ мӮ°л°ңм ҒмңјлЎң л°ңмғқн• мҲҳлҸ„ мһҲкі (sporadic LAM, S-LAM) кІ°м ҲкІҪнҷ”мҰқ(tuberous sclerosis complex, TSC)мқҳ н•©лі‘мҰқмңјлЎң лӮҳнғҖлӮ мҲҳ мһҲлӢӨ(TSC-LAM). TSC нҷҳмһҗмқҳ мөңлҢҖ 30%м—җм„ң LAMмқҙ лҸҷл°ҳлҗңлӢӨкі м•Ңл Өм ё мҷ”мңјлӮҳ[3] мөңк·ј м—°кө¬ кІ°кіјм—җ л”°лҘҙл©ҙ 40м„ё мқҙмғҒмқҳ TSC нҷҳмһҗм—җм„ң мөңлҢҖ 80%к№Ңм§Җ LAMмқҳ мң лі‘лҘ мқҙ мҰқк°Җн•ңлӢӨкі ліҙкі лҗҳм—ҲлӢӨ[4]. LAMмқҳ мһ„мғҒ мҰқмғҒмқҖ м№ЁлІ”н•ҳлҠ” мһҘкё°м—җ л”°лқј лӢӨлҘҙм§Җл§Ң, мЈјлЎң 진н–үн•ҳлҠ” нҳёнқЎ кіӨлһҖ, кё°нқү, мң лҜёнқү(chylothorax)мқҙлӮҳ AMLмқ„ нҸ¬н•Ён•ң ліөл¶Җ мў…м–‘кіј к°ҷмқҖ мҰқмғҒмқ„ лӮҳнғҖлӮј мҲҳ мһҲлӢӨ. мқјл°ҳм ҒмңјлЎң нҸҗм—җ лҢҖн•ң мҰқмғҒмқҙ мҡ°м„ён•ҳл©°, мў…мў… мІңмӢқ, нҸҗкё°мў… лҳҗлҠ” л§Ңм„ұ нҸҗмҮ„м„ұ нҸҗм§Ҳнҷҳ(chronic obstructive pulmonary disease, COPD) л“ұкіј к°ҷмқҖ лӢӨлҘё нҳёнқЎкё° м§ҲнҷҳмңјлЎң мһҳлӘ» 진лӢЁлҗҳм–ҙ 진лӢЁкіј м№ҳлЈҢк°Җ м§Җм—°лҗ мҲҳ мһҲлӢӨ.
S-LAMмқҳ мӢӨм ң л°ңлі‘лҘ кіј мң лі‘лҘ мқҖ м•Ңл Өм§Җм§Җ м•Ҡм•ҳмңјлӮҳ лҢҖл¶Җ분мқҙ кҙҖм°° м—°кө¬мқҙл©° TSC-LAMмқ„ нҸ¬н•Ён•ҳкё° л•Ңл¬ём—җ мӢӨм ң мң лі‘лҘ мқҙ кіјмҶҢнҸүк°Җлҗҳм—Ҳмқ„ к°ҖлҠҘм„ұмқҙ лҶ’лӢӨ. н•ң м—°кө¬м—җм„ң LAMмқҖ м—¬м„ұ 1,000,000лӘ…лӢ№ м•Ҫ 3.4-7.8лӘ…м—җкІҢ кұ°мқҳ лҸ…м җм ҒмңјлЎң л°ңмғқн•ңлӢӨкі ліҙкі лҗҳм—Ҳмңјл©°[5], лӮЁм„ұм—җм„ңлҠ” л§Өмҡ° л“ңл¬јкі мЈјлЎң TSCмҷҖ лҸҷл°ҳлҗңлӢӨ. LAM нҷҳмһҗ мӨ‘ 2/3лҠ” л°ңлі‘ мӢңкё°к°Җ нҸҗкІҪ м „ м—¬м„ұмңјлЎң, 30-40лҢҖм—җм„ң к°ҖмһҘ нқ”н•ҳкІҢ лӮҳнғҖлӮҳм§Җл§Ң, мҶҢм•„л¶Җн„° л…ёмқёк№Ңм§Җ лӘЁл“ м—°л №м—җм„ң л°ңмғқн• мҲҳ мһҲлӢӨ[6].
LAMмқҖ ліөмһЎн•ң м§ҲнҷҳмңјлЎң, LAM м„ёнҸ¬к°Җ нҳҲм•Ў л°Ҹ лҰјн”„кҙҖмқ„ нҶөн•ҙ мҲңнҷҳн•ҳкі нҸҗм—җ м№Ём°©н•ҳм—¬ мӢӨм§Ҳ нҢҢкҙҙмҷҖ лӮӯм„ұ м§Ҳнҷҳмқ„ мң л°ңн•ңлӢӨ[2]. мў…м–‘ м–өм ңмһҗ мң м „мһҗмқё TSC1 л°Ҹ TSC2мқҳ лҸҢм—°ліҖмқҙлҠ” mTOR кІҪлЎңлҘј нҶөн•ң л¶Җм Ғм Ҳн•ң мӢ нҳё м „лӢ¬мқ„ мң л°ңн•ҳл©°, мқҙлҹ¬н•ң лҸҢм—°ліҖмқҙлҠ” S-LAM л°Ҹ TSC-LAM лӘЁл‘җм—җм„ң лӮҳнғҖлӮңлӢӨ[1]. лҳҗн•ң LAM м„ёнҸ¬лҠ” лҰјн”„кҙҖ мғқм„ұмқ„ мҰқмӢқн•ҳлҠ” нҡЁкіјлҘј к°Җ진 нҳҲкҙҖ лӮҙн”ј м„ұмһҘ мқёмһҗ(vascular endothelial growth factor, VEGF)-C л°Ҹ VEGF-DлҘј л°ңнҳ„н•ҳл©°, мқҙлҠ” LAM м„ёнҸ¬мқҳ м „мқҙ нҷ•мӮ°м—җ кҙҖм—¬н•ңлӢӨ[7]. LAMмқҖ мЈјлЎң м—¬м„ұм—җм„ң л°ңмғқн•ҳл©° м—¬м„ұнҳёлҘҙлӘ¬ мҲҳм№ҳк°Җ кёүмҰқн•ҳлҠ” мғҒнҷ©мқё мһ„мӢ , нҳёлҘҙлӘ¬ н”јмһ„ л°Ҹ мғқлҰ¬ мӨ‘м—җ м•…нҷ”лҗҳл©°, нҸҗкІҪ нӣ„м—җлҠ” LAM нҷҳмһҗмқҳ лі‘м„ёк°Җ м•Ҳм •лҗҳлҠ” кІҪн–Ҙмқҙ мһҲм–ҙ м—¬м„ұнҳёлҘҙлӘ¬лҸ„ LAMмқҳ лі‘мқё кё°м „кіј кҙҖл Ёмқҙ мһҲмқ„ кІғмңјлЎң м¶”м •лҗңлӢӨ[8].
LAMмқҖ м—¬м„ұм—җм„ң мӣҗмқёмқ„ м•Ң мҲҳ м—ҶлҠ” нҳёнқЎ кіӨлһҖ л°Ҹ мӣҗл°ңм„ұ мһҗл°ңм„ұ кё°нқүмқ„ к°Җ진 кІҪмҡ°м—җ кі л Өн•ҙм•ј н•ҳлҠ” м§ҲнҷҳмқҙлӢӨ. к·ёлҹ¬лӮҳ LAM нҷҳмһҗ мӨ‘ м•Ҫ 1/3мқҖ кё°кҙҖм§Җнҷ•мһҘм ң л°ҳмқ‘ м–‘м„ұмқё кё°лҸ„нҸҗмғүмқ„ к°Җм§Җкі мһҲм–ҙ мў…мў… мІңмӢқ, нҸҗкё°мў… лҳҗлҠ” COPDмҷҖ к°ҷмқҖ кё°лҸ„ м§ҲнҷҳмңјлЎң мҳӨ진лҗ мҲҳ мһҲлӢӨ. нҸҗ м „мІҙм—җ лӢӨл°ңм„ұ нҸҗлӮӯмў…мқ„ ліҙмқҙлҠ” м§Ҳнҷҳ мӨ‘ к°җлі„мқҙ н•„мҡ”н•ң 진лӢЁмқҖ нҸҗлһ‘кІҢлҘҙн•ңмҠӨм„ёнҸ¬мЎ°м§Ғкө¬мҰқ(pulmonary Langerhans cell histiocytosis, PLCH), нҸҗкё°мў…, мҶҢнҸ¬м„ұ м„ёкё°кҙҖм§Җм—ј(follicular bronchiolitis), лҰјн”„кө¬к°„м§Ҳм„ұнҸҗл ҙ(lymphoid interstitial pneumonia), Birt-Hogg-DubГ© мҰқнӣ„кө°(Birt-Hogg-DubГ© [BHD] syndrome), кІҪмҮ„м№Ём°© м§Ҳнҷҳ(light chain deposition disease) л“ұмқҙ мһҲлӢӨ[6]. нҸҗлӮӯмў…мқҖ LAMмқҳ нҠ№м§•м Ғмқё лі‘ліҖмңјлЎң нқүл¶Җ HRCT кІҖмӮ¬м—җм„ң нҷ•мқёлҗҳл©°, м–ҮмқҖ лІҪмқ„ к°Җм§Җкі , л‘Ҙк·ј лӘЁм–‘мңјлЎң м–‘мӘҪ нҸҗм—җ кі лҘҙкІҢ 분нҸ¬н•ңлӢӨ. нҒ¬кё°лҠ” м§ҖлҰ„ 2 mmм—җм„ң 40 mmк№Ңм§Җ лӢӨм–‘н•ҳл©°, лӮҙл¶Җм—җ лӢӨлҘё кө¬мЎ°л¬јкіј кҙҖл Ёмқҙ м—Ҷм–ҙм„ң 비көҗм Ғ к№ЁлҒ—н•ҳкІҢ л‘ҳлҹ¬мӢём—¬ мһҲлӢӨ. мқҙлҹ¬н•ң нҠ№м§•л“ӨмқҖ LAM 진лӢЁм—җ мһҲм–ҙ нҠ№нһҲ мӨ‘мҡ”н•ң мҶҢкІ¬мқҙлӢӨ.
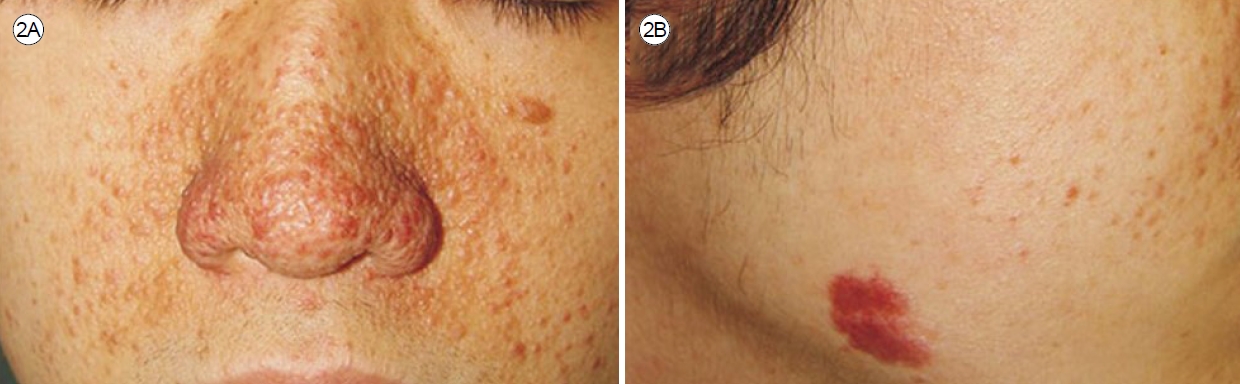
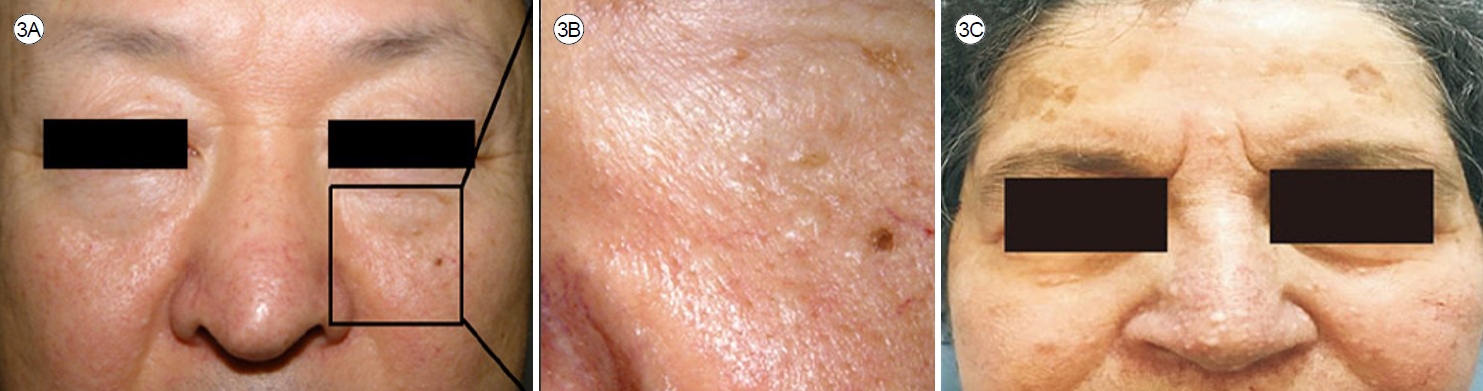
진лӢЁмқ„ мң„н•ҙ лӘЁл“ нҷҳмһҗм—җкІҢ нқЎм—° л°Ҹ м§Ғм—…л Ҙ мқҙл Ҙмқ„ нҷ•мқён•ҙм•ј н•ңлӢӨ. мӢ мІҙ кІҖмӮ¬м—җм„ңлҠ” лҢҖл¶Җ분 м •мғҒмқҙм§Җл§Ң мқјл¶Җ нҷҳмһҗлҠ” мІңлӘ…мқҢ, мҲҳнҸ¬мқҢ, ліөл¶Җ мў…м–‘ лҳҗлҠ” TSCмқҳ нҠ№м§•м Ғмқё мҰқмғҒмқ„ ліҙмқј мҲҳ мһҲлӢӨ[3]. 2/3мқҳ LAM нҷҳмһҗк°Җ нҳёнқЎ кіӨлһҖмқ„ кІҪн—ҳн•ҳл©°, нҳёнқЎкё° мҰқмғҒ мӨ‘м—җлҠ” кё°м№Ё, к°җм—ј л°Ҹ к°ҖмҠҙ нҶөмҰқкіј к°ҷмқҖ мҰқмғҒмқҙ м•Ҫ 25%м—җм„ң л°ңмғқн•ңлӢӨ. лҳҗн•ң к°қнҳҲмқҙлӮҳ лҰјн”„кҙҖмқҳ м—ӯлҘҳлЎң мқён•ң кё°м№Ё, н”јлЎңк°җ л“ұлҸ„ лӮҳнғҖлӮ мҲҳ мһҲлӢӨ[6]. TSCмқҳ н”јл¶Җ징нӣ„мқё м•Ҳл©ҙнҳҲкҙҖ섬мң мў…(angiofibroma, Fig. 2A), мғӨк·ёлҰ° л°ҳм җ(shagreen patch, Fig. 2B), мЎ°к°‘мЈјмң„섬мң мў…(periungual fibroma), л§қл§үм„ұ мғҒм„ёнҸ¬мў…(astrocytoma) л“ұмқҙ лӮҳнғҖлӮ мҲҳ мһҲмңјл©°[9] BHD мҰқнӣ„кө°мқҳ нҠ№м§•мқё м•Ҳл©ҙ섬мң лӘЁлӮӯмў…(fibrofolliculoma, Fig. 3A, B) л°Ҹ лӘЁмӣҗнҢҗмў…(trichodiscoma, Fig. 3C)кіј к°ҷмқҖ н”јл¶Җ 징нӣ„к°Җ кҙҖм°°лҗ мҲҳ мһҲлӢӨ[10,11]. лҳҗн•ң кІ°мІҙмЎ°м§Ғ м§Ҳнҷҳмқҳ мҶҢкІ¬мқ„ м°ҫм•„лӮҙкё° мң„н•ң мІ м Җн•ң мӢ мІҙ кІҖмӮ¬к°Җ н•„мҡ”н•ҳлӢӨ.
LAM нҷҳмһҗ мӨ‘ 1/3мқҖ кё°нқүмңјлЎң л°ңнҳ„н•ҳл©°, LAMм—җм„ңмқҳ кё°нқү л°ңмғқ л№ҲлҸ„лҠ” мқјл°ҳ м—¬м„ұ мқёкө¬м—җ 비н•ҙ 1,000л°° лҶ’мқҖ кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ. лҳҗн•ң LAM нҷҳмһҗмқҳ 50-80%к°Җ м§Ҳлі‘ кІҪкіј мӨ‘м—җ кё°нқүмқ„ кІҪн—ҳн•ҳл©°, мһ¬л°ңмқҙ л№ҲлІҲн•ҳкІҢ л°ңмғқн•ңлӢӨ[6].
нқүмҲҳлҠ” LAM нҷҳмһҗ мӨ‘ 10-30%м—җм„ң л°ңмғқн•ҳл©°, к·ёмӨ‘м—җм„ңлҸ„ мң лҜёнқүмқҙ к°ҖмһҘ нқ”н•ҳлӢӨ. мқҙлҹ¬н•ң нқүмҲҳлҠ” мЈјлЎң мқјмёЎ(76%)мқҙл©° мҡ°мёЎ(63.2%)м—җ лӮҳнғҖлӮҳм§Җл§Ң м–‘мёЎмңјлЎң л°ңмғқн• мҲҳлҸ„ мһҲлӢӨ. нқүмҲҳлҠ” лҰјн”„кө¬ мҡ°м„ёмқҳ мӮјм¶ңм•Ўмқҙл©° lactate dehydrogenaseліҙлӢӨ лӢЁл°ұм§Ҳмқҳ мҲҳм№ҳк°Җ лҚ” лҶ’кі кі мӨ‘м„ұм§Җл°©, мҪңл ҲмҠӨн…ҢлЎӨ л°Ҹ chylomicronsмҷҖ к°ҷмқҖ нҠ№м§•мқ„ к°Җ진лӢӨ[12].
мӢ мһҘ AMLмқҖ S-LAM нҷҳмһҗ мӨ‘ 30%м—җм„ң л°ңмғқн•ҳл©° TSC-LAM нҷҳмһҗ мӨ‘ мөңлҢҖ 80%м—җм„ң л°ңмғқн•ңлӢӨ[6,12]. S-LAMм—җм„ң AMLмқҖ мқјмёЎм„ұмқҙл©° лҢҖл¶Җ분 мҰқмғҒмқҙ м—Ҷкі , м–‘мёЎм„ұмқё кІҪмҡ° мЈјлЎң TSCмҷҖ кҙҖл Ёмқҙ мһҲлӢӨ. мӢ мһҘ AMLмқҖ ліөл¶Җ CT мҠӨмә”м—җм„ң нҷ•мқён• мҲҳ мһҲлӢӨ. AMLлЎң мқён•ң м¶ңнҳҲмқҖ мҶҢмҲҳмқҳ LAM нҷҳмһҗм—җм„ң мҰқмғҒмңјлЎң лӮҳнғҖлӮ мҲҳ мһҲмңјл©°, мҰқмғҒмқҙ лӮҳнғҖлӮ л•Ң нҷҳмһҗлҠ” л§Ңм ём§ҖлҠ” ліөл¶Җ мў…кҙҙлӮҳ ліөнҶөмқ„ нҳёмҶҢн•ңлӢӨ[12].
лҰјн”„кҙҖнҸүнҷңк·јмў…(lymphangioleiomyomas)мқҖ LAM нҷҳмһҗ мӨ‘ 16%м—җм„ң 38%к№Ңм§Җ лӮҳнғҖлӮҳл©°, л¬ҙмҰқмғҒмқҙкұ°лӮҳ мң„м№ҳм—җ л”°лқј кҙҖл Ё мҰқмғҒ(нҶөмҰқ, н•ҳм§Җл¶Җмў…, ліөл¶ҖнҢҪл§Ң л“ұ)мқҙ лӮҳнғҖлӮ мҲҳ мһҲлӢӨ. лҰјн”„м Ҳ 비лҢҖ(lymphadenopathy)лҠ” мЈјлЎң кіЁл°ҳмқҙлӮҳ нӣ„ліөл§ү л¶Җмң„м—җм„ң лӮҳнғҖлӮҳл©°, LAM нҷҳмһҗ мӨ‘ 25%м—җм„ң 77%к№Ңм§Җ лӮҳнғҖлӮ мҲҳ мһҲлӢӨ. лҰјн”„м Ҳ비лҢҖлҠ” мӨ‘мҰқлҸ„мҷҖ м—°кҙҖмқҙ мһҲлӢӨ[12].
LAMмқҳ лі‘лҰ¬н•ҷм Ғ 진лӢЁмқҖ нҸҗ, лҰјн”„м Ҳ лҳҗлҠ” мІҙм•Ўм—җм„ң м„ёнҸ¬н•ҷм ҒмңјлЎң LAM м„ёнҸ¬лҘј нҷ•мқён•ҙм•ј н•ңлӢӨ. нҸҗмЎ°м§Ғм—җм„ң LAMмқҳ нҠ№м§•м Ғмқё лі‘лҰ¬н•ҷм Ғ нҠ№м§•мқҖ лӢӨм–‘н•ң нҒ¬кё°мқҳ лӢӨмҲҳмқҳ нҸҗлӮӯм„ұ л°Ҹ LAM м„ёнҸ¬мқҳ мҰқмӢқмқ„ нҸ¬н•Ён•ңлӢӨ. мқҙлҹ¬н•ң LAM м„ёнҸ¬лҠ” нҳҲкҙҖ нҸүнҷңк·јкіј мң мӮ¬н•ҳкІҢ ліҙмқҙл©°, л©ңлқјлӢҢм„ёнҸ¬ н‘ңм§Җмһҗ(HMB-45, Melan-A, tyrosinase, microphthalmia transcription factor, NKI/C3) л°Ҹ к·јмңЎ н‘ңм§Җмһҗ(smooth muscle actin, pan-muscle actin, muscle myosin, calponin)мҷҖ м–‘м„ұ л°ҳмқ‘мқ„ лӮҳнғҖлӮёлӢӨ[12].
лҜёкөӯнқүл¶Җн•ҷнҡҢмҷҖ мқјліёнҳёнқЎн•ҷнҡҢмқҳ LAM 진лӢЁ л°Ҹ кҙҖлҰ¬ м§Җм№Ём—җ л”°лҘҙл©ҙ, LAMмқҳ нҷ•м§„мқҖ мһ„мғҒм Ғ нҠ№м§•, мҳҒмғҒ кІҖмӮ¬ л°Ҹ нҳҲм•Ў кІҖмӮ¬ кІ°кіјлҘј мЎ°н•©н•ҳм—¬ мҲҳн–үлҗңлӢӨ[13].
LAMм—җ н•©лӢ№н•ң мһ„мғҒ лі‘л ҘмқҖ мЈјлЎң м ҠмқҖ м—¬м„ұ лҳҗлҠ” мӨ‘л…„ м—¬м„ұм—җм„ң нҳёнқЎ кіӨлһҖ, кё°нқү, нқүмҲҳ л“ұмқҳ мҰқмғҒмқ„ ліҙмқҙл©°, лӢӨлҘё лӮӯм„ұ нҸҗм§Ҳнҷҳкіј кҙҖл Ёлҗң мҰқмғҒ, мҳҲлҘј л“Өм–ҙ лҲҲкіј мһ…мқҳ кұҙмЎ° мҰқмғҒ, кІ°мІҙ мЎ°м§Ғ м§Ҳнҷҳ кҙҖл Ё мҶҢкІ¬, мғҒлӢ№н•ң нқЎм—°л Ҙ, TSC мҷё м–јкөҙ н”јл¶Җ лі‘ліҖмқҳ к°ңмқё л°Ҹ к°ҖмЎұл Ҙ, лҳҗлҠ” мӢ мһҘ мў…м–‘мқҳ лі‘л Ҙмқҙ м—Ҷм–ҙм•ј н•ңлӢӨ.
LAMмқҳ 진лӢЁмқҖ кё°ліём ҒмңјлЎң LAMм—җ н•©лӢ№н•ң лі‘л Ҙмқ„ к°Җ진 мһҗм—җм„ң HRCTлҘј нҶөн•ҙ нҠ№м§•м Ғмқё нҸҗлӮӯм„ұ ліҖнҷ”лҘј нҷ•мқён•ЁмңјлЎңмҚЁ мқҙлЈЁм–ҙ진лӢӨ. мқҙлҹ¬н•ң мЎ°кұҙмқ„ 충мЎұн•ҳлҠ” нҷҳмһҗ мӨ‘м—җм„ң TSCмқҳ лҸҷл°ҳ м—¬л¶Җ, мӢ мһҘ AMLмқҳ лҸҷл°ҳ, лҶ’мқҖ лҶҚлҸ„мқҳ VEGF-D (вүҘ 800 pg/mL), мң лҜём„ұ м•ЎмІҙ 축м Ғ, CTм—җм„ң м „нҳ•м Ғмқё лҰјн”„кҙҖ м№ЁлІ” мӨ‘ н•ҳлӮҳ мқҙмғҒмқҙ кҙҖм°°лҗ л•Ң LAMмқҳ мһ„мғҒм Ғ нҷ•м§„мқҙ к°ҖлҠҘн•ҳлӢӨ[13].
LAMмқҳ 진лӢЁмқҖ к°ҖлҠҘн•ң м№ЁмҠөм Ғмқҙм§Җ м•ҠмқҖ л°©лІ•мқ„ мӮ¬мҡ©н•ҳм—¬ мҲҳлҰҪлҗҳм–ҙм•ј н•ңлӢӨ(Fig. 4). нқүл¶Җ HRCTм—җм„ң кІҪлҜён•ң лӮӯмў… ліҖнҷ”л§Ң ліҙмқҙкі л¬ҙмҰқмғҒмқё нҷҳмһҗмқҳ кІҪмҡ°, м№ЁмҠөм Ғ кІҖмӮ¬лҘј кі л Өн•ҳкё° м „м—җ нҷҳмһҗк°Җ мһ мһ¬м Ғмқё LAM 진лӢЁ мҲҳмҡ© м—¬л¶ҖлҘј нҷ•мқён•ҙм•ј н•ңлӢӨ. л§Ңм•Ҫ нҷҳмһҗк°Җ мһ мһ¬м Ғ LAM 진лӢЁмқ„ мҲҳмҡ©н•ңлӢӨл©ҙ м •кё°м Ғмқё 추м Ғ кҙҖм°°л§ҢмңјлЎңлҸ„ м§Ҳлі‘мқ„ лӘЁлӢҲн„°л§Ғн• мҲҳ мһҲлӢӨ. HRCTлҠ” к°„м§Ҳм„ұ нҸҗм§Ҳнҷҳмқҳ нҸҗлі‘ліҖмқ„ 진лӢЁн•ҳлҠ” лҚ° 비침мҠөм Ғмқҙкі м •нҷ•н•ң кІҖмӮ¬лЎң, LAMмқҙ мқҳмӢ¬лҗҳлҠ” нҷҳмһҗм—җкІҢлҠ” 1м°Ё кІҖмӮ¬лЎң мӮ¬мҡ©лҗңлӢӨ. к·ёлҹ¬лӮҳ HRCTм—җм„ң LAMмқҳ нҠ№м§•м Ғмқё м–‘мғҒмқҙ лӮҳнғҖлӮҳм§Җл§Ң 추к°Җм Ғмқё LAM 진лӢЁ нҠ№м§•мқҙ м—ҶлҠ” кІҪмҡ°м—җлҠ” HRCT кІ°кіјл§Ңмқ„ кё°л°ҳмңјлЎңлҠ” лӮ®мқҖ нҠ№мқҙлҸ„лҘј ліҙмқҙкё° л•Ңл¬ём—җ LAMмқҳ нҷ•м • 진лӢЁмқ„ лӮҙлҰ¬м§Җ м•Ҡкё°лҘј к¶ҢмһҘн•ңлӢӨ. л”°лқјм„ң кё°лҠҘм Ғ м Җн•ҳлӮҳ н•©лі‘мҰқмқҙ лҸҷл°ҳлҗҳм–ҙ mTOR м–өм ңм ңмқё м•Ҫл¬ј м№ҳлЈҢлҘј мӮ¬мҡ©н•ҳкё° м „м—җлҠ” LAM нҷ•м§„мқ„ мң„н•ң мЎ°м§Ғ кІҖмӮ¬к°Җ н•„мҡ”н•ҳлӢӨ. мқҙлҹ¬н•ң кІҪмҡ° мҲҳмҲ м Ғ мЎ°м§Ғ кІҖмӮ¬м—җ 비н•ҙ лҚң м№ЁмҠөм Ғмқё BFS-TBLBлҘј лЁјм Җ мӢңн–ү нӣ„ кІ°кіјм—җ л”°лқј н•„мҡ”мӢң мҲҳмҲ м Ғ мЎ°м§Ғ кІҖмӮ¬лҘј кі л Өн• мҲҳ мһҲлӢӨ.
LAMмқҳ м№ҳлЈҢлІ•мқҖ мҰқмғҒмқҳ мӢ¬к°Ғм„ұкіј нҷҳмһҗмқҳ мғҒнғңм—җ л”°лқј лӢӨлҘј мҲҳ мһҲлӢӨ. м•Ҫл¬ј м№ҳлЈҢлЎңлҠ” mTOR м–өм ңм ң мӨ‘ н•ҳлӮҳмқё sirolimusлҘј кі л Өн• мҲҳ мһҲлӢӨ. Multicenter international lymphangioleiomyomatosis efficacy and safety of sirolimus (MILES) мһ„мғҒмӢңн—ҳ кІ°кіјм—җ л”°лҘҙл©ҙ, sirolimusлҘј ліөмҡ©н•ң нҷҳмһҗкө°мқҖ лҢҖмЎ°кө°м—җ 비н•ҙ FEV1мқ„ нҸ¬н•Ён•ҳм—¬ FVC, кё°лҠҘм Ғ мһ”кё°лҹү, нҳҲмІӯ VEGF-D, мӮ¶мқҳ м§Ҳ м§Җн‘ң(EQ-VAS м җмҲҳ)к°Җ нҳём „лҗҳм—ҲлӢӨ. к·ёлҹ¬лӮҳ 6분 лҸ„ліҙ кІҖмӮ¬ кұ°лҰ¬лӮҳ DLCOлҠ” л‘җ к·ёлЈ№ к°„м—җ мң мқҳн•ң м°Ёмқҙк°Җ лӮҳнғҖлӮҳм§Җ м•Ҡм•ҳлӢӨ[14]. MILES н•ҳмң„ 분м„қ кІ°кіјм—җ л”°лҘҙл©ҙ, нҸҗкІҪ м „ нҷҳмһҗмқҳ FEV1 к°җмҶҢ мҶҚлҸ„к°Җ нҸҗкІҪ нӣ„ нҷҳмһҗм—җ 비н•ҙ 5л°° л№Ёлһҗмңјл©°, нҳҲмІӯ VEGF-Dк°Җ 600 мҙҲкіјмқё кІҪмҡ° FEV1 к°җмҶҢк°Җ лҚ” л№Ёлһҗм§Җл§Ң sirolimus м№ҳлЈҢм—җ лҚ” мһҳ л°ҳмқ‘н–ҲлӢӨ. к·ёлҹ¬лӮҳ нҸҗкІҪ м—¬л¶Җ, мқёмў…, кё°кҙҖм§Җнҷ•мһҘм ң л°ҳмқ‘м„ұ, кё°м Җ FEV1, TSC лҸҷл°ҳ м—¬л¶ҖлҠ” FEV1 к°җмҶҢм—җ мҳҒн–Ҙмқ„ лҜём№ҳм§Җ м•Ҡм•ҳмңјл©°, sirolimus м№ҳлЈҢлҠ” мқҙлҹ¬н•ң мҡ”мқёкіј мғҒкҙҖм—Ҷмқҙ FEV1 к°җмҶҢлҘј м•Ҳм •нҷ”мӢңмј°лӢӨ[15]. Sirolimus мӮ¬мҡ©мқҖ 3.5л…„ мқҙмғҒмқҳ мһҘкё°м Ғ 추м Ғм—җм„ңлҸ„ м•Ҳм •м„ұмқҙ мһ…мҰқлҗҳм—Ҳм§Җл§Ң л¶Җмһ‘мҡ©мқҙ лӮҳнғҖлӮ мҲҳ мһҲмңјл©° м§Ҳлі‘ мҷ„м№ҳлҘј лӘ©н‘ңлЎң н•ҳм§Җ м•ҠмңјлҜҖлЎң м§Ҳлі‘ 진н–ү мң„н—ҳмқҙ лҶ’мқҖ нҷҳмһҗлҘј мӢ мӨ‘н•ҳкІҢ м„ лі„н•ҳкі м№ҳлЈҢ мӢңкё°лҘј кІ°м •н•ҙм•ј н•ңлӢӨ. нҸҗкё°лҠҘмқҙ м •мғҒ лҳҗлҠ” кІҪлҸ„ м Җн•ҳлҗң нҷҳмһҗлҠ” мЈјлЎң 추м Ғ кҙҖм°°мқҙ к¶ҢмһҘлҗңлӢӨ. к·ёлҹ¬лӮҳ мӨ‘л“ұлҸ„ FEV1 м Җн•ҳк°Җ мһҲкұ°лӮҳ FEV1мқҙ кёүмҶҚн•ҳкІҢ к°җмҶҢн•ҳкұ°лӮҳ chylous diseaseлӮҳ лҰјн”„кҙҖнҸүнҷңк·јмў…кіј к°ҷмқҖ нҸҗмҷё н•©лі‘мҰқмқҙ лҸҷл°ҳлҗң кІҪмҡ° sirolimus м№ҳлЈҢлҘј кі л Өн• мҲҳ мһҲлӢӨ[7]. лӢӨл§Ң көӯлӮҙм—җм„ңлҠ” sirolimus нҲ¬м•Ҫ мӢң FEV1мқҙ 70% мқҙн•ҳмқё кІҪмҡ°м—җл§Ң кёүм—¬ кё°мӨҖмқҙ лҗҳлҜҖлЎң, м№ҳлЈҢ мӢңмһ‘ мӢң нҷҳмһҗмқҳ FEV1 мҲҳм№ҳмҷҖ мҰқмғҒмқ„ кі л Өн•ҙм•ј н•ңлӢӨ. LAM нҷҳмһҗ мӨ‘ 70% мқҙмғҒмқҙ н•ң лІҲ мқҙмғҒ кё°нқүмқ„ кІҪн—ҳн• к°ҖлҠҘм„ұмқҙ лҶ’мңјл©° мһ¬л°ң мң„н—ҳмқҙ лҶ’лӢӨ. л”°лқјм„ң мІ« лІҲм§ё кё°нқү л°ңмғқ мқҙнӣ„ нқүл§үмң м°©мҲ (pleurodesis)мқ„ кі л Өн•ҙм•ј н•ңлӢӨ. мқҙм „ нқүл§ү кҙҖл Ё мӢңмҲ мқҖ нҸҗ мқҙмӢқм—җ лҢҖн•ң кёҲкё°к°Җ м•„лӢҲл©°, мһҘкё°м ҒмңјлЎң нҸҗ мқҙмӢқмқҙ н•„мҡ”н•ң кІҪмҡ° мҲҷл Ёлҗң нқүл¶Җмҷёкіј мқҙмӢқ м „л¬ёмқҳмҷҖ мғҒлӢҙмқҙ н•„мҡ”н•ҳлӢӨ[13]. нҳёлҘҙлӘ¬ м№ҳлЈҢлҠ” нҡЁкіјк°Җ м—Ҷмңјл©° мқјл°ҳм ҒмңјлЎң мӮ¬мҡ©лҗҳм§Җ м•ҠлҠ”лӢӨ. лҳҗн•ң мӮ°мҶҢ м№ҳлЈҢ л°Ҹ нҳёнқЎ мһ¬нҷңмқҙ н•„мҡ”н•ң кІҪмҡ°лҸ„ мһҲмңјл©°, мӨ‘мҰқ м§Ҳнҷҳм—җм„ңлҠ” нҸҗ мқҙмӢқмқ„ кі л Өн• мҲҳ мһҲлӢӨ[13].
LAMмқҖ мЈјлЎң м—¬м„ұм—җкІҢ л“ңл¬јкІҢ л°ңмғқн•ҳлҠ” м§ҲнҷҳмңјлЎң нҸҗмӢӨм§Ҳ нҢҢкҙҙмҷҖ лӮӯмў… нҳ•м„ұмқҙ нҠ№м§•мқҙлӢӨ. LAMмқҖ мӨ‘추лҰјн”„кҙҖм—җлҸ„ мҳҒн–Ҙмқ„ лҜём№ҳл©° мң мІҙк°Җ к°Җл“қн•ң лӮӯм„ұ кө¬мЎ°л¬ј нҳ•м„ұкіј ліөл¶Җ м№ЁлІ”, мӢ мһҘ AMLкіј к°ҷмқҖ ліөк°• лӮҙ мһҘкё° м№ЁлІ”лҸ„ к°ҖлҠҘн•ҳлӢӨ. LAMмқҖ мӮ°л°ңм ҒмңјлЎң лӮҳнғҖлӮ мҲҳлҸ„ мһҲкі , TSCмҷҖ м—°кҙҖлҗ мҲҳ мһҲлӢӨ. LAMмқҳ 진лӢЁмқҖ мһ„мғҒм Ғ, мҳҒмғҒн•ҷм Ғ, нҳҲм•Ўн•ҷм Ғ кІҖмӮ¬ кІ°кіјлҘј мЎ°н•©н•ҳм—¬ мқҙлЈЁм–ҙм§Җл©°, м№ҳлЈҢлҠ” мҰқмғҒкіј нҷҳмһҗ мғҒнғңм—җ л”°лқј лӢӨм–‘н• мҲҳ мһҲлӢӨ. м•Ҫл¬ј м№ҳлЈҢлЎңлҠ” mTOR м–өм ңм ң нҲ¬м•Ҫмқ„ кі л Өн•ҳл©°, 비м•Ҫл¬јм Ғ м№ҳлЈҢлЎңлҠ” нҳёнқЎ мһ¬нҷң л°Ҹ нҸҗ мқҙмӢқмқ„ кі л Өн• мҲҳ мһҲлӢӨ.
REFERENCES
1. Gupta N, Vassallo R, Wikenheiser-Brokamp KA, McCormack FX. Diffuse cystic lung disease. Part I. Am J Respir Crit Care Med 2015;191:1354вҖ“1366.



2. McCormack FX, Travis WD, Colby TV, Henske EP, Moss J. Lymphangioleiomyomatosis: calling it what it is: a low-grade, destructive, metastasizing neoplasm. Am J Respir Crit Care Med 2012;186:1210вҖ“1212.



3. Moss J, Avila NA, Barnes PM, et al. Prevalence and clinical characteristics of lymphangioleiomyomatosis (LAM) in patients with tuberous sclerosis complex. Am J Respir Crit Care Med 2001;164:669вҖ“671.


4. Cudzilo CJ, Szczesniak RD, Brody AS, et al. Lymphangioleiomyomatosis screening in women with tuberous sclerosis. Chest 2013;144:578вҖ“585.


5. Harknett EC, Chang WY, Byrnes S, et al. Use of variability in national and regional data to estimate the prevalence of lymphangioleiomyomatosis. QJM 2011;104:971вҖ“979.


6. Ryu JH, Moss J, Beck GJ, et al. The NHLBI lymphangioleiomyomatosis registry: characteristics of 230 patients at enrollment. Am J Respir Crit Care Med 2006;173:105вҖ“111.


7. Young L, Lee HS, Inoue Y, et al. Serum VEGF-D a concentration as a biomarker of lymphangioleiomyomatosis severity and treatment response: a prospective analysis of the multicenter international lymphangioleiomyomatosis efficacy of sirolimus (MILES) trial. Lancet Respir Med 2013;1:445вҖ“452.


8. Gupta N, Lee HS, Ryu JH, et al. The NHLBI LAM registry: prognostic physiologic and radiologic biomarkers emerge from a 15-year prospective longitudinal analysis. Chest 2019;155:288вҖ“296.


9. Seo JY, Kim A, Baek YS, Jeon J. Successful long-term multimodality management of facial lesions in tuberous sclerosis complex in an adult patient. Ann Dermatol 2023;35 Suppl 2:S243вҖ“S246.

10. Hasal E, Baskan EB, Gul S, et al. Birt-Hogg-DubГ© syndrome: diagnostic journey of three cases from skin to gene. Ann Dermatol 2022;34:66вҖ“71.



11. Shin WW, Baek YS, Oh TS, et al. Birt-Hogg-DubГ© syndrome, a rare case in Korea confirmed by genetic analysis. Ann Dermatol 2011;23 Suppl 2:S193вҖ“S196.

12. O'Mahony AM, Lynn E, Murphy DJ, Fabre A, McCarthy C. Lymphangioleiomyomatosis: a clinical review. Breathe (Sheff) 2020;16:200007.


13. Gupta N, Finlay GA, Kotloff RM, et al. Lymphangioleiomyomatosis diagnosis and management: high-resolution chest computed tomography, transbronchial lung biopsy, and pleural disease management. An Official American Thoracic Society/ Japanese Respiratory Society clinical practice guideline. Am J Respir Crit Care Med 2017;196:1337вҖ“1348.


Computed tomography (CT) scan reveals numerous predominantly small, round, thinly-walled cysts diffusely distributed throughout both lungs (A). Additionally, multiple enlarged lymph nodes are observed in the aortocaval, para-aortic, and right external iliac area (arrows) (B).
FigureВ 1.
Skin manifestations of tuberous sclerosis complex. (A) Angiofibroma and (B) shagreen patch. Multiple erythematous to flesh-colored papules, nodules, and plaques on the face, particularly the nose and perinasal area. Adopted from Seo et al. [9] with permission.
FigureВ 2.
Proposed algorithm for the diagnosis of lymphangioleiomyomatosis (LAM) in a patient with compatible clinical history. The algorithm is designed as a step-wise, least-invasive approach to confirm the diagnosis of LAM. Modifications based on clinical judgment are often necessary, and diagnostic decisions should be tailored to each individual. Adopted from Gupta et al. [13] with permission. HRCT, high resolution computed tomography; TSC, tuberous sclerosis complex; VEGF-D, vascular endothelial growth factor-D; CT, computed tomography; MRI, magnetic resonance imaging; PFT, pulmonary function tests.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




