 |
 |
| Korean J Med > Volume 98(2); 2023 > Article |
|
요약
급성 고탄산 호흡부전은 진단되지 않은 중증근무력증의 초기 증상 중 하나일 수 있다. 근무력증 위기는 중증근무력증 환자의 15% 정도에서 발생하나 대부분 진단 후 발현하며 첫 증상으로 발현하는 경우는 드물다. 하지만 저자들은 경증의 폐렴 환자에서 급성 호흡부전이 발생하여 중증근무력증으로 진단된 예를 경험하였다. 따라서 안검하수, 복시 및 근력 약화 등의 전형적인 증상 없이 단순히 가벼운 쇠약감이나 운동 실조 등이 있는 환자에서 급성 호흡부전이 발생하면, 특히 고탄산형이면서 경증의 폐렴이나 쇼크 등이 동반된 환자에서는 중증근무력증을 반드시 의심하여야 한다. 조기 진단을 통해 IVIG 등 적극적인 치료로 사망률을 줄이고 빠른 회복을 통해 입원 치료 기간을 줄일 수 있을 것으로 생각된다.
Abstract
Myasthenic crisis, which can be life-threatening due to severe respiratory failure, occurs in 15-20% of patients with myasthenia gravis. However, the crisis often develops within 1-2 years after diagnosis and is very rare as a first symptom of myasthenia gravis; isolated sudden-onset hypercapnic respiratory failure without other symptoms of myasthenia gravis is even rarer. A 63-year-old woman presented to the emergency department with fever and dizziness. Chest computed tomography showed multifocal peribronchial ground-glass opacities, and a diagnosis of pneumonia was made. Initially, the patient did not have dyspnea. However, she developed acute hypercapnic respiratory failure and was intubated. After mechanical ventilation, her hypercapnia improved initially, but worsened on initiation of weaning from the ventilator. As she had a high acetylcholine receptor antibody titer, myasthenia gravis was diagnosed. Her hypercapnia improved after treatment with pyridostigmine and methylprednisolone.
중증근무력증은 최근 증가하는 경향을 보이고 있는 질병으로, 100만 명당 1.7-21.3명의 발병률과 10만 명당 12.4명의 유병률을 보이며, 특히 노인에서 증가하는 질환으로 알려져 있다[1,2]. 복시, 안검하수 및 근력 약화가 흔한 증상이나 중증근 무력증 환자의 15-20% 정도에서는 심한 호흡장애로 인해 생명을 위협할 수 있는 근무력증 위기가 발생하기도 한다[3,4]. 하지만 근무력증 위기는 대부분 진단 후 치료 경과 1-2년 중에 발현하며, 초기 증상으로는 드물다[4]. 특히 중증근무력증의 다른 증상 없이 단일 급발성 고탄산 호흡부전만으로 발현하는 경우는 더욱 드물다. 저자들은 경증의 폐렴 치료 도중 단일 급발성 고탄산 호흡부전이 발생하여 중증근무력증으로 진단된 환자를 경험하였기에 이에 대해 보고하고자 한다.
63세 여자 환자가 내원 당일부터 발생한 발열과 어지럼증으로 응급실에 내원하였다. 4일 전부터 미열이 있으면서 조금씩 기력이 저하되었고 식사량이 감소하였다. 기침 및 가래 등 호흡기 증상은 호소하지 않았다. 5년 전 당뇨 및 고지질혈증을 진단받았으나 최근 3년간 치료받지 않았으며, 내원 전까지 혼자 살면서 일상생활이 가능하였고 활동에 문제가 없었다. 흡연력 및 천식 등의 만성 호흡기 질환은 없었으며 오염 환경에 노출된 과거력도 없었다.
이학적 소견: 초기 활력징후는 혈압 130/80 mmHg, 맥박수 94회/분, 호흡수 20회/분, 체온 38.6°C였다. 응급실 내원 당시 pulse oximetry (SpO2)가 89-91%여서 비강 캐뉼라 2 L/min로 흡입하도록 하여 SpO2가 98-99% 유지되었다. 의식 상태는 정상이었으며 신경학적 검사에서 대뇌 및 소뇌 기능 그리고 사지 활력도 정상이었다. 흉부 청진 소견은 정상이었고 이외 특이 소견은 없었다.
검사 소견: 말초혈액 검사에서 백혈구 수는 20,250/μL, 헤모글로빈 15.2 g/dL, 혈소판 수는 304,000/μL였다. 적혈구 침강속도는 8 mm/h, 고감도 C-반응단백은 9.63 mg/dL, 혈당은 179.5 mg/dL, 총 콜레스테롤은 257.4 mg/dL였다. 심장표지자 등 기타 검사 소견은 정상이었다.
방사선학적 소견: 흉부 엑스선 검사는 정상 소견이었고 (Fig. 1), 흉부 전산화단층촬영에서 폐색전증 소견은 없었다. 다발성 기관지 주위 간유리음영이 우중엽과 우하엽에 국소적으로 확인되었으며, 폐기종 등의 만성 폐쇄성 폐질환을 의심할 만한 소견은 없었다(Fig. 2). 뇌 전산화단층촬영 소견은 정상이었다.
치료 및 경과: 입원하여 항생제 치료를 시작하였고 비강캐뉼라 4 L/min로 산소 흡입하였다. 입원 1일째 호흡 곤란은 없었으며, SpO2는 98-100%로 유지되었다. 입원 2일째 오전 6시 동맥혈가스 분석 결과 pH 7.23, 동맥혈탄산가스분압(PaCO2) 88.0 mmHg, 동맥혈산소분압(PaO2) 230.2 mmHg, HCO3 36.2 mEq/L, SaO2 99.3%로(Table 1) 비강 캐뉼라 2 L/min로 감량하였다. 감량 4시간 후 호흡이 약해지면서 SpO2 및 혈압이 측정되지 않았다. 오전 10시 54분 당시 동맥혈가스 분석 결과 pH 7.05, PaCO2 119.4 mmHg, PaO2 75.2 mmHg, HCO3 32.4 mEq/L, SaO2 85.8%로 급성 고탄산 호흡부전 소견을 보였다. 이후 심폐소생술 및 기관 내 삽관 후 중환자실로 전실되었다.
기계환기 적용 후 고탄산혈증은 호전되었고 묻는 말에 고개를 끄덕이는 등 신경학적 이상은 없었다. 입원 5일째부터 기계환기 이탈을 시도하였으며, 입원 8일째까지는 잘 견뎠으나 기계환기 호흡수를 줄이면 자가 호흡이 약해지면서 호흡곤란을 호소하였고 동맥혈가스 분석 결과 pH 7.25, PaCO2 80.4 mmHg, PaO2 72.3 mmHg, HCO3 34.5 mEq/L, SaO2 92.7% 로(Table 1) 근육 피로감으로 인해 지친 것으로 판단하고 호흡수를 올리고 서서히 기계환기 이탈을 시도하기로 하였다. 입원 15일째 천식 또는 만성 폐쇄성 폐질환 가능성을 고려하여 스테로이드 정주(메틸프레드니솔론 40 mg/day)를 추가하였으나 일시적으로 호전되다가 증세가 악화되었고, 입원 18일째 중증근무력증을 의심하여 아세틸콜린 수용체 항체 검사를 시행하였다.
입원 27일째 의식이 혼수로 악화되었고 고탄산혈증이 기계환기 조작으로 호전되지 않았으며 PaCO2가 100 mmHg 이상으로 증가하고 pH가 6.8 전후로 감소하면서 쇼크가 발생하였다(Table 1). 중탄산염나트륨으로 산혈증을 교정하고 노르에피네프린 정주로 혈압을 유지하려 하였으나 잘 되지 않았다.
입원 29일째 아세틸콜린 수용체 항체 양성(11.80 nmol/L, 정상: <0.5 nmol/L) 확인되어 중증근무력증으로 진단하였다. 응급실 내원하여 시행한 흉부 전산화단층촬영에서 흉선종 소견은 없었고(Fig. 2B) 갑상선기능 검사는 정상이었다. 이후 4일간 8시간마다 pyridostigmine bromide 60 mg + 메틸프레드니솔론 500 mg/day 병합 치료를 시작하였고, 정맥 주사용 면역글로불린(intravenous immunoglobulin, IVIG)을 병행 치료 하려 했으나 보호자가 거부하였다. 치료 3일째(입원 31일째) pH 7.54, PaCO2 39.7 mmHg, PaO2 128.0 mmHg, HCO3 33.5 mEq/L, SaO2 98.8%로(Table 1) 산혈증이 호전되었다. 보호자 사정으로 인해 치료 9일째(입원 37일째) 기계환기를 유지하면서 상급 병원으로 전원하였고 이후 IVIG 치료를 병행하여 전원 7일 후에 기계환기 이탈이 가능하였다.
본 증례는 중증근무력증을 의심할 수 있는 증상 없이 단일 급발성 고탄산 호흡부전으로 발현하여 근무력증 위기로 진단된 경우이다. 최근 중증근무력증 진단이 증가하면서 초기 증상으로 호흡부전을 동반한 근무력증 위기가 보고되고 있다[5-7]. 하지만 근무력증 위기는 다수의 경우 중증근무력증 치료 경과 도중 발현하고, 첫 증상이더라도 대부분 의심되는 전구 증상이 동반되며, 단일 고탄산 호흡부전은 흔치않다[4]. 또한 급성 호흡부전이더라도 대부분 수일에 걸쳐 서서히 발생한다. 대부분 보고된 단일 근무력증 위기 환자들은 2-3일에 거쳐 서서히 진행된 경우이며 본 증례와 같이 입원 24시간 이내 고탄산 호흡부전이 기계환기를 필요할 정도로 급속히 진행된 예는 없었다[8]. 이런 경우에는 병력 청취 등이 어려워 중증근무력증을 의심하기 어려울 수 있다.
본 증례의 경우 적절한 치료에도 불구하고 기계환기 이탈이 어려워 입원 18일째 중증근무력증을 의심하여 아세틸콜린 수용체 항체 검사를 시행하여 중증근무력증 진단 후 치료하였다. 만약 조기에 근무력증을 의심하여 진단했다면 환자 또는 보호자와의 소통이 더욱 원만하게 되고, 기계환기 및 중환자실 재원 기간을 훨씬 단축시킬 수 있었을 것으로 생각된다.
중증근무력증은 신경근 접합부의 아세틸콜린 수용체를 차단하는 자가항체가 형성되어 발병하는 골격근의 위약감을 특징으로 하는 만성 자가면역신경근 질환이다[9]. 과거에는 근무력증 위기가 초기 증상으로 매우 드물었다고 하나, Dushay 등[5]과 Mier 등[6]이 호흡부전을 중증근무력증의 첫 증상으로 보고한 이후 많은 보고가 있었다. Qureshi 등[7]은 중증근무력증을 진단받지 않은 환자들에서 첫 증상이 호흡부전으로 발현된 경우들을 분석하였는데, 조사된 중증근무력증 환자 52명 중 8명(15.3%)이 이에 해당되었다고 보고하였고, 10년간의 다기관 연구 보고에서 근무력증 위기 환자 250명 중 54명(21.6%)이 첫 증상으로 호흡부전이 발현된 경우였다고 보고하여, 적지않음을 알 수 있다[8]. 그러나 첫 증상이더라도 대부분 의심되는 전구 증상이 동반되는 경우가 많아 단일 근무력증 위기로 발현된 증례는 드물다.
호흡부전이 첫 증상으로 발현된 근무력증 위기 환자에서 어느 정도가 단일 호흡부전으로 발현되는지에 대해 정확히 보고된 바는 없다. Qureshi 등[7]의 보고에서 8명 중 7명(87.5%)은 초기 진찰에서 중증근무력증이 의심되는 안구 혹은 연수 마비 증상이 있었으며, 5명(62.5%)은 이미 설명되지 않는 호흡부전 증상을 가지고 있었다. 그리고 8명 중 1명(12.5%)만이 단일 호흡부전이 있었다. 중증근무력증 환자의 사망률은 1960년 초반에는 40%로 매우 높았으나 2019년 대규모 연구에서는 사망률이 5-12% 정도로 현저히 감소하였다. 이는 IVIG 등 여러 치료약제 개발과 더불어 전형적인 증상 없이 급성 호흡부전으로 발현하는 중증근무력증의 조기 진단이 중요한 역할을 했다고 여겨진다. 따라서 조기 진단은 근무력증 위기의 사망률 감소에 있어 중요할 수 있다.
단일 근무력증 위기로 발현하는 중증근무력증 환자는 10만명당 1명 미만으로 상당히 드물다고 할 수 있다. 하지만 중증근무력증의 전구 증상이 없더라도, 설명되지 않는 호흡부전 환자에서 근무력증 위기를 감별진단에 포함시켜야 한다. 즉 호흡기나 심장 등의 특별히 의심되는 질환 없이 급성 고탄산 호흡부전이 발생한 경우, 특히 본 증례와 같이 경증의 폐렴으로 입원한 환자나 비특이적인 쇠약감 및 운동력 감소 등이 있는 환자에서 쇼크가 동반된 경우 근무력증 위기를 의심해야 하며, 아세틸콜린 수용체 항체 검사나 edrophonium 검사 등을 가능하면 조기에 시행하여 근무력증 여부를 확인해야 한다.
REFERENCES
1. Bubuioc AM, Kudebayeva A, Turuspekova S, Lisnic V, Leone MA. The epidemiology of myasthenia gravis. J Med Life 2021;14:7–16.



2. Salari N, Fatahi B, Bartina Y, et al. Global prevalence of myasthenia gravis and the effectiveness of common drugs in its treatment: a systematic review and meta-analysis. J Transl Med 2021;19:516.



3. Estephan EP, Baima JPS, Zambon AA. Myasthenia gravis in clinical practice. Arq Neuropsiquiatr 2022;80 Suppl 1:257–265.

5. Dushay KM, Zibrak JD, Jensen WA. Myasthenia gravis presenting as isolated respiratory failure. Chest 1990;97:232–234.


6. Mier A, Laroche C, Green M. Unsuspected myasthenia gravis presenting as respiratory failure. Thorax 1990;45:422–423.



7. Qureshi AI, Choundry MA, Mohammad Y, et al. Respiratory failure as a first presentation of myasthenia gravis. Med Sci Monit 2004;10:CR684–CR689.

(A) Chest computed tomography (CT) scan shows multifocal peribronchial ground-glass opacities in the right middle lobe and right lower lobe. There was no evidence of chronic obstructive pulmonary disease, such as emphysema. (B) Chest CT shows no pulmonary embolism or thymoma.
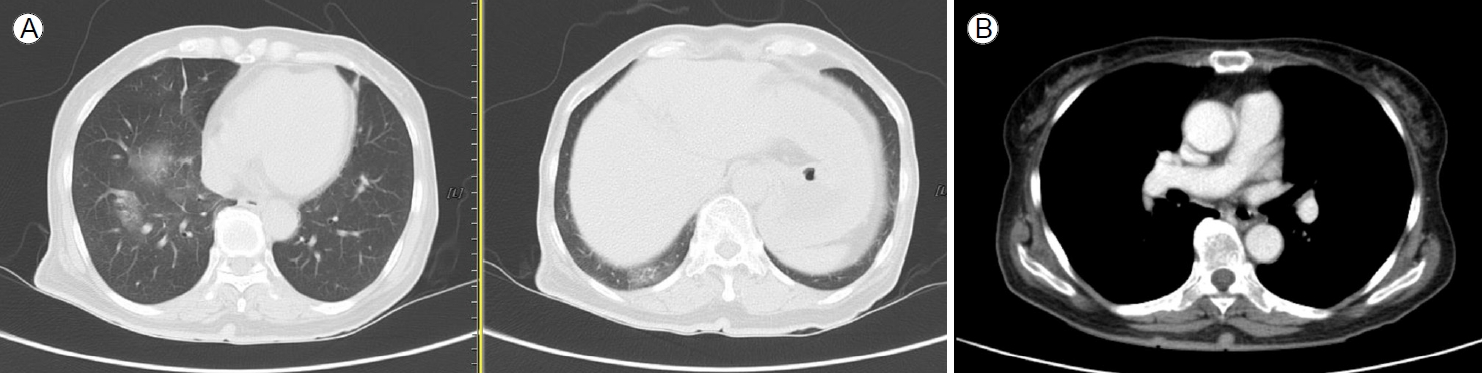
Figure 2.
Table 1.
Patient condition, treatment, ventilatory parameters, and arterial blood gas data
| HD, time | Condition and treatment | Mode | TV (mL) | Ti (s) | RR (breaths/min) | PS (cmH2O) | PEEP (cmH2O) | FiO2 | pH | PaCO2 (mmHg) | PaO2 (mmHg) | HCO3 (mEq/L) | SaO2 (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2, 06:00 AM | Normal consciousness, oxygen reduced to 2 L/min | 4 L/min | 7.23 | 88.0 | 230.2 | 36.2 | 99.3 | ||||||
| 2, 10:54 AM | Respiratory arrest, intubation | 2 L/min | 7.05 | 119.4 | 75.2 | 32.4 | 85.8 | ||||||
| 2, 11:30 AM | Mechanical ventilation started | CMV | 410 | 0.9 | 24 | 5 | 1.00 | 7.33 | 54.9 | 378 | 28.2 | 99.8 | |
| 5, 06:30 AM | Weaning try | SIMV | 400 | 0.9 | 24 | 4 | 5 | 0.24 | 7.44 | 43.0 | 76.5 | 29.1 | 97.0 |
| 8, 15:30 PM | Weaning failure | SIMV | 400 | 1.2 | 16 | 4 | 0 | 0.24 | 7.25 | 80.4 | 72.3 | 34.5 | 92.7 |
| 11, 08:30 AM | Weaning try | SIMV | 400 | 1.2 | 18 | 6 | 0 | 0.24 | 7.34 | 55.0 | 80.1 | 28.8 | 95.5 |
| 15, 06:30 AM | Steroid administered | SIMV | 400 | 1.0 | 20 | 6 | 4 | 0.24 | 7.21 | 74.5 | 88.7 | 29.0 | 96.3 |
| 18,a 13:00 PM | Temporarily improved then worsened | SIMV | 380 | 1.0 | 24 | 6 | 0 | 0.22 | 7.39 | 38.6 | 91.4 | 23.1 | 97.4 |
| 27, 20:00 PM | Comatous | SIMV | 400 | 1.2 | 24 | 12 | 5 | 0.22 | 7.20 | 67.8 | 73.3 | 25.9 | 92.0 |
| 29,b 13:00 PM | Comatous, shock | CMV | 420 | 1.2 | 28 | 12 | 4 | 0.50 | 6.87 | >200.0 | 175.0 | 99.8 | |
| 31, 06:30 AM | Improved consciousness | CMV | 420 | 1.2 | 28 | 12 | 4 | 0.45 | 7.54 | 39.7 | 128.0 | 33.5 | 98.8 |
| 36, 06:30 AM | Transfer to other hospital | SIMV | 400 | 1.2 | 16 | 10 | 0 | 0.30 | 7.42 | 38.2 | 119.0 | 24.2 | 98.4 |
HD, hospital day; TV, tidal volume; Ti, inspiratory time; RR, respiratory rate; PS, pressure support; PEEP, positive end-expiratory pressure; FiO2, fraction of inspired oxygen; PaCO2, arterial tension of carbon dioxide; PaO2, arterial tension of oxygen; SaO2, oxygen saturation; CMV, controlled mandatory ventilation; SIMV, synchronized intermittent mandatory ventilation.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




