만성 B형간염 진료지침 업데이트
Updated Treatment Guidelines for Chronic Hepatitis B
Article information
Trans Abstract
Chronic hepatitis B virus (HBV) infection is a major cause of liver cirrhosis and hepatocellular carcinoma in Korea. While the prevalence of HBV infection is gradually declining in Korea, 3 of the population still suffers from HBV-related chronic liver diseases. In this review, we summarize the updated clinical guidelines for management of chronic HBV, as revised by the Korean Association for the Study of the Liver in 2022.
서 론
만성 B형간염은 B형간염 바이러스(hepatitis B virus, HBV) 감염이 6개월 이상 지속되면서 간에 만성 염증 괴사가 발생하는 질환이다. 국가예방접종 사업 및 주산기 감염 예방사업으로 인해 우리나라의 HBV 감염율은 점차 감소하여 3%를 유지하고 있다. 하지만 B형간염은 현재도 우리나라 만성 간질환의 약 70%를 차지하는 주요 원인이며, 높은 간질환 및 간암 관련 사망률로 인해 여전히 국민 건강의 위협 요소로 남아있다[1].
최근 B형간염 항바이러스제의 지속적인 발전과 여러 가지 연구에서 수집되는 증거를 바탕으로 대한간학회 만성 B형간염 진료지침은 꾸준히 개정되고 있다. 만성 B형간염에 관한 전면 개정을 단행하였던 2018년 진료지침과 달리, 2022년 진료지침은 최근 발표된 의학정보를 바탕으로 최신 지견의 반영이 필요한 주요 12개 임상 주제를 선별하고 이에 대하여 진료 권고안을 수정 보완하는 부분 개정 방식으로 이루어졌다[2,3]. 본고에서는 2022년 부분 개정된 대한간학회 만성 B형간염 가이드라인[3]을 중심으로, 만성 B형간염의 자연경과에서 중요성이 대두되고 있는 이른바 ‘회색지대(grey zone)’ 환자들에 대한 최근 연구 결과 및 권고사항들을 살펴보고자 한다. 또한, 낮은 농도의 바이러스혈증 환자의 치료와 경구용 항바이러스제 치료를 종료할 수 있는 기준에 대해 소개하고 간세포암종 환자, 신기능 이상 또는 골대사 질환자에서의 B형간염 치료에 대해 간략히 알아보고자 한다.
본 론
만성 B형간염 자연경과 중 회색지대(grey zone)의 정의와 환자 관리
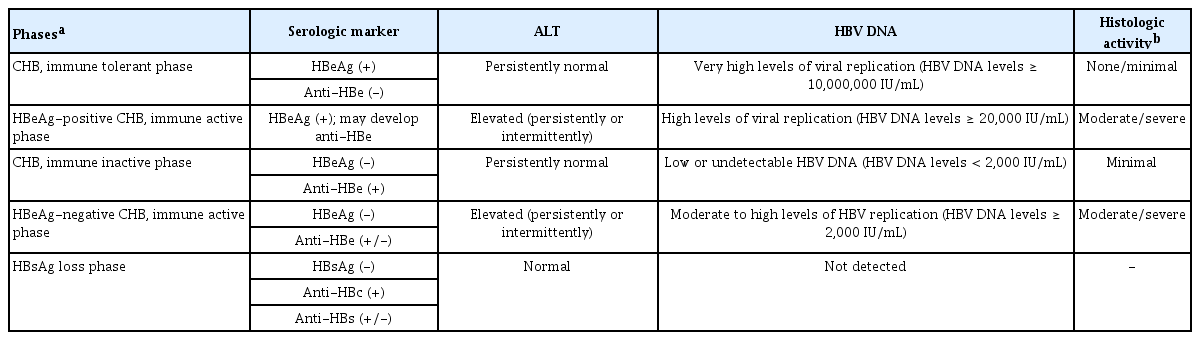
만성 B형간염 회색지대의 정의 및 평가
이번 2022년 진료지침에서는 만성 B형간염의 자연경과 중 어느 한 단계에 정확히 부합하지 않는 상태인 ‘회색지대’에 대해서 처음으로 언급하였다. 만성 B형간염의 자연 경과는 면역관용기, hepatitis B e antigen (HBeAg) 양성 면역활동기, 면역비활동기, HBeAg 음성 면역활동기, HBsAg 소실기로 나누어진다(Table 1). 이러한 자연경과 단계들은 환자마다 지속 기간이 다양하고 항상 연속적이지 않으며, 어느 한 단계에 정확히 부합하지 않는 회색지대가 존재할 수 있다. 예를 들면 HBeAg 양성 환자에서 혈청 HBV DNA가 107 IU/mL 미만이면서 혈청 ALT가 상승하지 않거나 HBeAg 음성 환자에서 혈청 HBV DNA가 2,000 IU/mL 이상이면서 혈청 ALT가 상승하지 않는 경우와 같이 임상적 지표인 혈청 HBV DNA와 ALT를 기준으로 어느 한 단계에 정확히 부합하지 않는 상태를 ‘회색지대(grey zone)’라고 정의할 수 있다. 만성 B형간염 환자의 약 30%가 회색지대에 해당하는 것으로 보고되어 있으며, 회색지대 환자들의 경우 간손상을 반영하는 지표인 혈청 ALT가 유의하게 높지 않은 경우가 많다[4,5]. 하지만 상대적으로 연령이 높고, 당뇨 및 지방간 등의 동반 질환, B형간염 바이러스 특정 부위의 변이 등 간질환 진행과 연관된 추가적인 위험인자들을 동반하는 경우가 있다.
회색지대의 환자에서 항바이러스 치료 시작 여부를 결정하기 위해 가장 중요한 것은 간섬유화와 간의 염증 정도를 정확하게 평가하는 것이다. 간섬유화는 침습적인 간생검 외에도, AST to Platelet Ratio Index (APRI), fibrosis-4 (FIB-4) index, Mac-2 binding protein glycosylation isomer (M2BPGi) 등의 혈청 표지자[6,7] 또는 간섬유화스캔(fibroscan), two-dimensional shear wave elastography와 같은 간 탄성도 검사로 비침습적으로 평가할 수 있다[8]. 간생검에서는 F2 이상의 섬유화를 의미있는 섬유화(significant fibrosis)로 간주하며[9], 국내 메타분석 연구 결과 간섬유화 스캔에서 F2 진단의 기준치는 7.8 kPa이었다[10]. 간 염증 및 손상 정도를 평가할 때는 혈청 ALT가 주로 활용되며, 간생검을 통해서 염증 괴사 동반 여부를 확인할 수 있다. 일반적으로 A2-A3 이상의 염증 동반 시 중등도 이상의 염증으로 판단한다.
면역관용기 회색지대 환자의 치료
B형간염 자연 경과 중 전형적인 기준의 면역관용기는 HBeAg 양성이고 혈청 HBV DNA 값이 대개 107 IU/mL 이상으로 매우 높지만, ALT가 지속적으로 정상 범위 이내이며 간생검에서는 염증이 없거나 매우 경미하고 섬유화도 없는 상태로, 이 시기에는 치료 없이 경과 관찰하여도 양호한 예후를 보인다[11,12]. 하지만 면역관용기로 추정되는 환자들 중에서도 상대적으로 나이가 많은 경우, 남성인 경우, 상대적으로 낮은 혈청 HBV DNA 농도를 보이는 경우[13], 간섬유화 점수가 높은 경우[14], ALT가 정상 상한치보다 약간 높은 경우 등이 간암 및 간 관련 합병증 발생 위험이 높은 것으로 보고되어 면역관용기 회색지대 환자에 대한 이슈가 부각되었다. 따라서 이번 2022년 B형간염 가이드라인에서는 면역관용기 추정 환자 중 정상 ALT를 보이더라도 연령이 30-40세 이상이거나, 혈청 HBV DNA < 107 IU/mL인 경우 또는 ALT가 정상 상한치의 경계에 있는 경우에는 간생검 또는 비침습적 방법으로 간섬유화 정도를 평가하여 의미 있는 간섬유화를 시사하는 소견이 있을 경우, 치료를 고려할 수 있음을 권고하였다(권고 수준: B2) (Fig. 1).
면역활동기 회색지대 환자의 치료
만성 B형간염 환자 중 바이러스의 활동적 증식과 함께 중등도 이상의 염증과 2단계 이상의 의미 있는 섬유화를 보이는 경우 면역활동기로 정의한다. 바이러스의 활동성 증식은 HBV DNA로 평가하며 HBeAg 양성의 경우에는 2,000-20,000 IU/mL 이상, HBeAg 음성인 경우에는 2,000 IU/mL 이상인 경우를 항바이러스 치료를 고려하는 바이러스 활동적 증식으로 간주한다. 간의 염증이 있는지 확인하는 데는 혈청 ALT가 간손상을 반영하는 간편한 지표로 널리 활용되어 왔다. 최근 15개의 무작위 대조군 연구와 44개의 관찰 연구를 분석한 메타분석에서도 면역활동기 환자군에서의 항바이러스 치료는 간경변증의 위험, 비대상성 변화의 위험 그리고 간암의 위험을 낮추는 것으로 나타났다[15]. 따라서 바이러스의 활동적 증식과 더불어 진행된 염증 및 섬유화를 보이는 경우에는 항바이러스 치료를 시작해야 한다(Fig. 1).
HBV DNA는 증가되어 있으나 ALT가 정상 상한치의 1-2배 사이로 지속되어 면역활동기의 기준에 부합하지 않는 회색 지대의 경우, 2022년 개정 가이드라인에서는 추적 관찰하거나 간생검을 시행하여 중등도 이상의 염증 괴사 혹은 문맥 주변부 섬유화 이상의 단계를 보이면 항바이러스 치료를 시작하도록 권고하였다(권고 수준: A1). 또한 임상적으로 의미있는 간섬유화는 비침습적 방법으로 평가할 수 있도록 제시하였다(권고 수준: B1) (Fig. 1).
낮은 농도의 바이러스 혈증 환자에서 항바이러스제 치료의 필요성 여부
전형적인 면역비활동기는 HBeAg 음성, anti-HBe 양성, 지속적인 정상 ALT 그리고 HBV DNA가 측정치 이하로 미검출되거나, 낮은 농도(< 2 ,000 IU/mL)로 지속되는 시기로 진행된 간섬유화의 증거가 없는 면역비활동기의 경우 치료없이 경과 관찰하여도 좋은 예후를 보인다[16]. 반면 낮은 농도의 바이러스 혈중 상태를 보이더라도(< 2 ,000 IU/mL), 진행된 간섬유화를 시사하는 FIB-4나 APRI가 증가한 경우 간암 등 합병증 발생이 증가되어 있는 것으로 보고되었다[5,17,18]. 따라서 개정된 가이드라인에서는 혈청 HBV DNA < 2,000 IU/mL라도 간생검이나 비침습적 검사에서 의미 있는 간섬유화를 시사하는 소견이 있을 경우, 치료를 고려하도록 하였다(권고 수준: B2) (Fig. 1).
간경변증의 합병증이 발생하지 않은 대상성 간경변증 환자의 경우 혈청 HBV DNA ≥ 2,000 IU/mL이면 ALT에 관계없이 항바이러스제 치료가 급여 적용이 가능하다. 최근 유럽 및 미국 간학회 가이드라인에서는 낮은 농도의 혈청 HBV DNA 농도를 보이더라도(< 2 ,000 IU/mL) 혈청 HBV DNA가 검출되는 대상성 간경변증 환자에서 치료를 권고하고 있다[11,19]. 낮은 혈청 HBV DNA 농도를 보이는 대상성 간경변증 환자들의 임상 경과를 보고한 국내 관찰 연구에서는 관찰 기간 중 33%가 HBV DNA 2,000 IU/mL 이상 상승 소견을 보였고, 이들 중에서 간암의 위험이 높다고 보고하였다[20]. 또한 비록 관찰 기간 내내 낮은 농도의 바이러스로 유지된다고 하더라도 바이러스가 미검출 상태로 유지된 환자군에 비하여 간암의 위험이 높았다. 따라서 낮은 혈청 HBV DNA 농도를 보이는 간경변증 환자에게 항바이러스 치료를 시행하게 되면 HBV DNA의 농도 상승 발생을 예방할 수 있고, 합병증 발생의 위험을 낮출 가능성이 있다. 이를 기반으로 개정 가이드라인에서는 혈청 HBV DNA < 2,000 IU/mL라도 혈청 HBV DNA가 검출되는 대상성 간경변증의 경우에는 ALT에 관계없이 항바이러스 치료를 시작할 것을 권고하였다(권고 수준: B1) (Fig. 1).
B형간염 환자에서 항바이러스제를 종료할 수 있는 기준
만성 B형간염 환자에서 치료의 종료를 고려하고자 한다면 치료 목적을 잘 반영할 수 있으면서 치료 중 측정이 용이한 대체 지표의 변화를 치료 목표로 삼아 종료 시점을 선택하는 것이 대안이 될 수 있다. 임상에서는 ALT 정상화, 혈청 HBV DNA의 불검출, HBeAg의 혈청소실 및 전환, HBsAg 혈청소실 및 전환 등을 치료 목표로 이용하고 있다. 최근, 혈청 HBsAg 정량 검사, 혈청 hepatitis B core-related antigen (HBcrAg) 정량 검사 혹은 혈청 HBV RNA 등의 측정을 통해서 지속 치료반응 예측 및 종료 시점 결정에 도움을 줄 수 있다는 연구들이 소개 되고 있다.
항바이러스 치료 후 치료 반응이 지속되기도 하지만 약제 중단 후 간염 악화 및 심각한 간부전으로 진행할 수 있다. 따라서 치료 반응 지속 및 재발 여부, 간기능 상태 등을 알아보기 위하여 정기적인 간기능 검사, HBeAg, anti-HBe, HBV DNA 등에 대한 추적 검사 및 경과 관찰이 반드시 필요하다. 특히, 약제 중단 후 HBV DNA가 증가하는 경우, HBV DNA와 ALT를 포함한 간기능 검사를 세밀히 시행하여 약제 재투여 여부를 결정해야 한다.
HBsAg의 혈청소실
HBsAg 소실은 anti-HBs 형성 여부와 상관없이 혈액 내의 HBsAg과 HBV DNA의 소실을 뜻한다[21]. 이러한 경우 비록 간세포 내에 cccDNA가 존재할 수 있지만 간손상이 진행되지 않고 간암의 위험이 낮아 “기능적 완치”로 일컬어지며 현실적인 치료 목표로 제시되고 있다. 항바이러스 치료를 통하여 HBsAg 소실 혹은 전환이 일어나는 환자에서 일부가 일시적인 HBsAg 재출현이나 HBV DNA의 검출이 될 수 있으나 대부분의 환자는 HBsAg 소실과 HBV DNA 불검출을 유지한다고 보고되었고 간암의 발생도 HBsAg 소실을 보이지 않은 환자에 비하여 낮으므로, HBsAg 소실 혹은 전환은 치료 목적을 잘 반영하는 가장 좋은 임상적인 치료 목표라 할 수 있다[22-24]. 따라서, 만성 B형간염 환자에서는 HBsAg 소실이 이루어진 후 경구용 항바이러스제 치료 종료를 권장한다(권고 수준: A1).
HBsAg 정량치
HBV의 복제 과정에서 전사된 mRNA로부터 세 가지 다른 크기의 S (small), M (middle), L (large) HBs 단백이 생성이 되는데, HBsAg 정량치는 이 세 가지 입자 모두를 포함하여 검출하게 된다[25]. 여러 연구에서 항바이러스제 치료 종료 시점의 낮은 HBsAg 정량치가 지속 바이러스 반응과 HBsAg 혈청 소실을 예측하는데 유용함이 보고되었다[26,27]. 치료 종료 시점에 10-200 IU/mL 정도의 낮은 HBsAg 정량치를 보이는 경우 약제 종료 후에도 지속 바이러스 반응과 HBsAg 소실과 연관된다고 알려져 있어, 경구용 항바이러스제 치료 중 모니터링에 있어서도 HBsAg 정량 검사는 도움이 된다. 따라서 2022년 개정 가이드라인에서는 경구용 항바이러스제 치료 중단을 고려하는 경우, HBsAg 정량치를 참고하여 중단 여부를 결정할 수 있도록 권고하였다(권고 수준: B1).
HBcrAg 정량치
HBcrAg은 precore/core 유전자로부터 합성된 3개의 단백질(HBeAg, HBcAg, p22cr)을 동시에 측정하는 혈청표지자이다. HBcrAg은 간 내 바이러스 증식 정도를 나타내는 간내 cccDNA, 간내 HBV DNA와 좋은 상관관계를 보이는 것으로 알려져 있다[25,28]. HBcrAg 정량치도 항바이러스제 치료 후 지속 반응을 예측하는 데 유용하며, 최근 일본 가이드라인에서는 HBsAg 정량치와 HBcrAg 정량치를 조합하여 재활성화 위험도에 따라 약제 중단을 권고하고 있다[29].
혈청 HBV RNA
혈청 HBV RNA는 cccDNA로부터 지속적으로 전사되어 생성되며, 혈청 HBV DNA, HBsAg과 더불어 간에서 생성되는 바이러스 증식 중간물(viral replicative intermediates)을 대변하는 혈청 지표이다[30]. HBV RNA도 최근 항바이러스제 치료 종료를 결정하는 인자로 연구들이 진행되고 있다[7,31]. 또한, 이를 HBsAg 정량치와 HBcrAg 정량치 등과의 조합으로 치료 종료 후의 지속 바이러스 반응을 예측하는 지표로 제시하고 있다[32,33]. 그러나 같은 환자의 혈청에서도 HBV RNA 추출 및 PCR 정량 방법에 따라 결과값이 달라지므로, HBV RNA가 B형간염의 유용한 표지자로 널리 사용되기 위해서는 향후 HBV RNA 검출 방법의 표준화가 필요하다.
간암 환자에서 B형간염 바이러스의 치료
B형간염에 의해 간암이 발생한 환자에서 항바이러스제 치료는 B형간염 바이러스 증식을 억제하여 간기능을 호전시켜 간암에 대해 적극적인 치료를 받을 수 있도록 도와주는 역할을 한다. 또한 간암에 대해 간 절제, 고주파 열치료, 간이식 등의 완치 치료를 받은 환자에서 항바이러스제 치료는 간암의 재발 위험을 줄이고 생존율을 향상시키는 것으로 알려졌다[33,34]. 이러한 점을 고려하여 국내에서는 B형간염 환자가 간암을 진단받는 경우, HBV DNA가 검출되기만 하면 ALT, AST 정도와 상관없이 항바이러스제 사용을 권고하고 있으며 보험 적용도 가능하다. 항바이러스제 종류의 경우 테노포비어, 엔테카비어 등의 바이러스 억제능이 높은 약제를 사용하는 것이 그렇지 않은 경우보다 간암 치료 후 무재발 생존 기간이 유의하게 길었다. 하지만 테노포비어와 엔테카비어 중 어느 약제가 간암 재발 및 생존율 향상에 더 효과적인지에서는 여러 후향적 연구에서 상반된 결과를 보여 추가적인 대규모 연구들이 필요하겠다[35,36].
간암 환자가 B형간염 표면항원(HBsAg)은 양성이나 HBV DNA가 검출되지 않는 경우 현재는 항바이러스제가 보험 적용이 되지 않는다. 하지만 이런 경우에도 수술적 절제 후 HBV 재활성화가 20% 가까이 발생한 반면, 항바이러스제 사용하는 군에서는 HBV 재활성화를 감소시켰다[37]. 따라서 HBV DNA가 검출되지 않더라도 HBsAg 양성인 간암 환자들은 항바이러스제 사용을 고려하는 것이 좋겠다.
간암 치료 중 경동맥항암화학색전술(transarterial chemoembolization, TACE)와 체외 방사선 치료를 병행할 경우에는 단독 TACE 치료에 비해 HBV 재활성화 위험이 2배 이상 증가하였다[38]. 또한 HBsAg 음성이지만 anti-HBc 양성이거나 과거 B형간염의 병력이 있었던 환자에서도 TACE 단독 치료나 TACE와 체외 방사선 치료 병행 시 HBV 재양전 및 재활성화가 된다는 연구가 보고되었다[39]. 따라서 HBV 재활성화의 위험도가 높은 간암 치료 시에는 HBsAg 음성이라도 B형간염 재활성화 여부에 대한 주의 깊은 모니터링이 필요하겠다.
신기능 이상 또는 골대사 질환자에서의 B형간염 치료
국내 만성 B형간염 환자는 점차 고령화되고 있는 추세이며, 이에 따라 신기능 저하, 골대사 질환 등의 각종 동반 질환을 가지고 있는 환자 수 역시 증가하고 있다. 만성 B형간염 환자에서 경구 항바이러스제를 처음으로 처방하게 되는 초치료 환자의 경우, 해당 환자의 신기능 이상 및 골대사 질환 혹은 이러한 질환의 위험성(장기간 스테로이드 사용자 등) 여부를 사전에 살펴보아야 한다. 현재 초치료 환자에서 1차 치료제로 추천되고 있는 테노포비어 DF의 경우 테노포비어 AF와의 3상 비교 연구에서 신기능 감소가 유의하게 테노포비어 DF 사용군에서 두드러졌으며, 골밀도 역시 테노포비어 DF 사용 군에서 테노포비어 AF 사용군에 비해 기저 대비 96주 치료 후 더 악화되었다[40]. 따라서 개정된 2022년 만성 B형간염 진료 가이드라인 개정판에서는 신기능 저하에 대한 위험인자가 있는 경우(기저 사구체여과율 < 60 mL/min, 단백뇨, 알부민뇨[소변 알부민: 크레아티닌 비 > 30 mg/g], 저인산혈증[< 2 .5 mg/dL], 조절되지 않는 당뇨나 고혈압), 테노포비어 DF 이외 다른 경구 항바이러스제 사용(테노포비어 AF, 엔테카비어, 베시포비어)을 추천하고 있다. 뿐만 아니라 골밀도 감소의 위험이 있거나 장기적으로 골밀도를 감소시킬 만한 약제를 사용하는 경우에도 테노포비어 DF 이외 다른 경구 항바이러스제 사용을 추천하고 있다(Fig. 2).
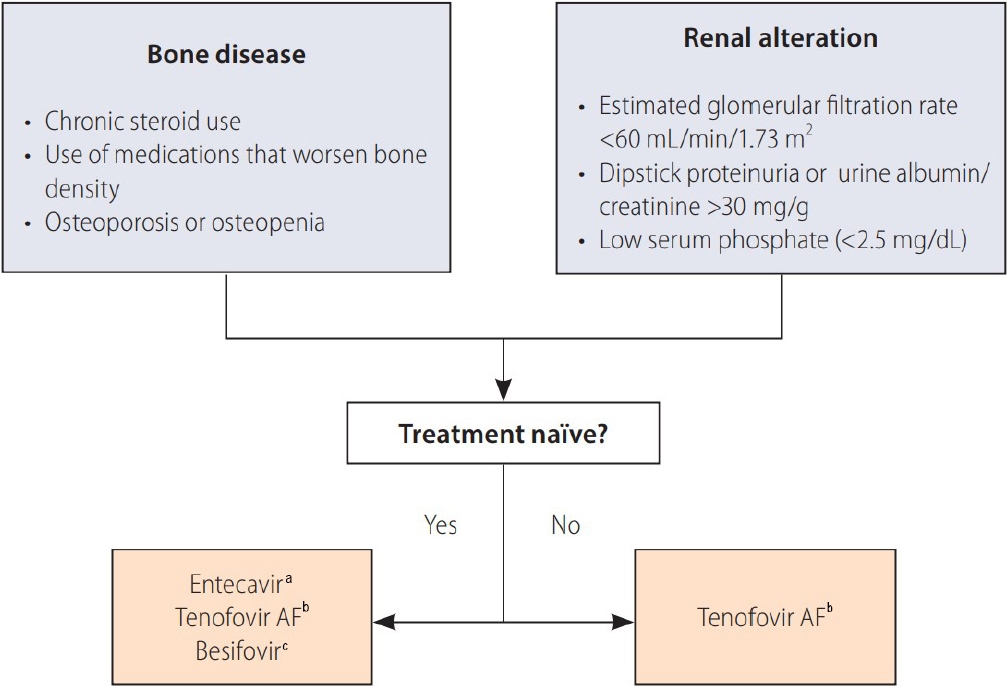
Indications for selecting entecavir, tenofovir alafenamide fumarate or besifovir over tenofovir disoproxil fumarate. Reproduced from reference [3] with permission. AF, alafenamide fumarate. a Dose was adjusted if creatinine clearance was < 50 mL/min. b Not indicated if creatinine clearance was < 15 mL/min without dialysis. c Not indicated if creatinine clearance was < 15 mL/min.
장기간 항바이러스제를 사용하고 있는 환자가 점차 증가하고 있기에 치료 중 신기능과 골밀도의 지속적인 모니터가 더욱 중요해지고 있다. 따라서 치료 중 신기능 혹은 골밀도 저하가 발생할 경우 유발인자를 찾아 교정하고, 필요 시 항바이러스제 변경을 고려해야 한다. 테노포비어 DF, 테노포비어 AF를 비교한 3상 연구에서 테노포비어 DF를 96주 혹은 144주간 사용하다가 테노포비어 AF로 변경하였을 경우 지속적인 신기능의 호전이 관찰되었고, 계속적으로 치료 시 처음부터 테노포비어 AF를 사용한 환자들과 통계적으로 유의한 차이를 보이지 않았다[41]. 따라서 테노포비어 DF 사용에 따른 신기능 감소는 약제 변경을 통해 회복될 수 있는 가역적인 과정임을 추측할 수 있다. 이전 여러 가지 약제를 사용한 경험이 있는 다제 내성 B형간염 바이러스 보유 환자에서도 장기간 테노포비어 DF를 사용한 뒤 테노포비어 AF로 변경하여 사용할 경우 지속적으로 테노포비어 DF를 유지한 군에 비해서 신기능과 골밀도의 개선을 보여주었다[42]. 따라서 항바이러스제 치료 중 관찰될 수 있는 신기능 혹은 골밀도 감소는 약제 변경을 통해 호전될 수 있을 것으로 판단된다.
결 론
이번 만성 B형간염 가이드라인은 축적된 연구 결과들을 바탕으로 임상적으로 중요한 핵심 주제에 대해 부분 개정하여 제시하였다. 만성 B형간염 환자에서 진료 지침에 기반한 적절한 치료 및 관리를 통해 간질환 관련 합병증을 예방하고 생존율을 더욱 향상시킬 수 있을 것이다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
This study was supported by grant from the National Research Foundation of Korea funded by the Ministry of Science and ICT (RS-2022-00166674).
AUTHOR CONTRIBUTIONS
J An wrote the manuscript of the whole contents.
Acknowledgements
None.