 |
 |
| Korean J Med > Volume 91(2); 2016 > Article |
|
ņÜöņĢĮ
ļ¬®ņĀü
ĒÅÉĻ▓ĮņØĆ ņ¦Ćņ¦łļīĆņé¼ ņןņĢĀ, ļ╣äļ¦ī ĻĘĖļ”¼Ļ│Ā ĒśłņĀä ĒśĢņä▒ ņ┤ēņ¦äĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒĢ£ĻĄŁ ņżæļģä ņŚ¼ņä▒ņŚÉņä£ ĒÅÉĻ▓ĮĻ│╝ ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ĒÖśņ×ÉņØś ņ×äņāü Ļ▓ĮĻ│╝ļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.ļīĆņāü ļ░Å
ļīĆņāü ļ░Å ļ░®ļ▓Ģ
2005ļģä 11ņøöļČĆĒä░ 2013ļģä 12ņøöĻ╣īņ¦Ć ĒĢ£ĻĄŁņØĖ ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļō▒ļĪØņé¼ņŚģņŚÉ ļō▒ļĪØļÉ£ 1,781ļ¬ģņØś 65ņäĖ ļ»Ėļ¦ī ņżæļģä ņŚ¼ņä▒ņØä ļīĆņāüņ£╝ļĪ£ ĒÅÉĻ▓Į ņĀä ĻĘĖļŻ╣(IĻĄ░, Ōēż 55ņäĖ, 669ļ¬ģ)Ļ│╝ ĒÅÉĻ▓Į Ēøä ĻĘĖļŻ╣(IIĻĄ░, 56-64 ņäĖ, 1,112ļ¬ģ)ņ£╝ļĪ£ ļéśļłäņ¢┤ņä£ 1ļģä Ēøä ņŻ╝ņÜö ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤ņØä ļ╣äĻĄÉ ļČäņäØĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ņØĆ 669ļ¬ģ(IĻĄ░ 49.1 ┬▒ 5.6ņäĖ)ņØ┤ļ®░ ĒÅÉĻ▓Į Ēøä ņŚ¼ņä▒ņØĆ 1,112ļ¬ģ(IIĻĄ░ 60.6 ┬▒ 2.6ņäĖ)ņØ┤ņŚłļŗż. ņ▓┤ņ¦łļ¤ēņ¦Ćņłś(IĻĄ░ 24.2 ┬▒ 3.2 kg/m2 vs. IIĻĄ░ 24.6┬▒3.3kg/m2; p= 0.048)ņÖĆ ļ│ĄļČĆ ļæśļĀł(IĻĄ░ 90.3 ┬▒ 9.4 cm vs. IIĻĄ░ 92 ┬▒ 9.5 cm; p= 0.005)ļŖö IIĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż. Ļ│ĀĒśłņĢĢ(IĻĄ░ 42.2% vs. IIĻĄ░ 59.4%; p< 0.001), ļŗ╣ļć©ļ│æ(IĻĄ░ 27.4% vs. IIĻĄ░ 35.7%; p< 0.001), ņØ┤ņāüņ¦Ćņ¦łĒśłņ”Ø(IĻĄ░ 12.9% vs. IIĻĄ░ 17.7%; p= 0.008)ņØĆ IIĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļŹö ļåÆņĢśļŗż. ĒØĪņŚ░(IĻĄ░ 2.7% vs. IIĻĄ░ 1.9%; p< 0.001)Ļ│╝ Ļ░ĆņĪ▒ļĀź(IĻĄ░ 12% vs. IIĻĄ░ 6.8%; p< 0.001)ņØĆ IĻĄ░ņŚÉņä£ ļåÆĻ▓ī ļéśĒāĆļé¼ļŗż. ņ┤Ø ņĮ£ļĀłņŖżĒģīļĪż(IĻĄ░ 185.5 ┬▒ 48.1 mg/dL vs. IIĻĄ░ 194.5 ┬▒ 47.6 mg/dL; p< 0.001)Ļ│╝ ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪż(IĻĄ░ 116.1 ┬▒ 40.8 mg/dL vs. IIĻĄ░ 125.8 ┬▒ 47.9 mg/dL; p< 0.001)ņØĆ IIĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż. ņŻ╝ņÜö ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤ņŚÉ ņ׳ņ¢┤ņä£ 1Ļ░£ņøö(IĻĄ░ 1.7% vs. IIĻĄ░ 2.5%; p= 0.481), 6Ļ░£ņøö(IĻĄ░ 4.9% vs. IIĻĄ░ 4.6%; p= 0.911), 12Ļ░£ņøö(IĻĄ░ 7.6% vs. IIĻĄ░ 8.5%; p= 0.551) ļ░£ņāØļźĀņØĆ ļæÉ ĻĄ░ Ļ░ä ņ░©ņØ┤ļź╝ ļéśĒāĆļé┤ņ¦Ć ņĢŖņĢśļŗż. ļśÉĒĢ£ ņāØņĪ┤ņ£©Ļ│╝ ņāØņĪ┤ ļČäņäØļÅä ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ļŗżļ│Ćļ¤ē ļČäņäØņØä ĒĢ£ Ļ▓░Ļ│╝ ļŗ╣ļć©ļ│æ(HR 1.69, 95% CI 1.16-2.45, p= 0.006), ņŗ¼ļ░®ņäĖļÅÖ(HR 5.95, 95% CI 1.44-21.29, p= 0.007), ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ĻĖ░ņÖĢļĀź(HR 1.86, 95% CI 1.15-2.94, p= 0.009), ļŗżĒśłĻ┤Ć ņ¦łĒÖś(HR 1.54, 95% CI 1.05-2.22, p= 0.025) ĻĘĖļ”¼Ļ│Ā Killip class (HR 1.26, 95% CI 1.02-1.54, p= 0.028), Ļ░ĆņĪ▒ļĀź(HR 1.78, 95% CI 0.99-3.03, p= 0.042)ņØĆ 1ļģä ņŻ╝ņÜö ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤ņØä ņśłņĖĪĒĢśļŖö ļÅģļ”ĮņĀüņØĖ ņ£äĒŚś ņÜöņØĖņØ┤ņŚłļŗż.
Abstract
Background/Aims
It is well known that the menopause is related to interference in lipid metabolism, obesity, and a hypercoagulable state. The aim of the present study was to examine the impact of the menopause in middle-aged Korean females with acute myocardial infarction (AMI).
Methods
A total of 1,781 middle-aged females (aged < 65 years) in the Korean Acute Myocardial Infarction registry were enrolled into this study between November 2005 and December 2013. The patients were divided into two groups; the pre-menopause group (Ōēż 55 years old) and the menopause group (56-64 years old). Major adverse cardiac events (MACE) were analyzed over a one-year follow-up period.
Results
The pre-menopause and menopause groups comprised 669 patients (mean age, 49.1 ┬▒ 5.6 years) and 1,112 patients (mean age, 60.6 ┬▒ 2.6 years), respectively. The incidence of hypertension (42.2% vs. 59.4%, p < 0.001), diabetes mellitus (DM) (27.4% vs. 35.7%, p < 0.001), and dyslipidemia (12.9% vs. 17.7%, p = 0.008) were more frequent in menopausal patients. Additionally, the rates of smoking (20% vs. 12.7%, p < 0.001) and familial history (12% vs. 6.8%, p < 0.001) were higher in the pre-menopause group. The cumulative rates of MACE did not show any differences between the two groups. A history of atrial fibrillation, previous AMI and DM, higher Killip class, and multi-vessel disease were independent risk factors for predicting one-year MACE.
Conclusions
The survival analysis demonstrated that there was no significant difference in MACE rates between the pre-menopause and menopause groups during the one-year follow-up. Therefore, middle-aged pre-menopausal women should be treated more intensively, regardless of whether they are menopausal.
ņśżļŖśļéĀ ĒśäļīĆņØĖļōżņØś ņāØĒÖ£ ņłśņżĆņØ┤ Ē¢źņāüļÉśļ®┤ņä£ ĒÖ£ļÅÖļ¤ēņØĆ ņżäņ¢┤ļōżĻ│Ā ņśüņ¢æ ņäŁņĘ©ļ¤ēņØĆ ļ¦ÄņĢäņ¦Ćļ®┤ņä£ ņ¦łļ│æ ņ¢æņāüņØ┤ ĻĖēņä▒ ņ¦łĒÖśņŚÉņä£ Ļ│ĀĒśłņĢĢ, ļŗ╣ļć©ļ│æ, Ļ│Āņ¦ĆĒśłņ”Ø ļō▒ ļ¦īņä▒ ņ¦łĒÖśņØś ņ”ØĻ░ĆļĪ£ ļ│ĆĒÖöĒĢśņśĆļŗż[1].
ĒĢ£ĻĄŁņØĖņŚÉņä£ ņé¼ļ¦ØņØś ņøÉņØĖļÅä ļ│ĆĒÖöĒĢśĻ│Ā ņ׳ļŗż. ņĢģņä▒ ņŗĀņāØļ¼╝ņØ┤ ļåÆņØĆ ņł£ņ£äļź╝ ņ░©ņ¦ĆĒĢśĻ│Ā ņ׳ņ¦Ćļ¦ī ļŗ©ņØ╝ ĻĖ░Ļ┤Ćņ£╝ļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØļźĀļĪ£ ļ│╝ ļĢīļŖö ņŗ¼ļćīĒśłĻ┤Ć ņ¦łĒÖśņØ┤ ļ╣ĀļźĖ ņåŹļÅäļĪ£ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż[2]. ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņ£Āļ│æļźĀņØĆ ņŚ¼ņä▒ļ│┤ļŗż ļé©ņä▒ņØś ņ£Āļ│æļźĀņØ┤ ļīĆņ▓┤ļĪ£ ļåÆņ¦Ćļ¦ī ņżæļģä ņØ┤ĒøäņŚÉņä£ļŖö ņŚ¼ņä▒ņØś ņ£Āļ│æļźĀņØ┤ ļåÆņĢäņ¦ĆĻ│Ā ņ׳ļŗż[3].
2013ļģä Ļ│ĀĒśłņĢĢĒĢÖĒÜīņŚÉņä£ ļ░£Ēæ£ĒĢ£ ņ¦łļ│æĻ┤Ćļ”¼ļ│ĖļČĆņØś ņĪ░ņé¼ ļé┤ņÜ®ņŚÉņä£ļŖö Ļ│ĀĒśłņĢĢ ņ£Āļ│æļźĀņØ┤ ĒśäņĀĆĒĢśĻ▓ī ņżæļģä ņØ┤Ēøä ņŚ¼ņä▒ņŚÉņä£ ļåÆņĢäņ¦ĆļŖö Ļ▓āņØä ļ│╝ ņłś ņ׳ļŗż[1]. ĒĢ£ĻĄŁņØĖ ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļō▒ļĪØņé¼ņŚģ(Korea Acute Myocardial Infarction Registry, KAMIR)ņŚÉ ļō▒ļĪØļÉ£ ļŹ░ņØ┤Ēä░ļź╝ ļČäņäØĒĢ£ Ļ▓░Ļ│╝ 6ļģä ļÅÖņĢł ĒĢ£ĻĄŁ ņŚ¼ņä▒ņØś ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”ØņØś ļ░£ņāØļźĀņØĆ ļé©ņä▒ņŚÉ ļ╣äĒĢ┤ņä£ ļéśņØ┤Ļ░Ć ļōżņ¢┤Ļ░łņłśļĪØ ņ”ØĻ░ĆļÉśņŚłņ£╝ļ®░, ĻĘĖ ņ”ØĻ░Ćņ£©ņØ┤ ņżæļģä ņØ┤ĒøäļČĆĒä░ ļ╣ĀļźĖ ņåŹļÅäļĪ£ ņ”ØĻ░ĆļÉśļŖö Ļ▓āņØä ņĢī ņłś ņ׳ņŚłĻ│Ā 70ļīĆņŚÉ Ļ░Ćņן ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż[4]. ņżæļģä ņØ┤Ēøä ņŚ¼ņä▒ļōżņØś ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØ┤ ņ”ØĻ░ĆĒĢśļŖö ļŹ░ļŖö ĒÅÉĻ▓ĮĻĖ░ļź╝ Ļ▒░ņ╣śļ®┤ņä£ ļé£ņåīņŚÉņä£ņØś ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉņØś ļČäļ╣ä Ļ░ÉņåīĻ░Ć ņøÉņØĖņØ┤ļØ╝ļŖö ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ļ│┤Ļ│ĀļÉśņŚłļŗż[5,6]. ļīĆĒæ£ņĀüņØĖ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļĪ£ļŖö ļé£ņåīņŚÉņä£ ļČäļ╣äļÉśļŖö ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉĒśĖļź┤ļ¬¼ņØĆ ĒśłĻ┤ĆņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ļé£ĒżĒśĖļź┤ļ¬¼ ņłśņÜ®ņ▓┤ļź╝ ĒåĄĒĢ┤ ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒżņÖĆ ĒśłĻ┤ĆņØś ĒÅēĒÖ£ĻĘ╝ņäĖĒżņŚÉ ņ×æņÜ®ĒĢśņŚ¼ ĒśłĻ┤ĆņØä ĒÖĢņןņŗ£Ēéżļ»ĆļĪ£ ĒÅÉĻ▓Į ĒøäņØś ņŚÉņŖżĒŖĖļĪ£Ļ▓É ļČäļ╣ä Ļ░ÉņåīļŖö ĒśłņĢĢ ņāüņŖ╣ņØś ņøÉņØĖņØ┤ ļÉ£ļŗż[7]. ĻĘĖļ”¼Ļ│Ā ĒÅÉĻ▓Į ĒøäņŚÉļŖö ņ┤Ø ņĮ£ļĀłņŖżĒģīļĪżĻ│╝ ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪżņØ┤ ņ”ØĻ░ĆļÉśļ®┤ņä£ Ļ│Āņ¦ĆĒśłņ”ØņØś ļ░£ņāØņ£╝ļĪ£ ļÅÖļ¦źĻ▓ĮĒÖöņ”ØņØ┤ ņ¦äĒ¢ēņØ┤ ĻĖēņåŹĒ׳ ļÉśĻ│Ā ĒśłņĢĪņØæĻ│Ā ņØĖņ×ÉņØĖ ņä¼ņ£ĀņåīņøÉņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆļÉśļ®┤ņä£ ĒśłņĀäņ”ØņŚÉ ļīĆĒĢ£ ņ£äĒŚśņØ┤ ļåÆņĢäņ¦ĆĻ│Ā ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņØ┤ĒÖśņ£©ņØ┤ ļåÆņĢäņ¦ĆĻ▓ī ļÉ£ļŗż[8,9]. ņŚ¼ņä▒ļōżņØĆ ĒÅÉĻ▓ĮņŚÉ ņØśĒĢ┤ņä£ Ļ░ÖņØĆ ļéśņØ┤ņØś ļé©ņä▒ļ│┤ļŗż ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņ£äĒŚśņØ┤ ņ”ØĻ░ĆĒĢśļŖöļŹ░, ņØ┤ļŖö ĒÅÉĻ▓Į ņŚ¼ņä▒ņØś ņ▓┤ņ¦łļ¤ēņ¦Ćņłś(body mass index, BMI), ņ▓┤ņ¦Ćļ░®ļ¤ē, ņ¦Ćļ░®ļČäĒżņØś ļ│ĆĒÖöņÖĆ ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉĒśĖļź┤ļ¬¼ņØś Ļ░ÉņåīļĪ£ ĻĖ░ņ┤łļīĆņé¼ļ¤ēņØ┤ Ļ░ÉņåīĒĢśļ®┤ņä£ ņ▓┤ņżæņØś ņ”ØĻ░ĆļĪ£ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗż[10].
ņØ┤ ņŚ░ĻĄ¼ņØś ļ¬®ņĀüņØĆ ĒÅÉĻ▓ĮņØä ĻĖ░ņżĆņ£╝ļĪ£ ĒÅÉĻ▓Į ņĀä ņŗ¼ĻĘ╝Ļ▓Įņāēņ”ØņØ┤ ļ░£ņāØĒĢ£ ĒÖśņ×ÉņÖĆ ĒÅÉĻ▓Į Ēøä ņŗ¼ĻĘ╝Ļ▓Įņāēņ”ØņØ┤ ļ░£ņāØĒĢ£ ĒÖśņ×ÉņØś ņ×äņāüņĀü ĒŖ╣ņ¦Ģ ļ░Å ņśłĒøäļź╝ ĒīīņĢģĒĢ┤ļ│┤Ļ│Ā ĒÅÉĻ▓Į ņĀäĒøä ļ░£ņāØĒĢ£ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ĒÖśņ×ÉņØś ņ╣śļŻī ļ░Å Ļ┤Ćļ”¼ņŚÉ ņżæņÜöĒĢ£ ņ×ÉļŻīļź╝ ņĀ£Ļ│ĄĒĢśĻ│Āņ×É ļ│Ė ņŚ░ĻĄ¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż.
2005ļģä 11ņøöļČĆĒä░ 2013ļģäļÅä 12ņøöĻ╣īņ¦Ć KAMIRņŚÉ ļō▒ļĪØļÉ£ 30-64ņäĖĻ╣īņ¦ĆņØś 4,128ļ¬ģ ņżæ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļ░£ņāØ Ēøä 1ļģä ņČöņĀüņĪ░ņé¼Ļ░Ć ļÉ£ 1,781ļ¬ģ ņżæļģä ņŚ¼ņä▒ņ£╝ļĪ£ ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ 699ļ¬ģ(IĻĄ░, Ōēż 55ņäĖ, 49.1 ┬▒ 5.6ņäĖ)Ļ│╝ ĒÅÉĻ▓Į Ēøä ņŚ¼ņä▒ 1,112ļ¬ģ(IIĻĄ░, 56-64 ņäĖ, 60.6 ┬▒ 2.6ņäĖ)ņØä ļīĆņāüņ£╝ļĪ£ ļæÉ ĻĄ░ Ļ░äņØś ņ×äņāü Ļ▓ĮĻ│╝ļź╝ ļ╣äĻĄÉ ļČäņäØĒĢśņśĆļŗż.
ĒĢ£ĻĄŁņŗ¼ņןĒĢÖĒÜī 50ņŻ╝ļģä ĻĖ░ļģÉ ņŚ░ĻĄ¼ ņé¼ņŚģņ£╝ļĪ£ ņ¦äĒ¢ēļÉśņŚłļŹś KAMIRņØś ĒÖśņ×ÉņĀĢļ│┤ĻĖ░ļĪØļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż[11]. ņĀäļé©ļīĆĒĢÖļ│æņøÉ ņāØļ¬ģņ£żļ”¼ņ£äņøÉĒÜīņØś ņŗ¼ņØś(CNUH 05-49)ļź╝ ĒåĄĻ│╝ĒĢśņŚ¼ ļ¬©ļōĀ ĒÖśņ×ÉņØś ļÅÖņØśņä£ ņĘ©ļōØ Ēøä ņØ┤ļŻ©ņ¢┤ņĪīļŗż. ņØ╝ļ░śņĀü ĒŖ╣ņä▒ņ£╝ļĪ£ļŖö ņŚ░ļĀ╣, ņŗĀņן, ļ¬Ėļ¼┤Ļ▓ī, BMI, ņ▓┤ņżæ, ĒśłņĢĢ, ļ¦źļ░Ģ, Killip Class, ņŗ¼ļ░®ņäĖļÅÖ, Ļ│ĀĒśłņĢĢ, ļŗ╣ļć©ļ│æ, ņØ┤ņāüņ¦Ćņ¦łĒśłņ”Ø, ĒØĪņŚ░, Ļ░ĆņĪ▒ļĀź, ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ĻĖ░ņÖĢļĀź, ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤, ņĄ£ņóģ ņ¦äļŗ©ļ¬ģ, ņŻ╝ņÜö ņŗ¼ņן ņé¼Ļ▒┤ņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼ĒĢśņśĆļŗż. ņ×äņāüņĀü ĒŖ╣ņ¦Ģņ£╝ļĪ£ļŖö ĒŚżļ¬©ĻĖĆļĪ£ļ╣ł, Ēśłļŗ╣, Ēü¼ļĀłņĢäĒŗ░ļŗī, creatine kinase (CK), CK-MB, Troponin-I, ņ┤ØņĮ£ļĀłņŖżĒģīļĪż, ņżæņä▒ņ¦Ćļ░®, Ļ│Āļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪż, ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪż, high sensitivity C-reactive protein (hs-CRP), N-terminal brain natriuretic peptide (NT pro-BNP), glycated hemoglobin ļō▒ņØä ņĪ░ņé¼ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŻ╝ņÜö ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤ņ£╝ļĪ£ļŖö 1Ļ░£ņøö, 6Ļ░£ņøö, 12Ļ░£ņøöņ¦ĖņØś ņāØņĪ┤ ļČäņäØņØä ņŗ¼ņןņé¼ļ¦Ø, ļ╣äņŗ¼ņØĖņä▒ ņé¼ļ¦Øņ£╝ļĪ£ ņĪ░ņé¼ĒĢśņśĆļŗż.
ņłśņ¦æļÉ£ ņ×ÉļŻīļŖö SPSS ver. 21.0 for window (SPSS Inc., Chicago, IL, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļīĆņāüņ×ÉņØś ņØ╝ļ░śņĀü ĒŖ╣ņä▒Ļ│╝ ņ¦łļ│æ Ļ┤ĆļĀ© ĒŖ╣ņä▒ņØĆ ļ╣łļÅäņÖĆ ļ░▒ļČäņ£©, ĒÅēĻĘĀĻ│╝ Ēæ£ņżĆĒÄĖņ░©ļĪ£, ĒÅÉĻ▓Į ņĀäĒøäņŚÉ ļö░ļźĖ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”ØņØś ĒŖ╣ņ¦ĢĻ│╝ ņśłĒøäļŖö t-testļĪ£, ļīĆņāüņ×ÉņØś ņØ╝ļ░śņĀü ĒŖ╣ņä▒Ļ│╝ ņ¦łļ│æ Ļ┤ĆļĀ© ĒŖ╣ņä▒ņŚÉ ļö░ļźĖ ĒÅÉĻ▓Į ņĀäĒøäņØś ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ĒŖ╣ņ¦ĢĻ│╝ ņśłĒøäņØś ņ░©ņØ┤ļŖö Chi-Square testļĪ£ ļČäņäØĒĢśņśĆļŗż. ņŻ╝ņÜö ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤ņØś ļ░£ņāØ ņ£Āļ¼┤ņØś ļÅģļ”ĮņĀüņØĖ ņśłņĖĪ ņÜöņØĖņØä ļČäņäØņØä ņ£äĒĢ┤ņä£ļŖö ļŗ©ļ│Ćļ¤ē ĒÜīĻĘĆļČäņäØ Ļ▓░Ļ│╝ pĻ░ÆņØ┤ ņØśļ»Ė ņ׳ļŖö ļ│ĆņłśļōżļĪ£ ļŗżņżæĒÜīĻĘĆļČäņäØņØä ĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż.
ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 49.1 ┬▒ 5.6ņäĖņśĆĻ│Ā ĒÅÉĻ▓Į Ēøä ņŚ¼ņä▒ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 60.6 ┬▒ 2.6ņäĖņśĆļŗż. BMIļŖö IĻĄ░ņŚÉņä£ 24.2 ┬▒ 3.2 kg/m2ņśĆĻ│Ā IIĻĄ░ņØĆ 24.6 ┬▒ 3.3 kg/m2ļĪ£ IIĻĄ░ņŚÉņä£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż.
ņ▓┤ņżæĻ│╝ ĒÖ£ļĀź ņ¦ĢĒøäņŚÉņä£ ņłśņČĢĻĖ░ ĒśłņĢĢņØĆ ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļ®░, ņØ┤ņÖäĻĖ░ĒśłņĢĢ(IĻĄ░, 78.8 ┬▒ 17.3 mmHg vs. IIĻĄ░, 79.0 ┬▒ 16.8 mmHg; p= 0.014), ļ¦źļ░Ģ(IĻĄ░, 78.7 ┬▒ 17.9 rate/min vs. IIĻĄ░, 76.6 ┬▒ 17.7 rate/min; p= 0.014)ņØĆ IIĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż. ņ×ģņøÉņŗ£ ņĄ£ņóģ ņ¦äļŗ©ņØĆ ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. Killip classļŖö IIĻĄ░(p= 0.017)ņŚÉņä£ ļåÆņĢśļŗż. ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņ£äĒŚś ņÜöņØĖ ņżæņŚÉņä£ļŖö Ļ│ĀĒśłņĢĢ(IĻĄ░, 42.2% vs. IIĻĄ░, 59.4%; p< 0.001), ļŗ╣ļć©ļ│æ(IĻĄ░, 27.4% vs. IIĻĄ░, 35.7%; p< 0.001), ņØ┤ņāüņ¦Ćņ¦łĒśłņ”Ø(IĻĄ░, 12.9% vs. IIĻĄ░, 17.7%; p= 0.008)ņØĆ IIĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśņ£╝ļ®░, ĒØĪņŚ░(IĻĄ░, 2.7% vs. IIĻĄ░, 1.9%; p< 0.001)Ļ│╝ Ļ░ĆņĪ▒ļĀź(IĻĄ░, 12.0% vs. IIĻĄ░, 6.8%; p< 0.001)ņØĆ IĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż. ņŗ¼ļ░®ņäĖļÅÖ(IĻĄ░, 3ļ¬ģ[0.4%] vs. IIĻĄ░, 8ļ¬ģ[0.7%]; p= 0.693)ņØĆ ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśļŗż(Table 1).
ļé┤ņøÉ ņŗ£ņŚÉ ņŗ£Ē¢ēĒĢ£ ĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ Ēśłļŗ╣Ļ│╝ ļŗ╣ĒÖöĒśłņāēņåīļŖö ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. Ēśłņ▓Łņ¦Ćņ¦ł Ļ▓Ćņé¼ļŖö ņ┤Ø ņĮ£ļĀłņŖżĒģīļĪż(IĻĄ░, 185.5 ┬▒ 48.1 mg/dL vs. IIĻĄ░, 194.5 ┬▒ 47.6 mg/dL; p< 0.001)Ļ│╝ ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪż(IĻĄ░, 116.1 ┬▒ 40.8 mg/dL vs. IIĻĄ░, 125.8 ┬▒ 47.9 mg/dL; p< 0.001)ņØĆ IIĻĄ░ņŚÉņä£ ļåÆĻ▓ī ļéśĒāĆļé¼ņ£╝ļ®░, ņżæņä▒ņ¦Ćļ░®Ļ│╝ Ļ│Āļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪżņØĆ ļæÉ ĻĄ░ Ļ░ä ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. NT-proBNP, hs-CRP, creatinine, creatin kinase, CK-MB, troponin IņØĆ ļæÉ ĻĄ░ Ļ░ä ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Table 1).
ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļ░£ņāØ Ēøä ņ╣śļŻī ņĢĮļ¼╝ņØĆ aspirin, cilostazol, statin, angiotensin converting enzyme inhibitor, angiotensin receptor blocker, calcium channel blockerļŖö ļæÉ ĻĄ░ Ļ░äņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļ®░, clopidogrelņØĆ IIĻĄ░(p= 0.045)ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļ¦ÄņØ┤ ņé¼ņÜ®ļÉśņŚłļŗż. Ļ┤ĆņāüļÅÖļ¦źņżæņ×¼ņłĀņŗ£ ņé¼ņÜ®ļÉśņŚłļŹś ņĢĮļ¼╝ ņÜ®ņČ£ņŖżĒģÉĒŖĖņÖĆ ĻĖłņåŹ ņŖżĒģÉĒŖĖļŖö ļæÉ ĻĄ░ Ļ░äņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(Table 2).
1ļģä ņ×äņāüņĀü ņČöņĀü Ļ┤Ćņ░░ Ļ▓░Ļ│╝ ņŻ╝ņÜö ņŗ¼ņן ņé¼Ļ▒┤ņØĆ IĻĄ░ 51Ļ▒┤(7.6%), IIĻĄ░ 95Ļ▒┤(8.5%)ņ£╝ļĪ£ņä£(p= 0.551) ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśļŗż. ņŗ¼ņןņé¼ļ¦Ø(IĻĄ░, 5ļ¬ģ[0.7%] vs. IIĻĄ░, 14ļ¬ģ[1.3%]; p= 0.436), ļ╣äņŗ¼ņØĖņä▒ņé¼ļ¦Ø(IĻĄ░, 2ļ¬ģ[0.3%] vs. IIĻĄ░, 11ļ¬ģ[1.0%]; p= 0.171), ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø(IĻĄ░, 6ļ¬ģ[0.9%] vs. IIĻĄ░, 8ļ¬ģ[0.7%]; p= 0.894), ņ×¼Ļ┤ĆņāüļÅÖļ¦źņżæņ×¼ņłĀ(IĻĄ░, 15ļ¬ģ[2.2%] vs. IIĻĄ░, 37ļ¬ģ[3.3%]; p= 0.241), ļćīņĪĖņżæ(IĻĄ░, 1ļ¬ģ[0.1%] vs. IIĻĄ░, 4ļ¬ģ[0.4%]; p= 0.727), ņŗ¼ļČĆņĀäņ£╝ļĪ£ ņØĖĒĢ£ ņ×ģņøÉ(IĻĄ░, 3ļ¬ģ[0.4%] vs. IIĻĄ░, 4ļ¬ģ[0.4%]; p= 1.000) ļō▒ņØĆ ļæÉ ĻĄ░ Ļ░äņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(Table 3).
ļŗ©ļ│Ćļ¤ē ļČäņäØ Ļ▓░Ļ│╝ ņżæ ņØśļ»Ė ņ׳ļŖö Ļ░ÆņØä ļŗżļ│Ćļ¤ē ļČäņäØņØä ĒĢ£ Ļ▓░Ļ│╝, ļŗ╣ļć©ļ│æ(hazard ratio [HR] 1.69, 95% confidence interval [CI] 1.16-2.45, p= 0.006), ņŗ¼ļ░®ņäĖļÅÖ(HR 5.95, 95% CI 1.44-21.29, p= 0.007), ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ĻĖ░ņÖĢļĀź(HR 1.86, 95% CI 1.15-2.94, p=0.009), ļŗżĒśłĻ┤Ć ņ¦łĒÖś(HR 1.54, 95% CI 1.05-2.22, p= 0.025), Killip class (HR 1.26, 95% CI 1.02-1.54, p= 0.028), Ļ░ĆņĪ▒ļĀź(HR 1.78, 95% CI 0.99-3.03, p= 0.042)ņØĆ 1ļģä ņŻ╝ņÜö ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤ņØä ņśłņĖĪĒĢśļŖö ļÅģļ”ĮņĀüņØĖ ņ£äĒŚś ņÜöņØĖņØ┤ņŚłļŗż(Table 4 and 5).
Kaplan-Meierļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ ņāØņĪ┤ļČäņäØ Ļ▓░Ļ│╝ņŚÉņä£ ņāØņĪ┤ņ£©ļÅä ļæÉ ĻĄ░ Ļ░ä ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(Fig. 1).
ĒÅÉĻ▓ĮņØĆ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņ£äĒŚś ņØĖņ×ÉļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖö ņ¦Ćņ¦łļīĆņé¼, ĒśłņĀä ĒśĢņä▒ ņ┤ēņ¦ä ĻĘĖļ”¼Ļ│Ā ļ╣äļ¦īĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżĻ│Ā ņČöņĀĢļÉśĻ│Ā ņ׳ņ¢┤, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒĢ£ĻĄŁ ņżæļģä ņŚ¼ņä▒ņŚÉņä£ ĒÅÉĻ▓ĮĻ│╝ ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļ░£ņāØ Ēøä ņ×äņāü Ļ▓ĮĻ│╝ļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝ ĒÅÉĻ▓Į ņĀäĻ│╝ ĒÅÉĻ▓Į ĒøäņØś ņØ╝ļ░śņĀüņØĖ ĒŖ╣ņä▒ ļ░Å ņ×äņāüņĀü Ļ▓ĮĻ│╝ļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļéś, ĒÅÉĻ▓Į Ēøä ņŚ¼ņä▒ņŚÉņä£ ļŗ╣ļć©ļ│æĻ│╝ Ļ│ĀĒśłņĢĢ, ņØ┤ņāüņ¦ĆĒśłņ”ØņØ┤ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļ░£ņāØņØś ņŻ╝ņÜöĒĢ£ ņ£äĒŚś ņØĖņ×ÉņśĆņ£╝ļ®░, ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ņŚÉņä£ļŖö ĒØĪņŚ░Ļ│╝ Ļ░ĆņĪ▒ļĀźņØ┤ ņ£äĒŚś ņØĖņ×ÉņśĆļŗż.
ņĄ£ĻĘ╝ ņÜ░ļ”¼ļéśļØ╝ ņé¼ļ¦ØņøÉņØĖ ĒåĄĻ│äņŚÉ ņØśĒĢśļ®┤ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņ£╝ļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØņØ┤ ņĀäņ▓┤ ņé¼ļ¦ØņØś 2ņ£äļź╝ ņ░©ņ¦ĆĒĢśĻ│Ā ņ׳ļŗż[2]. ņŗ¼ņן ņ¦łĒÖśņ£╝ļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØļźĀņØ┤ ņØĖĻĄ¼ ņŗŁļ¦ī ļ¬ģļŗ╣ 2003ļģä 35.3ļ¬ģ, 2013ļģä 50.2ļ¬ģņ£╝ļĪ£ 10ļģäĻ░ä 42.2%ņØś ņ”ØĻ░Ćļź╝ ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż[2]. ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØĆ ņŗ¼ņןĻ│╝ ĒśłĻ┤ĆņŚÉ ļ░£ņāØĒĢśļŖö ņ¦łĒÖśņØä ļ¦ÉĒĢśļ®░ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØä ņØ┤ļŻ©ļŖö Ļ│ĀĒśłņĢĢņä▒ ņ¦łĒÖś, ĒŚłĒśłņä▒ ņŗ¼ņן ņ¦łĒÖś, ļćīĒśłĻ┤Ć ņ¦łĒÖśņØä ņØśļ»ĖĒĢ£ļŗż.
ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”ØņØĆ ņäĖĻ│äņĀüņ£╝ļĪ£ ņé¼ļ¦ØļźĀ ļ░Å ņןĻĖ░ņĀü ĻĖ░ļŖź ļČĆņĀäņØś ņŻ╝ņÜöĒĢ£ ņÜöņØĖņ£╝ļĪ£ņä£[12], ņ”ØņāüņØĆ ņĀä ĒØēļČĆ ļśÉļŖö Ēøä ĒØēļČĆļĪ£ ļ░£ņāØĒĢśļŖö ĒØēĒåĄņ£╝ļĪ£ņä£ ņ¦ōļłäļź┤ļŖö, ĒāĆļŖö ļō»ĒĢ£, ļ░öļŖśļĪ£ ņ░īļź┤ļŖö ļō»ĒĢ£ ļŗżņ¢æĒĢ£ ņ¢æņāüņ£╝ļĪ£ ļéśĒāĆļéśļŖöļŹ░, ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ļé©ņä▒ņØĆ ĒØēĒåĄ ņ”ØņāüņØ┤ ņĀäĒśĢņĀüņØĖļŹ░ ļ╣ä ņŚ¼ņä▒ņØĆ ļ╣äņĀäĒśĢņĀüņØĖ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[3,5]. ļ░£ļ│æ ņŚ░ļĀ╣ņØä ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝ ļīĆņāüņ×ÉņØś ĒÅēĻĘĀ ļéśņØ┤ļŖö ļé©ņä▒ļ│┤ļŗż ņŚ¼ņä▒ņØ┤ 10ļģä ļŹö ļŖ”Ļ▓ī ļ░£ļ│æĒĢśņśĆĻ│Ā[13], ņ¦æļŗ©ļ│ä ņŚ░ļĀ╣ ļČäĒżņŚÉņä£ ļé©ņä▒ņØĆ 50ņäĖ ņØ┤ĒĢśĻ░Ć ļ¦ÄņĢśĻ│Ā ņŚ¼ņä▒ņØĆ 70ņäĖ ņØ┤ņāüņØ┤ ļ¦ÄņĢśļŗż[3]. ĒŖ╣Ē׳ ņŚ¼ņä▒ņØĆ ĒÅÉĻ▓ĮņØä ņŗ£ņ×æņ£╝ļĪ£ ņāØļ”¼ņĀü, ņāØļ¼╝ĒĢÖņĀü ļ│ĆĒÖöĻ░Ć ņāØĻĖ░ļ®░ Ļ┤ĆņāüļÅÖļ¦ź ņ¦łĒÖś ņ£Āļ│æļźĀņØ┤ ļåÆņĢäņĪīņ£╝ļ®░[14], ĒÅÉĻ▓Į ņĀäņŚÉļŖö Ļ┤ĆņāüļÅÖļ¦ź ņ¦łĒÖś ļ░£ņāØņØ┤ ļ¦żņÜ░ ļō£ļ¼╝ņŚłļŗż[15]. Ļ░ÖņØĆ ņŚ░ļĀ╣ĻĄ░ņØä ļ╣äĻĄÉĒĢ┤ ļ│┤ņĢśņØä ļĢī ĒÅÉĻ▓Į ņØ┤ņĀä ņŚ¼ņä▒ļ│┤ļŗż ĒÅÉĻ▓Į ņŚ¼ņä▒ņŚÉņä£ Ļ┤ĆņāüļÅÖļ¦ź ņ¦łĒÖś ļ░£ņāØ ņ£äĒŚśņØ┤ 4ļ░░ņŚÉ ļŗ¼ĒĢśņśĆļŗż[16]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļśÉĒĢ£ ņżæļģä ņŚ¼ņä▒ņŚÉņä£ ĒÅÉĻ▓Į Ēøä ņŚ¼ņä▒ņØ┤ ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ņŚÉ ļ╣äĒĢ┤ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļ░£ņāØļźĀņØ┤ 3ļ░░ ņĀĢļÅä ļåÆņĢśļŗż.
ĒÅÉĻ▓Į ļ░£ņāØņŚÉ ļīĆĒĢ£ ņŚ░ļĀ╣ņØĆ ņŚ░ĻĄ¼ļ¦łļŗż ņ░©ņØ┤Ļ░Ć ļéśĒāĆļéśĻ│Ā, ĒĢ┤ļ¦łļŗż ņ”ØĻ░ĆĒĢśļŖö ņ¢æņāüņØä ļ│┤ņśĆļŗż. 1994ļģä ļ│┤Ļ│ĀļÉśņŚłļŹś ĒĢ£ĻĄŁ ņŚ¼ņä▒ņØś ĒÅÉĻ▓Į ņŚ░ļĀ╣ņØĆ ĒÅēĻĘĀ 48ņäĖņśĆĻ│Ā[17], 2001ļģä ļ│┤Ļ│ĀņŚÉņä£ļŖö ĒÅÉĻ▓Į ņŚ░ļĀ╣ņØ┤ 49.2ņäĖļĪ£ ļŗżņåī ļåÆņĢäņ¦ĆļŖö ņČöņäĖņśĆļŗż[18]. ĻĄŁņÖĖ cohort ņŚ░ĻĄ¼ņŚÉņä£ ĒÅÉĻ▓Į ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 51.4ņäĖņśĆņ£╝ļ®░[19], ļŗżļ»╝ņĪ▒ņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ŌĆśStudy of WomenŌĆÖs Health Across the Nation' ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÅÉĻ▓Į ĒÅēĻĘĀ ņŚ░ļĀ╣ņØ┤ 51.4ņäĖņśĆļŗż. ĒŖ╣ņØ┤ĒĢ£ ņ¢æņāüņØĆ ņØ╝ļ│Ė ņŚ¼ņä▒ņØ┤ ļ░▒ņØĖ ņŚ¼ņä▒ļ│┤ļŗż ĒÅÉĻ▓Į ĒÅēĻĘĀ ņŚ░ļĀ╣ņØ┤ 51.8ņäĖļĪ£ Ļ░Ćņן ļåÆņĢśļŗż[20]. 2005-2012ļģäĻ╣īņ¦Ć KAMIRņŚÉ ļō▒ļĪØļÉ£ ĒÖśņ×ÉņØś ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 50.4ņäĖļĪ£ ļéśĒāĆļé¼ļŗż. ņØ┤ Ļ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£ KAMIR ļŹ░ņØ┤Ēä░ņØś ĒÅÉĻ▓Į ņŚ░ļĀ╣ņØĆ 50.4ņäĖļ│┤ļŗż ļŹö ļåÆņĢäņ¦ł Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉśņ¢┤ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÅÉĻ▓Į ņŚ░ļĀ╣ņØä 55ņäĖ ĻĖ░ņżĆņ£╝ļĪ£ ņĀĢĒĢśņśĆņ£╝ļ®░ Ē¢źĒøä ĒÅÉĻ▓Į ņŚ░ļĀ╣ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļŹö ĒĢäņÜöĒĢśļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż.
ņŚ¼ņä▒ņØĆ ĒÅÉĻ▓ĮĻĖ░Ļ░Ć ļÉśļ®┤ ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉĒśĖļź┤ļ¬¼ņØ┤ Ļ░ÉņåīĒĢśĻ│Ā ņ▓┤ļĀźņØ┤ ĻĖēĻ▓®Ē׳ ļ¢©ņ¢┤ņ¦Ćļ®░ ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ņāØļ”¼ņĀüņØĖ ļ│ĆĒÖöĻ░Ć ļéśĒāĆļé£ļŗż. ĒÅÉĻ▓Į ņØ┤ņĀäņØś ņŚ¼ņä▒ņØĆ ĒĢŁļÅÖļ¦źĻ▓ĮĒÖöņ”Ø ņØĖņ×ÉņØĖ Ļ│Āļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪżņØś ņłśņ╣śĻ░Ć ļé©ņä▒ļ│┤ļŗż ļåÆĻ│Ā, ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪżņØś ņłśņ╣śĻ░Ć ļé«Ļ▓ī ļéśĒāĆļéśņ¦Ćļ¦ī, ĒÅÉĻ▓Į ņØ┤ĒøäņŚÉļŖö ļé£ĒżĒśĖļź┤ļ¬¼ Ļ▓░ĒĢŹņŚÉ ņØśĒĢ£ ļé£ņåī ĻĖ░ļŖźņØś ņĀĆĒĢśļĪ£ ņŚÉņŖżĒŖĖļĪ£Ļ▓É ņ×ÉĻĘ╣Ļ│╝ ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ ņłśņÜ®ņ▓┤ ĒÖ£ļÅÖņØś Ļ░ÉņåīĻ░Ć ņØ┤ļŻ©ņ¢┤ņĀĖ ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪżņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā Ļ│Āļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪżņØś ņłśņżĆņØ┤ ļé«ņĢäņĀĖņä£[21,22], ĒÅÉĻ▓ĮĻĖ░ ņŚ¼ņä▒ļōżņØś ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņ£Āļ│æļźĀņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ņøÉņØĖņØ┤ ļÉ£ļŗż[23,24]. ĒÅÉĻ▓Į ņØ┤Ēøä Ļ░ÉņåīĒĢśļŖö ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉņØĆ Ļ┤ĆņāüļÅÖļ¦źņŚÉņä£ ĒśłĻ┤ĆņØä ļ│┤ĒśĖĒĢśļŖö ĻĖ░ņĀäņØĖ ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ ņé░ĒÖöņØś ņ¢ĄņĀ£, ņĮ£ļĀłņŖżĒģīļĪżņØś ĒśłĻ┤Ćļ▓Į ļé┤ ņ£Āņ×ģ ņ¢ĄņĀ£, ĒśłĻ┤Ćļ▓Įņ£╝ļĪ£ļČĆĒä░ ņĮ£ļĀłņŖżĒģīļĪż ņ£ĀņČ£ ņ”ØĻ░Ć, ĒśłĻ┤Ć ĒÅēĒÖ£ĻĘ╝ņäĖĒż ļ░Å myoinitial cellņØś ņ”ØņŗØ ņ¢ĄņĀ£, collagenĻ│╝ elastin ņāØņä▒ņØä ņ¢ĄņĀ£, ĒśłņåīĒīÉņØś ņØæņ¦æ ņ¢ĄņĀ£, prostacyclinņØś ņāØņä▒ņØä ņ”ØĻ░Ćņŗ£ņ╝£ ņŻĮņāüļÅÖļ¦źĻ▓ĮĒÖöņ”ØņØś ĒśĢņä▒ņØä ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ļŗż[25-27]. ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ņŚÉņä£ļÅä ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉņØś ņłśņ╣śĻ░Ć ļé«ņØĆ ņŚ¼ņä▒ņØĆ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖś ņ£äĒŚśļÅäĻ░Ć ļŹö ļåÆņĢäņ¦ÉņØä ļ│╝ ņłś ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ĒÅÉĻ▓Į Ēøä ĻĄ░ņŚÉņä£ ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪżņØ┤ ļåÆņĢśļŗż.
ĒÅÉĻ▓Į ņŚ¼ņä▒ņŚÉņä£ ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉĒśĖļź┤ļ¬¼ ņ╣śļŻīļź╝ ĒåĄĒĢ┤ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖś ļ░£ņāØņØ┤ Ļ░ÉņåīļÉ©ņØä ļ│╝ ņłś ņ׳ņŚłļŹś Ļ▓░Ļ│╝[28]ņÖĆ ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ņŚÉņä£ļÅä ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉņØś ņłśņ╣śĻ░Ć ļé«ņØĆ ņŚ¼ņä▒ņØĆ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖś ņ£äĒŚśļÅäĻ░Ć ļŹö ļåÆņĢäņ¦ÉņØä ļ│╝ ņłś ņ׳ļŗż[29]. ĻĘĖļ¤¼ļéś ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÅÉĻ▓Į ņĀäĒøä ļæÉ ĻĄ░ Ļ░äņŚÉ ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļ░£ņāØ Ēøä ņØ╝ ļģäĻ░ä ņŻ╝ņÜö ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤ņŚÉļŖö Ēü¼Ļ▓ī ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż.
ņØ╝ļ░śņĀüņ£╝ļĪ£ ĒÅÉĻ▓Į ņĀäĒøä ņŚ¼ņä▒ļōżņØĆ ņ▓┤ņżæņØ┤ ņĀÉņ░© ņ”ØĻ░ĆĒĢśĻ▓ī ļÉśļ®░, ņ▓┤ņ¦łļ¤ēņ¦ĆņłśĻ░Ć ņ”ØĻ░ĆĒĢśļ®┤ ĒśłņĢĢņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ņ▓┤ņ¦łļ¤ēņ¦ĆņłśĻ░Ć 25 ņØ┤ņāüņØ╝ ļĢīļŖö ņĮ£ļĀłņŖżĒģīļĪżņØ┤ ļåÆņĢäņ¦Ćļ®░ ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒/Ļ│Āļ░ĆļÅäņ¦Ćļŗ©ļ░▒ņØś ļ╣äĻ░Ć ņ”ØĻ░ĆļÉśņŚłļŗż[22]. ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöļŖö Ļ┤ĆņāüļÅÖļ¦ź ņ¦łĒÖśņØś ņ£äĒŚś ņØĖņ×ÉņŚÉ ĒĢ┤ļŗ╣ņØ┤ ļÉśļ»ĆļĪ£ Ļ│╝ņ▓┤ņżæ ļ╣äļ¦ī ņŚ¼ņä▒ļōżņŚÉĻ▓īļŖö Ļ┤Ćļ”¼Ļ░Ć ņżæņÜöĒĢśļŗż[22]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÅÉĻ▓Į ņĀäĻ│╝ ĒøäņŚÉ ļ╣äļ¦īļÅäļŖö Ēü░ ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļéś ĒÅÉĻ▓Į Ēøä ņŚ¼ņä▒ņŚÉņä£ļŖö ņØ┤ņāüņ¦ĆĒśłņ”ØņØ┤ ļŹö ņ”ØĻ░ĆļÉśļŖö Ļ▓āņØä ļ│╝ ņłś ņ׳ņŚłņ£╝ļ®░, ņØ┤ņÖäĻĖ░ĒśłņĢĢņØĆ ņØśļ»Ė ņ׳Ļ▓ī ĒÅÉĻ▓Į Ēøä ĻĄ░ņŚÉņä£ ļåÆņĢśļŗż.
ĒØĪņŚ░Ļ│╝ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØĆ ļ░ĆņĀæĒĢ£ Ļ┤ĆļĀ©ņØ┤ ņ׳ņ£╝ļ®░, ĒØĪņŚ░ņØĆ ĒÅÉĻ▓Į ņŚ░ļĀ╣ņØä ņĢ×ļŗ╣ĻĖ┤ļŗżļŖö Ļ▓░Ļ│╝ļōżņØ┤ ņ׳ļŗż[8]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ņŚÉņä£ļŖö ĒØĪņŚ░ņØ┤ ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļ░£ņāØ ņ£äĒŚś ņØĖņ×ÉļĪ£ņŹ© ņØśļ»Ė ņ׳ļŖö Ļ▓░Ļ│╝ļĪ£ ļČäņäØļÉśņŚłļŗż. ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ĒÅÉĻ▓Įņ£╝ļĪ£ ņØĖĒĢ£ ņŚÉņŖżĒŖĖļĪ£Ļ▓ÉņØś ļČĆņĪ▒, ĒØĪņŚ░, ļ╣äļ¦ī, ņ¦Ćļŗ©ļ░▒ņØś ļ│ĆĒÖö, ņÜ┤ļÅÖ ļČĆņĪ▒ ļō▒ņØĆ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖś ņ£äĒŚśļÅäļź╝ ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņ£╝ļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØĻ│╝ ļ░ĆņĀæĒĢ£ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżļŖö Ļ▓āņØä ļ│╝ ņłś ņ׳ņŚłļŗż[23,24].
ĒĢ£ĻĄŁņØĖ ņĀŖņØĆ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ĒÖśņ×É ņżæ 40ņäĖ ņĀäĒøä ņ¢æ ĻĄ░ņØä ļīĆņāüņ£╝ļĪ£ ņŻ╝ņÜö ņŗ¼ņן ņé¼Ļ▒┤ ļ░Å 1ļģäĻ░ä ļ¼┤ņé¼Ļ▒┤ ņāØņĪ┤ņ£©ņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ņ¢æ ĻĄ░ Ļ░äņØś ņ£ĀņØśĒĢ£ ĒåĄĻ│äņĀü ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļ®░[30], ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Øņ£╝ļĪ£ ļé┤ņøÉĒĢ£ 75ņäĖ ņØ┤ņāüņØś ļģĖņØĖ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņĀŖņØĆ ļīĆņĪ░ĻĄ░Ļ│╝ ņŻ╝ņÜö ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤ņØś ņ░©ņØ┤ļź╝ 1ļģäĻ░ä ņČöņĀüĒĢ£ Ļ▓░Ļ│╝ ņ¢æ ĻĄ░ņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż[31]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ĒÅÉĻ▓ĮņØ┤ ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ļ░£ņāØņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śĻ│Ā ļ░£ņāØ Ēøä ņŻ╝ņÜö ņŗ¼ĒśłĻ┤Ć ņé¼Ļ▒┤ņŚÉņä£ļÅä ĒÅÉĻ▓Į Ēøä ņżæļģä ņŚ¼ņä▒ņŚÉņä£ ļŹö ļåÆņØä Ļ▓āņØ┤ļØ╝Ļ│Ā ņśłņĖĪĒĢśņśĆņ¦Ćļ¦ī, ņ£äņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ Ļ░ÖņØ┤ ņ¢æ ĻĄ░ Ļ░äņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ņśłņĖĪĒĢśĻ▒┤ļīĆ ņØśĒĢÖņØś ļ░£ļŗ¼ļĪ£ ļŗżņ¢æĒĢ£ ņóŗņØĆ ņ╣śļŻīņĢĮļōżĻ│╝ ņŖżĒģÉĒŖĖ, ņŗØņØ┤ņÜöļ▓ĢĻ│╝ ņÜ┤ļÅÖņŚÉ ļīĆĒĢ£ ĻĄÉņ£Īņ£╝ļĪ£ ļ░£ņāØ Ēøä Ļ┤Ćļ”¼Ļ░Ć ņלļÉśĻ│Ā ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņŚ¼ņ¦äļŗż. ĒĢśņ¦Ćļ¦ī ĒÅÉĻ▓Į ņĀä ņżæļģä ņŚ¼ņä▒ļōżņØś Ļ▒┤Ļ░ĢĻ┤Ćļ”¼Ļ░Ć ļČĆņĪ▒ĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņŚ¼ņ¦Ćļ»ĆļĪ£ ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ļōżņŚÉ ļīĆĒĢ£ ņ¦æņżæņĀüņØĖ Ļ┤Ćļ”¼Ļ░Ć ĒĢäņÜöĒĢśļ®░, ņןĻĖ░Ļ░ä ņČöņĀü Ļ┤Ćņ░░ņØś ĒĢäņÜöņä▒ņØ┤ ņÜöĻĄ¼ļÉ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņØĆ ĒøäĒ¢źņĀüņØ┤ļ®░ ĒÅÉĻ▓Į ņĀä ĻĘĖļŻ╣ņØś Ēæ£ļ│ĖņłśĻ░Ć ĒÅÉĻ▓Į Ēøä ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņĀüņŚłļŗż. ļśÉĒĢ£ KAMIRņŚÉ ļō▒ļĪØļÉ£ ļŗżĻĖ░Ļ┤ĆņØś ļīĆĻĘ£ļ¬© ļŹ░ņØ┤Ēä░ļź╝ ĒÖ£ņÜ®ĒĢśņŚ¼ ĒÅÉĻ▓ĮņØś ņĀĢĒÖĢĒĢ£ ņŚ░ļĀ╣ņØä ņĢī ņłś ņŚåņŚłļŗżļŖö ņĀÉņØ┤ļŗż. ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ļ¼ĖĒŚīĻ│Āņ░░ņØä ĒåĄĒĢ┤ ĒÅÉĻ▓Įņ£╝ļĪ£ ņØĖĒĢ£ ņŚÉņŖżĒŖĖļĪ£Ļ▓É ļČäļ╣äņØś Ļ░ÉņåīĻ░Ć ņ▓┤ņżæ ņ”ØĻ░Ć, ļŗ╣ļć©, Ļ│ĀĒśłņĢĢ, ņĀĆļ░ĆļÅä ņ¦Ćļŗ©ļ░▒ņĮ£ļĀłņŖżĒģīļĪżņØś ņ”ØĻ░Ć ļō▒ņØś ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ļ│ĆĒÖöļź╝ ņśżĻ▓ī ĒĢśļŖö ņÜöņØĖņ£╝ļĪ£ ļ│┤ņŚ¼ņ¦ĆĻ│Ā, ļśÉĒĢ£ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņ£äĒŚś ņÜöņØĖļōżĻ│╝ ļ░ĆņĀæĒĢ£ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ĻĘĖļ¤¼ļéś ļ│Ė ņŚ░ĻĄ¼ļŖö ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļĪ£ņŹ© ĒÅÉĻ▓Į Ēøä ņŚ¼ņä▒ĒśĖļź┤ļ¬¼ ņÜöļ▓Ģ ļō▒ņØś ņ╣śļŻī ņŚ¼ļČĆņŚÉ ļīĆĒĢ£ ņĪ░ņé¼Ļ░Ć ļÉśņ¢┤ ņ׳ņ¦Ć ņĢŖņĢäņä£ ņŚ¼ņä▒ĒśĖļź┤ļ¬¼ ņ╣śļŻī ņĀäĒøäņØś ņ░©ņØ┤ļź╝ ņĢī ņłś ņŚåņŚłļŗż, Ē¢źĒøä ĒÅÉĻ▓Į Ēøä ņŚ¼ņä▒ņØś ĒśĖļź┤ļ¬¼ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņ×ÉļŻīļź╝ ņČöĻ░ĆĒĢśņŚ¼ ņŚ░ĻĄ¼Ļ░Ć ļŹö ĒĢäņÜöĒĢĀĻ▒░ļØ╝ ņāØĻ░üļÉ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ņĀ£ĒĢ£ņĀÉņØä ļ│┤ņÖäĒĢśņŚ¼ ņןĻĖ░Ļ░äņØś ņ×äņāüņĀü Ļ┤Ćņ░░ņØä ĒåĄĒĢ┤ ņżæļģä ņŚ¼ņä▒ņØś ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ĒÖśņ×ÉņØś ĒÜ©Ļ│╝ņĀüņØĖ ņ╣śļŻīņÖĆ Ļ┤Ćļ”¼ļź╝ ņ£äĒĢ£ ĻĖ░ņ┤ł ņ×ÉļŻīļź╝ ļ¦łļĀ©ĒĢśĻ│Ā ĒÅÉĻ▓Į ņĀä ņżæļģä ņŚ¼ņä▒ ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø ĒÖśņ×ÉņØś ņ¦æņżæņĀüņØĖ Ļ┤Ćļ”¼ļĪ£ ņśłĒøäļź╝ Ē¢źņāüņŗ£Ēé¼ ņłś ņ׳ļŖö ĻĖ░ņ┤ł ņ×ÉļŻīļź╝ ļ¦łļĀ©ĒĢśĻ│Āņ×É ĒĢ£ļŗż.
REFERENCES
1. Center for Disease Control & Prevention. Korea National Health and Nutrition Examination Survey in 2013 [Internet]. Ceongju (KR): Center for Disease Control & Prevention, c2015. [cited 2015 Jan 20]. Available from: http://stat.mohw.go.kr/front/statData/publicationView.jsp?menuId=47&bbsSeq=13&nttSeq=21549&searchKey=&searchWord=&nPage=1&topSelect=
2. Korean Statistical Information Service. Cause of Death Statistics [Internet]. Daejeon (KR): Korean Statistical Information Service, c2014. [cited 2014 Sep 23]. Available from: http://kostat.go.kr/portal/korea/kor_nw/2/1/index.board?bmode=read&aSeq=330181
3. Milner KA, Vaccarino V, Arnold AL, Funk M, Goldberg RJ. Gender and age differences in chief complaints of acute myocardial infarction (Worcestor Heart Attack Study). Am J Cardiol 2004;93:606ŌĆō608.


4. Health Insurance Review & Assessment Service. Evaluation result of Acute Myocardial Infarction in 2013 [Internet]. Wonju (KR): Health Insurance Review & Assessment Service, c2013. [cited 2013 Dec 12]. Available from: http://www.hira.or.kr/dummy.do?pgmid=HIRAA020041000000&cmsurl=/cms/inform/02/1322009_27116.html&subject=%ec%8b%ac%ed%8f%89%ec%9b%90+%ea%b8%89%ec%84%b1%ec%8b%ac%ea%b7%bc%ea%b2%bd%ec%83%89%ec%a6%9d+%ed%8f%89%ea%b0%80+%ea%b2%b0%ea%b3%bc%2c+%ec%b9%98%eb%a3%8c%eb%8a%94+%ec%84%b8%ea%b3%84%ec%a0%81+%ec%88%98%ec%a4%80
5. Isaksso RM, Holmgren L, Lundblad D, Brulin C, Eliasson M. Time trends in symptoms and prehospital delay time in women vs. men with myocardial infarction over a 15-year period. The Northern Sweden MONICA study. Eur J Cardiovasc Nurs 2008;7:152ŌĆō158.


6. van der Schouw YT, van der Graaf Y, Steyerberg EW, Eijkemans JC, Banga JD. Age at menopause as a risk factor for cardiovascular mortality. Lancet 1996;347:714ŌĆō718.


7. Yeoum SG. The investigation on the risk factors of cardiovascular disease for postmenopausal women over 50 years. J Menopausal Med 2003;9:3.
8. Crawford SL, Johannes CB. The epidemiology of cardiovascular disease in postmenopausal women. J Clin Endocrinol Metab 1999;84:1803ŌĆō1806.

9. Gaspard UJ, Gottal JM, van den Br├╗le FA. Postmenopausal changes of lipid and glucose metabolism: a review of their main aspects. Maturitas 1995;21:171ŌĆō178.


10. Stemfeld B, Bhat AK, Wang H, Sharp T, Quesenberry CP Jr. Menopause, physical activity, and body composition/fat distribution in midlife women. Med Sci Sports Exerc 2005;37:1195ŌĆō1202.


11. Jeong MH. Can time delay be shortened in the treatment of acute myocardial Infarction?: Experience from Korea acute myocardial Infarction registry. Korean J Med 2010;78:582ŌĆō585.
12. Moshki M, Zareie M, Hashemizadeh H. Sex difference in acute myocardial infarction. Nurs Midwifery Stud 2015;4:e22395.

13. Lloyd-Jones D, Adams R, Carnethon M, et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2009;119:e21ŌĆōe181.


14. Tackett AH, Bailey AL, Foody JM, et al. Hormone replacement therapy among postmenopausal women presenting with acute myocardial infarction: insights from the GUSTO-III trial. Am Heart J 2010;160:678ŌĆō684.


15. Jneid H, Thacker HL. Coronary artery disease in women: different often undertreated. Cleve Clin J Med 2001;68:441ŌĆō448.


16. Rosengren A, Spetz CL, K├Čster M, Hammar N, Alfredsson L, Ros├®n M. Sex differences in survival after myocardial infarction in Sweden; data from the Swedish National Acute Myocardial Infarction Register. Eur Heart J 2001;22:314ŌĆō322.


17. The Korean society of Menopause, Lee JY, Koo BS, et al. Management of menopausal women. 1st ed. Seoul: Kalbinseojeok, 1994.
18. Park YJ, Koo BS, Kang HC, Chun SH, Yoon JW. The menopausal age and climacteric symptoms and the related factors of Korean women. Korean J Women Health Nurs 2001;7:473ŌĆō485.

19. Henderson KD, Bernstein L, Henderson B, Kolonel L, Pike MC. Predictor of timing of natural menopause in the multiethnic cohort study. Am J Epidemiol 2008;167:1287ŌĆō1294.


20. Gold EB, Bromberger J, Crawford S, et al. Factors associated with age at natural menopause in a multiethnic sample of midlife women. Am J of Epidemiol 2001;153:865ŌĆō874.

21. Grundy SM. Cholesterol and coronary heart disease. Future directions. JAMA 1990;264:3053ŌĆō3059.


22. Brown CD, Higgins M, Donato KA, et al. Body mass index and the prevalence of hypertension and dyslipidemia. Obes Res 2000;8:605ŌĆō619.


23. Kuller LH, Gutai JP, Meilahn E, Matthews KA, Plantinga P. Relationship of endogenous sex steroid hormones to lipids and apoproteins in postmenopausal women. Arteriosclerosis 1990;10:1058ŌĆō1066.


24. Frost PH, Davis BR, Burlando AJ, et al. Coronary heart disease risk factors in men and women aged 60 years and older: findings from the Systolic Hypertension in the Elderly Program. Circulation 1996;94:26ŌĆō34.


25. Ford ES, DeStefano F. Risk factors for mortality from all causes and from coronary heart disease among persons with diabetes. Findings from the National Health and Nutrition Examination Survey I Epidemiologic Follow-up Study. Am J Epidemiol 1991;133:1220ŌĆō1230.

26. Singh AT, Rainwater DL, Haffner SM, et al. Effect of diabetes on lipoprotein size. Arterioscler Thromb Vasc Biol 1995;15:1805ŌĆō1811.


27. Vogel RA. Coronary risk factors, endothelial function, and artherosclerosis: a review. Clin Cardiol 1997;20:426ŌĆō432.


28. Glasser SP, Selwyn AP, Ganz P. Atherosclerosis: risk factors and the vascular endothelium. Am Heart J 1996;131:379ŌĆō384.


29. Tannen RL, Weiner MG, Xie D, Barnhart K. Estrogen affects post-menopausal women differently than estrogen plus progestin replacement therapy. Hum Reprod 2007;22:1769ŌĆō1777.


Kaplan-Meier curve of major adverse cardiac events (MACE)-free survival in menopausal (dotted black line) and pre-menopausal women (solid black line) at the one-year follow-up. HR, hazard ratio; CI, confidence interval.
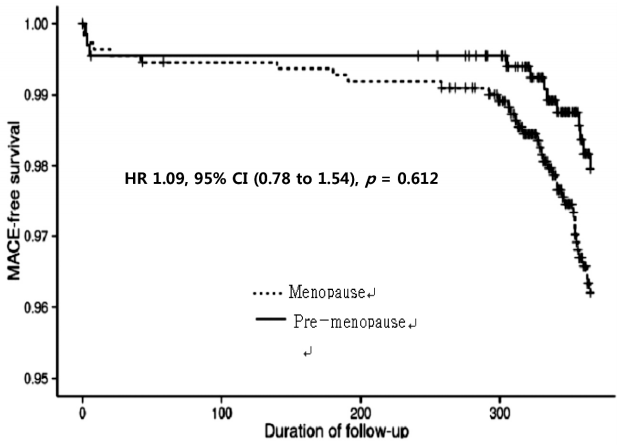
Figure┬Ā1.
Table┬Ā1.
Baseline clinical characteristics of the subjects
Values are presented as mean ┬▒ SD or n (%).
SBP, systolic blood pressure; DBP, diastolic blood pressure; HR, heart rate; NSTEMI, non-ST-segment elevation myocardial infarction; STEMI, ST-segment elevation myocardial infarction; MI, myocardial infarction; HDL, high-density lipoprotein; LDL, low-density lipoprotein; NT-proBNP, N-terminal brain natriuretic peptide; hs-CRP, high-sensitivity C-reactive protein; HbA1C, glycosylated hemoglobin; CK-MB, creatin kinase myoglobin; TnI, troponin-I.
Table┬Ā2.
Therapeutic modalities for myocardial infarction
Table┬Ā3.
One-year clinical outcomes
Table┬Ā4.
Results of univariate logistic regression
Table┬Ā5.
Multiple logistic regression analysis for the independent predictors of major adverse cardiac events
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 11,522 View
- 234 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



