ApoE 결손 생쥐에서 FXR 결핍과 피오글리타존이 동맥경화에 미치는 영향
Effects of FXR Deficiency and Pioglitazone on Atherosclerosis in ApoE-Knockout Mice
Article information
Abstract
목적:
Farnesoid X receptor (FXR)와 peroxisome proliferator-activated receptor (PPAR)는 둘 다 지질 대사와 동맥경화에 중요한 역할을 담당하고 있어 이들의 상호작용에 대해 알아보고자 하였다.
방법:
아포지질단백질 E가 결손된(ApoE-/-) 생쥐에 추가로 FXR을 결손시켜 ApoE-/-FXR-/- 생쥐를 만들었다. 생쥐는 ApoE-/-군, ApoE-/-FXR-/-군, ApoE-/-FXR-/- + pioglitazone군, 3군으로 나누어 12주간 고지방 고콜레스테롤 식이를 먹였고 ApoE-/-FXR-/- + pioglitazone군은 pioglitazone을 하루에 몸무게 kg당 20 mg을 식이에 섞어 투여하였다. 이후 체중, 혈당, 혈청 지질 농도, 간효소치를 측정하였다. 대동맥에서 Oil red O 염색을 통해 동맥경화반을 평가하였다.
결과:
세 군 사이에 체중과 혈당에는 차이가 없었다. ApoE-/-FXR-/-군은 ApoE-/-군에 비하여 모든 종류의 지질 농도와 간 효소치가 유의하게 증가하였다(p< 0.01). ApoE-/-FXR-/- + pioglitazone군은 ApoE-/-FXR-/-군에 비하여 HDL 콜레스테롤과(55 ± 4 mg/dL vs. 28 ± 2 mg/dL, p< 0.01) LDL 콜레스테롤이(797 ± 26 mg/dL vs. 682 ± 47 mg/dL, p= 0.04) 유의하게 감소하였다. 동맥경화반은 ApoE-/-군, ApoE-/-FXR-/-군, ApoE-/-FXR-/- + pioglitazone군에서 각각 2.7 ± 0.2%, 7.7 ± 1.2%, 18.6 ± 1.0%로 증가하였다. ApoE-/-FXR-/- 생쥐에서 pioglitazone의 투여는 유의하게 동맥경화를 증가시켰다(p= 0.02)
결론:
본 연구에서 ApoE-/-FXR-/- 생쥐에서 pioglitazone의 투여는 동맥경화반의 발생을 증가시켜 FXR이 억제된 상태에서 PPARγ의 활성화는 동맥경화에 나쁜 영향을 미칠 수 있음을 시사하였다.
Trans Abstract
Background/Aims:
Both the farnesoid X receptor (FXR) and peroxisome proliferator-activated receptor (PPAR) play importantroles in lipid metabolism and atherosclerosis. We investigated the interaction between FXR and PPARγ.
Methods:
Apolipoprotein E knockout (ApoE-/-) mice and FXR knockout (FXR-/- mice were crossed to generate ApoE-/-FXR-/-mice. The mice were divided into ApoE-/- ApoE-/-FXR-/- and ApoE-/-FXR-/- + pioglitazone groups. All mice were fed a high-fat,high-cholesterol diet for 12 weeks. The ApoE-/-FXR-/- + pioglitazone group was also treated with pioglitazone, 20 mg/kg bodyweight. Body weight, blood glucose level, lipid profile, and liver enzyme levels were measured. To evaluate atherosclerotic lesions,the aorta was stained with Oil red O.
Results:
There were no differences in body weight or blood glucose level among the three groups. The serum lipid concentrationand liver enzyme levels increased in the ApoE-/-FXR-/- group compared with the ApoE-/- group (p< 0.01). The ApoE-/-FXR-/- +pioglitazone group had lower high-density lipoprotein (HDL) (55 ± 4 vs. 28 ± 2 mg/dL, p< 0.01) and low-density lipoprotein(LDL) (797 ± 26 vs. 682 ± 47 mg/dL, p= 0.04) cholesterol than the ApoE-/-FXR-/- group. The respective percentages of aorticatherosclerotic plaques in the ApoE-/- ApoE-/-FXR-/- and ApoE-/-FXR-/- + pioglitazone groups were 2.7 ± 0.2%, 7.7 ± 1.2%, and18.6 ± 1.0%. In ApoE-/-FXR-/- mice, the administration of pioglitazone significantly increased the number of atherosclerotic lesions(p= 0.02).
Conclusions:
Pioglitazone increased the number of atherosclerotic plaques in ApoE-/-FXR-/- mice. This suggests that when FXR isinhibited, the activation of PPARγ can aggravate atherosclerosis. (Korean J Med 2013;84:238-244)
서 론
고지혈증은 동맥경화를 일으키는 중요한 위험인자이다. 지질의 항상성 유지에 여러 인자들이 관여하는데 그 중 하나가 핵수용체이다. Farnesoid X receptor (FXR)는 핵수용체의 하나로 담즙산이 결합하면 활성화되며, 그 자체가 담즙산의 대사에서 중요한 역할을 담당하고 있다[1]. FXR은 담즙산의 조절을 통해서 지질의 대사에도 깊이 관여하고 있다. 뿐만 아니라 FXR은 초저밀도지질단백질(very low-density lipoprotein, VLDL)이나 저밀도지질단백질(low-density lipoprotein, LDL)로부터 고밀도지질단백질(high-density lipoprotein, HDL)로 인지질(phospholipid)을 전달하는 단백질의 발현을 유도하여 HDL 생성을 촉진하고[2], 간에서 scavenger receptor B1 (SR-B1)의 발현을 촉진하여 역 콜레스테롤 수송(reverse cholesterol transport)을 증가시킨다[3]. 또한, FXR은 아포지질 단백질 CII (apolipoprotein CII, ApoCII)의 발현을 촉진하고 ApoCIII의 발현은 억제함으로써 lipoprotein lipase의 활성을 증가시켜 혈중 중성지방(triglyceride)을 감소시킨다[4]. 더불어, 간에서 sterol-response-element-binding protein 1c (SREBP1c), fatty-acid synthase (FAS)의 발현을 억제하여 간에서 중성지방 합성을 감소시킨다[5].
이처럼 FXR은 지질 대사에서 중요한 역할을 차지하고 있어, FXR의 기능 변화는 동맥경화에 영향을 줄 가능성이 있다. 지금까지의 동물 실험 결과를 살펴보면, FXR 작용제를 투여할 경우 ApoE를 결손시킨(ApoE-/-) 생쥐에서 동맥경화가 감소하였고[6], 반면에 FXR을 ApoE와 함께 결손시킨(ApoE-/- FXR-/-) 생쥐의 경우 동맥경화가 증가하였다[7]. 그러나 FXR을 LDL 수용체와 함께 결손시킨(FXR-/-LDLR-/-) 생쥐에서는 동맥경화가 감소하였다는 보고도 있어[8] FXR이 어떤 신호기전을 활성화하는가에 따라 동맥경화에 미치는 영향이 다를 가능성이 있다.
Thiazolidinedione (TZD)계 약물의 수용체로서 잘 알려진 핵수용체인 peroxisome proliferator-activated receptor (PPAR) 또한 지질 대사에 중요한 역할을 담당하고 있으며[9], 동맥경화의 발생에도 영향을 미쳐서, 동맥경화의 동물 모델인 ApoE-/- 생쥐나 LDLR-/- 생쥐에서 PPAR-γ 작용제를 투여한 경우 동맥경화가 감소함이 보고된 적이 있다[10,11].
그런데 기존에 보고된 다음의 연구 결과들은 FXR과 PPAR 사이에 상호작용이 있을 가능성을 시사하고 있다. 먼저, FXR과 PPAR 모두 retinoid X receptor (RXR)와 결합하여 이형이합체(heterodimer)를 형성하여 여러 가지 유전자들의 발현을 조절하므로[12] FXR과 PPAR이 서로 영향을 미칠 가능성이 있다. 또한, FXR은 PPAR gamma coactivator-1α (PGC-1α)를 활성화시키는데[13] PGC-1α는 PPARγ의 중요한 보조활성제(coactivator) 중 하나이므로 FXR의 활성화는 PPARγ를 활성화시킬 가능성이 있다. 실제로, 간세포와 간경화 쥐모델에서 FXR 작용제가 PPARγ를 활성화하였다는 보고가 있으며[14], 반대로 PGC-1α의 활성화가 FXR을 활성화시킨다는 보고도 있다[15].
FXR과 PPAR가 서로 영향을 미칠 가능성은 있으나, 동맥경화에 미치는 이들의 상호작용에 대해서는 아직까지 거의 밝혀진 바가 없다. 그러므로 본 연구에서는 동맥경화의 발생에 있어서 PPAR와 FXR이 어떠한 상호작용을 하는지 알기 위해 동맥경화의 동물모델인 ApoE-/- 생쥐에 추가로 FXR을 결손시켜 지질 대사 장애 및 동맥경화를 유도하고 PPARγ의 작용제 중 한 가지인 pioglitazone을 투여하여 이를 차단할 수 있는지를 보고자 하였다.
대상 및 방법
재료
PPARγ의 작용제인 pioglitazone (Actos®, 한국릴리, 서울)은 시중에서 판매하는 것을 구입하여 미세한 분말가루로 만든 후 고지방 고콜레스테롤 식이에 고르게 혼합하고 방사선을 조사하여 멸균하였다. Pioglitazone과 식이의 혼합제조는 지바이오(과천, 경기도)에 의뢰하였다.
실험 동물
ApoE-/- 생쥐는 잭슨 연구소(Jackson Laboratory, Sacramento, CA, 미국)로부터 구입하였다. FXR-/- 생쥐는 National Institutes of Health (NIH, Maryland 20892, 미국) Gonzalez 박사의 허락을 받고 베일러 의대(Dr. Moore; Baylor College of Medicine, Houston, Texas, 미국)로부터 반입하였다. ApoE-/- 생쥐와 FXR-/- 생쥐를 교배하여 ApoE-/-FXR-/- 생쥐를 만들었다. ApoE-/- 생쥐와 ApoE-/-FXR-/- 생쥐에 생후 12주부터 지방 21%, 콜레스테롤 0.21%를 포함하는 고지방 고콜레스테롤 식이(Research Diets, Inc. New Brunswick, NJ, 미국)를 12주간 먹였다. 생쥐는 ApoE-/-군, ApoE-/-FXR-/-군, ApoE-/-FXR-/- + pioglitazone군, 3군으로 나누었고, 군당 7-16마리로 구성되었다(ApoE-/-군 16마리, ApoE-/- FXR-/-군 15마리, ApoE-/-FXR-/- + pioglitazone군 7마리). ApoE-/- FXR-/- + pioglitazone군에는 pioglitazone을 하루에 몸무게 kg당 20 mg을 식이에 섞어 투여하였다
모든 생쥐는 플라스틱 우리에서 키웠고, 식이와 음수를 자유롭게 먹도록 하였다. 고지방 고콜레스테롤 식이를 시작한 날부터 실험이 종료되는 12주 동안 7일 간격(주 1회)으로 모든 생쥐의 체중 및 사료 섭취량을 측정하였다. 이를 통해 군당 사료 섭취량이 차이가 없었고, pioglitazone이 20 mg/kg 정도의 용량으로 섭취됨을 확인하였다(data not shown). 사육실의 온도는 23 ± 2℃, 습도는 60 ± 10%를 유지하였고 명암 주기는 12시간으로 조절하였다. 실험이 종료된 후 생쥐는 마취하여 희생하였다.
본 연구에서 모든 동물실험은 분당서울대병원 전임상실험실의 동물실험 윤리위원회(Institutional Animal Care and Use Committee, IACUC)의 승인하에 전임상실험실의 표준작업지침서(Standard Operation Procedures, SOP)에 따라 수행하였다.
혈당 측정
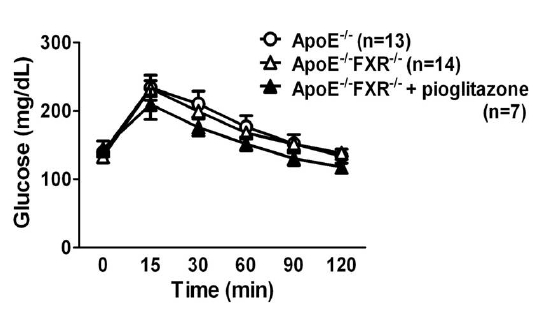
혈당은 꼬리 정맥에서 혈액을 얻은 뒤 혈당측정기(ACCU-CHEK Active, Roche, Mannheim, 독일)를 이용하여 측정하였다. 모든 생쥐는 고지방 고콜레스테롤 식이 투여 12주째에 복강내 당부하 검사(intraperitoneal glucose tolerance test, IPGTT)를 실시하였다. 검사는 생쥐를 6시간 금식시킨 후 기저 혈당 및 체중을 측정하고, 50% 포도당 용액 1 g/kg을 복강내로 주사하고 주입 후 15, 30, 60, 90, 120분이 경과한 후에 꼬리 정맥에서 말초 혈액을 채취하여 혈당을 측정하였다.
혈액 분석
채혈은 생쥐를 6시간 금식시킨 후 복강내에 zoletil 50 (80-100 mg/kg)과 rompun (10 mg/kg)을 투여하여 마취 유도 후 시행되었다. 마취된 생쥐를 개복한 뒤 23게이지 1 mL 주사기를 이용하여 후대정맥으로부터 최소 0.5 mL 이상의 혈액을 채취하였다. 채취된 혈액은 silica particle이 코팅되어 있는 혈청분리형 시험관(serum separation tube, SST)에 담아 상온에서 30분 방치한 후 3,000 rpm에서 10분 동안 원심 분리하여 혈청(serum)을 얻었다. 분리된 혈청은 멸균된 1.5 mL 용기에 옮겨져 측정 전까지 -80℃ 초저온 냉동고(deep freezer)에 보관하였다.
총 콜레스테롤, 중성지방, HDL 콜레스테롤, LDL 콜레스테롤, aspartate aminotransferase (AST), alanine aminotransferase (ALT)를 자동혈액화학분석기(Beckman Coulter AU480 automatic biochemistry analysis system, 일본)를 이용하여 측정하였다. 혈청 인슐린 농도는 방사면역측정법을 이용하여 측정하였다(Millipore, Billerica, MA, 미국).
동맥경화반 측정
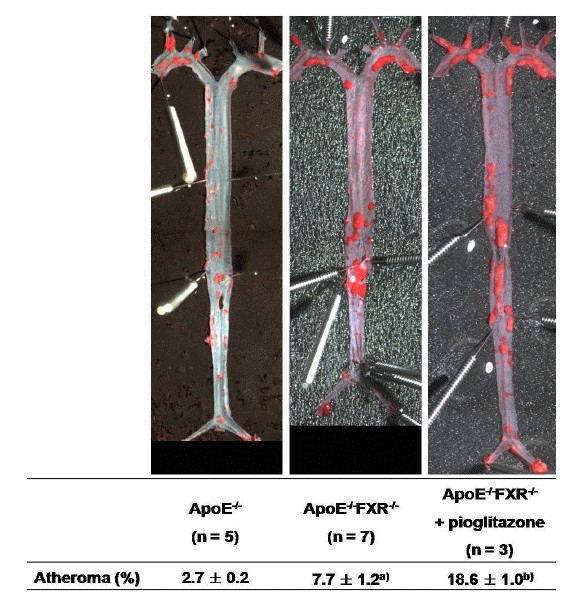
대동맥을 떼어내어 4% 포르말린액에 고정한 후, 대동맥을 심장부터 장골동맥까지 수직으로 절개하고 박리한 다음 핀을 이용하여 판에 고정하고, Oil red O 염색을 시행하여 광학 현미경(Carl Zeiss, 독일)으로 동맥경화반을 촬영하였다. 동맥경화반의 양은 전체 대동맥 면적 중에서 Oil red O가 염색된 면적의 비율을 퍼센트로 표시하였다. 이 결과는 ApoE-/-군 5마리, ApoE-/-FXR-/-군 7마리, ApoE-/-FXR-/- + pioglitazone군 3마리에서 동맥경화반 면적을 분석하였다.
통계 분석
측정값은 평균 ± 표준오차로 표시하였다. 군간의 비교는 Mann-Whitney U 검정을 이용하였다. 당부하 검사 결과는 반복측정 분산분석을 이용하여 분석하였다. SPSS version 15.0을 이용하였고 p 값이 0.05 미만인 경우를 통계적으로 유의하다고 판단하였다.
결 과
체중과 혈당 변화
12주간 고지방 고콜레스테롤 식이를 한 결과 ApoE-/-FXR-/- 군은 ApoE-/-군과 비교하여 다소 체중은 높고, 공복 혈당과 혈청 인슐린 농도가 낮은 경향을 보였으나, 통계적인 차이는 없었고(Table 1), 복강내 당부하 검사 결과에서도 차이가 없었다(Fig. 1). ApoE-/-FXR-/- + pioglitazone군은 ApoE-/-FXR-/- 군과 비교하여 공복 혈당과 당부하 후 혈당이 다소 낮은 경향이 관찰되었으나 통계적인 차이는 없었고, 체중과 인슐린 농도의 차이도 없었다(Table 1, Fig. 1).
혈청 지질 농도와 간효소치의 변화
혈액 분석 결과 ApoE-/-FXR-/-군은 ApoE-/-군에 비하여 모든 지질 농도가 유의하게 증가하였다(Table 2). LDL 콜레스테롤의 경우 482 ± 53 mg/dL에서 797 ± 26 mg/dL로 1.7배 상승하였다(p< 0.01). 또한, ApoE-/-FXR-/-군에서 ApoE-/-군과 비교할 때 간효소치의 증가가 관찰되었는데(Table 2), AST는 8.6배, ALT는 2.7배 상승하였다(p< 0.01).
ApoE-/-FXR-/- + pioglitazone군은 ApoE-/-군과 비교하여 혈청 지질 농도는 통계적으로 차이가 없었고, AST만 12배 유의하게 증가하였다. ApoE-/-FXR-/- + pioglitazone군과 ApoE-/- FXR-/-군을 비교할 때, pioglitazone의 투여는 HDL 콜레스테롤(55 ± 4 mg/dL vs. 28 ± 2 mg/dL, p< 0.01) 및 LDL 콜레스테롤(797 ± 26 mg/dL vs. 682 ± 47 mg/dL, p= 0.04)의 유의한 감소를 초래하여 총 콜레스테롤을 감소시켰다.
동맥경화반의 변화
고지방 고콜레스테롤 식이를 투여받은 ApoE-/-군에서는 동맥경화반의 비율이 2.7 ± 0.2%인 반면, ApoE-/-FXR-/-군에서는 7.7 ± 1.2%로 유의하게 증가하였다(p= 0.03) (Fig. 2). 또한, ApoE-/-FXR-/- 생쥐에 pioglitazone을 투여한 경우 동맥경화반의 비율은 18.6 ± 1.0%로서, ApoE-/-군 혹은 ApoE-/-FXR-/-군, 두 군 모두에 비교하여 유의하게 증가됨이 관찰되었다(p= 0.02) (Fig. 2).
고 찰
본 연구에서 ApoE-/-FXR-/- 생쥐에서 pioglitazone을 투여한 경우, 투여하지 않은 군보다 고지방 고콜레스테롤 식이에 의한 동맥경화반의 발생이 증가함을 관찰하였다.
당뇨병 환자에서 pioglitazone을 투여할 경우 심혈관 질환의 발생이 감소하고[16] 관상동맥이나 경동맥에서 동맥경화의 진행을 억제한다고 보고되었다[17,18]. 그런데 ApoE-/-FXR-/- 생쥐에서는 pioglitazone을 투여한 결과 동맥경화가 증가하였다. 이 결과를 설명할 수 있는 기전으로는 다음과 같은 것들을 생각해 볼 수 있다.
첫 번째로 HDL 콜레스테롤의 감소가 동맥경화를 악화시켰을 가능성이 있다. FXR 결핍 시 LDL 콜레스테롤이 증가됨이 잘 알려져 있고[7], 본 연구에서도 이와 마찬가지로 ApoE-/-FXR-/-군에서 LDL 콜레스테롤이 증가하였다. ApoE-/-FXR-/- + pioglitazone군에서 LDL 콜레스테롤이 감소하였으나 그 정도가 크지 않은 반면, HDL 콜레스테롤이 유의하게 낮아 FXR-/-군에서 보다 심한 동맥경화반이 발생했을 가능성이 있다. 그러나 본 연구에서 pioglitazone이 어떠한 기전으로 ApoE-/-FXR-/- 생쥐에서 HDL 콜레스테롤을 감소시키는지에 대한 기전을 밝히지는 못하였다.
이전의 동물 연구들에서 TZD의 투여는 동맥경화를 감소시키는 경우도 있었지만[10,11,19] 그렇지 못한 경우도 있었다[20,21]. 대식세포에는 PPARγ가 발현되어 있으므로 TZD의 투여는 대식세포의 기능을 변화시킬 수 있는데, 동맥경화반은 혈관벽의 대식세포에 산화된 LDL 콜레스테롤이 축적되는 것에서 시작되는 것으로 알려져 있다. 즉, 대식세포의 표면에 존재하는 CD36이 산화된 LDL 콜레스테롤을 인식하여 섭취하게 되고, 대식세포에 콜레스테롤이 축적되어 거품세포(foam cell)가 되는 것이 동맥경화의 발생에 중요하다. 그런데 PPAR-γ의 활성화는 대식세포에서 CD36의 활성화 등을 통해 산화된 LDL 콜레스테롤의 섭취를 증가시킴으로써 동맥경화에 나쁜 영향을 미칠 수 있지만[22,23], 동시에 ATP binding cassette transporter ABCA1 또는 caveolin-1의 발현을 증가시켜 대식세포에서 HDL로의 역 콜레스테롤 수송을 증가시켜 거품세포의 형성을 억제할 수도 있어[24-26], 이 두 기능의 균형이 어느 쪽으로 기우는가에 따라 PPAR-γ의 활성화가 동맥경화에 미치는 영향을 결정할 가능성이 있다. 한편, FXR의 활성화는 CD36의 발현은 감소시키고 ABCA1의 발현은 증가시킨다고 알려져 있다[6,27]. 따라서 FXR이 억제되면 CD36의 발현은 증가하나 ABCA의 발현은 감소하여, PPARγ가 활성화되었을 때 산화된 LDL 콜레스테롤의 섭취는 더욱 증가하나 역 콜레스테롤 수송은 증가하지 않아 이로 인해 동맥경화가 증가했을 가능성을 고려하여 볼 수 있다.
다른 가능성으로는 FXR을 결손 시킴으로써 PPARγ의 효과가 제대로 나타나지 않았을 가능성을 생각할 수 있다. FXR을 억제하면 PGC-1α가 억제될 수 있고[13] 그 결과 PPARγ가 제대로 작동하지 못하게 될 수 있다. 따라서 FXR을 억제시킨 상태에서는 pioglitazone을 사용하더라도 PPARγ에 의한 효과가 나타나지 않았을 가능성이 있다. Ob/ob 생쥐나 지방세포에서 FXR을 결손 시키면 rosiglitazone을 투여하여도 PPARγ가 활성화되지 않아 지방세포의 분화가 일어나지 않는다는 보고는 이러한 가설을 뒷받침하는 것이다[28].
본 연구의 한계점으로는 ApoE-/- 생쥐에 pioglitazone을 투여한 군이 없어서 FXR이 결핍되지 않은 상태에서의 pioglitazone의 효과를 직접 비교할 수 없었던 점을 들 수 있다. 그러나 기존의 연구에서 ApoE-/- 생쥐에서는 pioglitazone이 동맥경화반의 발생을 감소시킨다는 보고가 있어[29,30], 이와 비슷한 결과를 유추하여 볼 수 있겠다. 또한 ApoE-/-FXR-/- 이중 결손 생쥐의 번식능의 문제로 인하여 군당 마리 수가 적었던 것도 아쉬운 점 중 하나이다. 또한, 본 연구에서는 ApoE-/-FXR-/- 생쥐에서 pioglitazone의 투여가 동맥 경화를 악화시킨다는 현상만 관찰하였을 뿐 그 기전을 밝히지는 못하였다. 따라서 이에 대해서는 보다 깊이 있는 후속 연구가 필요하겠다.
결론적으로, 본 연구 결과 ApoE-/-FXR-/- 생쥐에서 pioglitazone의 투여는 오히려 동맥경화반의 발생을 증가시킴을 관찰하였으며, 이는 FXR이 억제된 상태에서 PPARγ의 활성화는 동맥경화에 나쁜 영향을 미칠 수 있음을 시사하는 것이다.