ņä£ ļĪĀ
ĻĖ░ļŖźņä▒ ņ£äņןĻ┤Ć ņ¦łĒÖśņØĆ ĻĖ░ņ¦łņĀüņØĖ ņøÉņØĖ ņŚåņØ┤ ļ│ĄĒåĄ ļō▒ņØś ņ”ØņāüņØś ņĢģĒÖöņÖĆ ĒśĖņĀäņØ┤ ļ░śļ│ĄļÉśļŖö ņ¦łĒÖśņ£╝ļĪ£ Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ņØ┤ ļīĆĒæ£ņĀüņØĖ ņśłņØ┤ļŗż. ņĢäņ¦üĻ╣īņ¦Ć ņøÉņØĖĻ│╝ ņ╣śļŻīļ▓ĢņØ┤ ļŗżņ¢æĒĢśĻ│Ā, ņ”ØņāüņØś ĒśĖņĀäņØä ņ£äĒĢ£ ļģĖļĀźņØĆ ĻŠĖņżĆĒ׳ Ļ│äņåŹļÉśņ¢┤ ņÖöļŗż. ņĄ£ĻĘ╝ ņ”ØņāüĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņŗØņØ┤ņÖĆ ņ”ØņāüĒśĖņĀäņØä ņ£äĒĢ£ ņØīņŗØņØś ņäĀĒāØņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØĆ ņĀÉņĀÉ ļŹö ņ”ØĻ░ĆĒĢśĻ│Ā[1], ņ”ØņāüņØś ņ£Āļ░£Ļ│╝ ĒśĖņĀäņŚÉ Ļ┤ĆĻ│äļÉ£ ļŗżņ¢æĒĢ£ ņØīņŗØņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ņ£╝ļéś Ļ░ü ļéśļØ╝ņØś ņŗØņØ┤ņŖĄĻ┤ĆņØ┤ ļŗżņ¢æĒĢśņŚ¼ ĻĄŁļé┤ņŚÉņä£ ņēĮĻ▓ī ņĀüņÜ®ĒĢśĻĖ░ņŚÉļŖö ņ¢┤ļĀżņÜ┤ ņŗżņĀĢņØ┤ļŗż.
Fermentable, Oligo-, Di-, Mono-saccharides and Polyols(FODMAPs)ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö 1991ļģä ĒśĖņŻ╝ ļ®£ļ▓äļźĖņØś Monash ļīĆĒĢÖņØś ņåīĒÖöĻĖ░ ļé┤Ļ│╝ņØśņé¼ Gibson ļ░Ģņé¼ņÖĆ ļŗ╣ņŗ£ Ļ░ÖņØĆ ļīĆĒĢÖņŚÉ ĻĘ╝ļ¼┤ĒĢśļŹś ņśüņ¢æĒĢÖņ×É Shepherd ļ░Ģņé¼ņŚÉ ņØśĒĢ┤ņä£ ņŚ░ĻĄ¼Ļ░Ć ņŗ£ņ×æļÉ£ ņØ┤ĒøäļĪ£ ņĀĆFODMAPņŗØņØ┤(low FODMAP diet)ņŚÉ ļīĆĒĢ£ ņ¦ĆņåŹņĀüņØĖ ņŚ░ĻĄ¼ ļŹĢļČäņŚÉ Ēśäņ×¼ļŖö FODMAPsņØś ņäŁņĘ©ņÖĆ Ļ┤ĆļĀ©ĒĢ£ ļ│æĒā£ņāØļ”¼ĻĖ░ņĀäņØ┤ ļ░ØĒśĆņ¦ĆĻ│Ā, ņØ┤ņżæļ¦╣Ļ▓Ć ļ¼┤ņ×æņ£ä ĻĄÉņ░©ņŗżĒŚśņØś ņŚ░ĻĄ¼ņä▒Ļ│╝ļź╝ ļ░£Ēæ£ĒĢśĻ│Ā, ĻŠĖņżĆĒ׳ ĒÖśņ×É-ņØśņé¼-ņŗØņØ┤ņĀäļ¼ĖĻ░Ć ļŗ©ņ▓┤ ĻĄÉņ£ĪņØś ņä▒Ļ│╝ļź╝ ļé┤Ļ│Ā ņ׳ļŗż[2].
ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ļŖö FODMAPsņØś ņĀĢņØś, ņĀäļ░śņĀü ĒŖ╣ņä▒, ļ│æĒā£ņāØļ”¼, ĻĄ¼ņä▒, ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼ņä▒Ļ│╝, ņןĻĖ░ņ▓śļ░®ņØś ļ¼ĖņĀ£ņĀÉņŚÉ ļīĆĒĢśņŚ¼ ņĢīņĢäļ│┤Ļ│Ā, ļéśņĢäĻ░Ć ņĀĆFODMAPņŗØņØ┤ņØś ĻĄŁļé┤ņĀüņÜ®ņØś Ļ░ĆļŖźņä▒Ļ│╝ ņĀ£ĒĢ£ņĀÉņŚÉ ļīĆĒĢśņŚ¼ ņé┤ĒÄ┤ļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ļ│Ė ļĪĀ
FODMAPs?
FODMAPsļŖö Fermentable, Oligo-, Di-, Mono-saccharides and PolyolsņØś ņ▓½ ĻĖĆņ×ÉņØś ņĢĮņ×ÉļĪ£, ņןļé┤ņŚÉņä£ ļ░£ĒÜ©ļÉśĻĖ░ ņē¼ņÜ┤ ņś¼ļ”¼Ļ│Āļŗ╣(oligosaccharides), ņØ┤ļŗ╣ļźś(disaccharides), ļŗ©ļŗ╣ļźś(monosaccharides), ĻĘĖļ”¼Ļ│Ā ĒÅ┤ļ”¼ņś¼(polyol)ņØä ļ£╗ĒĢśļŖö ņĢĮņ×ÉņØ┤ļŗż. ņ¢ĖĻĖēļÉ£ ņ¦¦ņØĆ ņé¼ņŖ¼ ĒāäņłśĒÖöļ¼╝ņØĆ ņé¼ļ×īņØś ņןļé┤ņŚÉņä£ļŖö ņēĮĻ▓ī ĒØĪņłśļÉśņ¦Ć ņĢŖņĢäņä£ ņé╝Ēł¼ņĢĢņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ņŚŁĒĢĀņØä ĒĢśņ¦Ćļ¦ī ņןļé┤ņäĖĻĘĀņŚÉ ņØśĒĢ┤ņä£ ņēĮĻ▓ī ļČäĒĢ┤ļÉśņ¢┤ Ļ░ĆņŖżļź╝ ļ░£ņāØņŗ£ĒéżļŖö ņä▒ņ¦łņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż.
ņś¼ļ”¼Ļ│Āļŗ╣ļźśļŖö ĒżļÅäļŗ╣(glucose), Ļ│╝ļŗ╣(fructose), Ļ░łļØĮĒåĀņŖż(galactose)ņÖĆ Ļ░ÖņØĆ ļŗ©ļŗ╣ņØ┤ 3-10Ļ░£ ņĀĢļÅä Ļ▓░ĒĢ®ĒĢ£ ņ¦¦ņØĆ ĒśĢĒā£ņØś ļŗ╣ņ£╝ļĪ£ ņäżĒāĢ ļŗ©ļ¦øņØś 20-40% ņĀĢļÅäļź╝ ļé┤ņ¦Ćļ¦ī, ņŗżņĀ£ļĪ£ ņåīņןņØś ņåīĒÖöĒÜ©ņåīņŚÉ ņØśĒĢ┤ņä£ ļČäĒĢ┤ļÉśņ¦Ć ņĢŖņ£╝ļ»ĆļĪ£ ņØĖņ▓┤ņŚÉņä£ Ļ▒░ņØś ĒØĪņłśļÉśņ¦Ć ņĢŖņĢä ļŗżņØ┤ņ¢┤ĒŖĖ ņŗØĒÆłņ£╝ļĪ£ļÅä ņ×ÉņŻ╝ ņØ┤ņÜ®ļÉ£ļŗż. ņś¼ļ”¼Ļ│Āļŗ╣ņŚÉļŖö ĒöäļŻ®Ēāä(fructan)Ļ│╝ Ļ░łļØĮĒāä(galactan)ņØ┤ ĒżĒĢ©ļÉśļ®░, ĒöäļŻ®ĒāäņØĆ ļŗżņłśņØś Ļ│╝ļŗ╣ņØ┤ ĒżĒĢ©ļÉśņ¢┤ ņ׳ņ¢┤ņä£ fructo-oligosaccharidesļØ╝Ļ│ĀļÅä ĒĢśĻ│Ā, Ļ░łļØĮĒāäņØĆ ļŗżņłśņØś Ļ░łļØĮĒåĀņŖżĻ░Ć ĒżĒĢ©ļÉśņ¢┤ galacto-oligosaccharidesļØ╝Ļ│ĀļÅä ĒĢśļŖö ņ¦¦ņØĆ ņé¼ņŖ¼ ĒāäņłśĒÖöļ¼╝ņØ┤ļŗż. ņØ┤ļōżņØĆ ļ¦ÄņØĆ ņóģļźśņØś ņŗØļ¼╝(Table 1), ņśłļź╝ ļōżļ®┤ ņ¢æĒīī, ņĮ®, Ēīī, ņĢäļ”¼ņ┤ł(artichoke), ņĢäņŖżĒīīļØ╝Ļ▒░ņŖż, ļ│æņĢäļ”¼ņĮ®, ļÅ╝ņ¦ĆĻ░Éņ×É ļō▒ņŚÉ ļŗżļ¤ē ĒżĒĢ©ļÉśņ¢┤ ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņ×ÉņŚ░ņŚÉ ĒżĒĢ©ļÉ£ ņś¼ļ”¼Ļ│Āļŗ╣ ņØ┤ņÖĖņŚÉļÅä ņĀäļČäņØä ņäĖĻĘĀ ļśÉļŖö ĒÜ©ņåīļĪ£ ļČäĒĢ┤ĒĢśņŚ¼ ņ¦¦ņØĆ ņé¼ņŖ¼ ĒāäņłśĒÖöļ¼╝ļĪ£ ļ¦īļōĀ ĒĢ®ņä▒ ņś¼ļ”¼Ļ│Āļŗ╣ņØĖ ļ¦ÉĒåĀļŹ▒ņŖżĒŖĖļ×Ć(maltodextrans)Ļ│╝ ņģĆļĪ£ļŹ▒ņŖżĒŖĖļ×Ć(cellodextrans)ņØ┤ ņ׳ļŗż[3].
ņØ┤ļŗ╣ļźśļŖö ļæÉ Ļ░£ņØś ļŗ©ļŗ╣ļźśĻ░Ć Ļ▓░ĒĢ®ļÉ£ ĒśĢĒā£ļĪ£ ņĪ┤ņ×¼ĒĢśļ®░, ļØĮĒåĀņśżņŖż(lactose), ļ¦ÉĒåĀņśżņŖż(maltose), ņŖłĒü¼ļĪ£ņŖż(sucrose) ļō▒ņØ┤ ĒĢ┤ļŗ╣ļÉ£ļŗż. ļØĮĒåĀņśżņŖż(ņĀ¢ļŗ╣)ļŖö ĒżļÅäļŗ╣Ļ│╝ Ļ░łļØĮĒåĀņŖż, ņŖłĒü¼ļĪ£ņŖż(ņäżĒāĢ)ļŖö ĒżļÅäļŗ╣Ļ│╝ Ļ│╝ļŗ╣, ļ¦ÉĒåĀņśżņŖż(ļ¦źņĢäļŗ╣)ļŖö ĒżļÅäļŗ╣Ļ│╝ ĒżļÅäļŗ╣ņØ┤ Ļ▓░ĒĢ®ĒĢśĻ│Ā ņ׳ļŗż. ņØ┤ļōżņØĆ Ļ░ĆņłśļČäĒĢ┤ņŚÉ ņØśĒĢ┤ņä£ ļŗ©ļŗ╣ļźśļĪ£ ļČäĒĢ┤ļÉĀ ņłś ņ׳ļŗż. ņŻ╝ļĪ£ ņÜ░ņ£Ā, ņÜöĻ▒░ĒŖĖ, ņĢäņØ┤ņŖżĒü¼ļ”╝, ņ╗żņŖżĒä░ļō£ Ēü¼ļ”╝, ņ╣śņ”ł ļō▒ņŚÉ ĒØöĒ׳ ņĪ┤ņ×¼ĒĢ£ļŗż[3].
ļŗ©ļŗ╣ļźśļŖö ĒāäņłśĒÖöļ¼╝ņØś Ļ░Ćņן ĻĖ░ļ│ĖņĀüņØĖ ļŗ©ņ£äļĪ£ ļŗ╣ļČäņØś Ļ░Ćņן ļŗ©ņł£ĒĢ£ ĒśĢĒā£ņØ┤ļŗż. ļīĆĒæ£ņĀüņ£╝ļĪ£ ĒżļÅäļŗ╣, Ļ│╝ļŗ╣, Ļ░łļØĮĒåĀņŖżĻ░Ć ņ׳ņ£╝ļ®░, ņŻ╝ļĪ£ Ļ│╝ļŗ╣ņØ┤ FODMAPsņŚÉ ĒĢ┤ļŗ╣ĒĢ£ļŗż. ņé¼Ļ│╝, ĒżļÅä, ņłśļ░Ģ, ņä£ņ¢æļ░░, Ļ░É, ņĮöņĮöņĢä, ņØĖņŖżĒä┤ĒŖĖ ņ╗żĒö╝, ņ¢æĒīī, ļ¦łļŖśĻ░ĆļŻ©, Ļ┐ĆņŚÉ ļ¦ÄņØ┤ ņĪ┤ņ×¼ĒĢ£ļŗż[3].
ĒÅ┤ļ”¼ņś¼ņØĆ ļŗżņłśņØś ņĢīņĮöņś¼ĻĖ░ļź╝ Ļ░Ćņ¦ĆļŖö ĒĢ®ņä▒ļŗ╣ņØ┤ļ®░, ņåīļź┤ļ╣äĒå©(sorbitol), ļ¦īļŗłĒå©(mannitol), ņ×ÉņØ╝ļ”¼Ēå©(xylitol), ļ¦ÉĒāĆĒå©(maltitol)ņØ┤ ĒżĒĢ©ļÉśļ®░, ņŻ╝ļĪ£ ņŗØĒÆłĻ░Éļ»ĖļŻīņŚÉ ļ¦ÄņØ┤ ĒżĒĢ©ļÉśņ¢┤ ļŗ©ļ¦øņØä ļéĖļŗż(Table 1). ļŗżņłśņØś Ēāäņé░ņØīļŻīņÖĆ Ļ│╝ņØ╝ņź¼ņŖż, ņé¼ĒāĢ, Ļ╗ī, ĒĢ®ņä▒ Ļ░Éļ»ĖļŻī ļō▒ņŚÉ ĒżĒĢ©ļÉśņ¢┤ ņ׳ļŗż[3].
FODMAPsņØś ļ│æĒā£ ņāØļ”¼
FODMAPsņØś ļ│æĒā£ ņāØļ”¼ļŖö ņ▓½ņ¦Ė, FODMAPsņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ņ¦¦ņØĆ ņé¼ņŖ¼ ĒāäņłśĒÖöļ¼╝ņØ┤ ņåīņןņŚÉņä£ Ļ▒░ņØś ĒØĪņłśļÉśņ¦Ć ņĢŖĻ▒░ļéś ļ¦żņÜ░ ņ▓£ņ▓£Ē׳ ĒØĪņłśļÉ£ļŗżļŖö ņĀÉņØ┤ļŗż. ņåīņןņŚÉņä£ ĒØĪņłśļÉśļŖö ņĀĢļÅäļŖö ņé¼ļ×īļ¦łļŗż ļŗżņ¢æĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ļ®░, ļØĮĒåĀņśżņŖż ļČäĒĢ┤ĒÜ©ņåīļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ļŖö ļČäĒĢ┤ļÉśņ¦Ć ņĢŖņØĆ lactoseĻ░Ć ļ¬©ļæÉ ļīĆņןņ£╝ļĪ£ ņØ┤ļÅÖĒĢ£ļŗż. PolyolņØś Ļ▓ĮņÜ░ļŖö Ļ░£ņØĖņĀüņØĖ ņ░©ņØ┤Ļ░Ć ņŗ¼ĒĢśĻ▓ī ļéśĒāĆļéśļŖö ļŗ╣ļźśņØ┤ļŗż[4,5].
ļæśņ¦Ė, FODMAPsņØĆ ņĀüņØĆ ņ¢æņØ┤ļ®┤ņä£ļÅä ņé╝Ēł¼ņĢĢņŚÉ ņØśĒĢ£ ņłśļČäļ¤ē ļ│ĆĒÖöļź╝ ņ£Āļ░£ĒĢśĻĖ░ņŚÉ ņČ®ļČäĒĢśļŗżļŖö Ļ▓āņØ┤ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņÜ░ļ”¼ ļ¬ĖņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ FODMAPsņØä ĒؼņäØņŗ£Ēé¼ ļ¬®ņĀüņ£╝ļĪ£, ņןĻ┤Ćļé┤ ņłśļČä ļČäļ╣äĻ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā ņןĻ┤Ć ļé┤ ņłśļČäĒØĪņłśĻ░Ć Ļ░ÉņåīļÉśņ¢┤ ņןĻ┤Ć ļé┤ ņłśļČäļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ņ£äņןĻ┤Ć ņÜ┤ļÅÖņØ┤ ļ╣©ļØ╝ņĀĖ ņäżņé¼ļź╝ ņ£Āļ░£ĒĢ£ļŗż. ļśÉĒĢ£, ļ╣Āļź┤Ļ▓ī ļ░£ĒÜ©ļÉśļŖö ĒāäņłśĒÖöļ¼╝ņØĆ ņןļé┤ņØś ņé╝Ēł¼ņĢĢņØä ļåÆņØĖļŗż. ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņŖłĒü¼ļĪ£ņŖż, ĒÅ┤ļ”¼ņś¼ ļō▒ņØ┤ ĒżĒĢ©ļÉ£ ņÜ®ņĢĪņØä ņäŁņĘ©ĒĢśļ®┤ ņןļé┤ ņłśļČäņØ┤ 2ļ░░ ņØ┤ņāü ņ”ØĻ░ĆĒĢśĻ│Ā ņØ┤ļĪ£ ņØĖĒĢśņŚ¼ ļČäļ│ĆņØś ļ¼┤Ļ▓īĻ░Ć ņ”ØĻ░ĆĒĢśņśĆļŗż[6]. ņĀĢņāüņØĖņŚÉņä£ļÅä 17.5 gņØś ļ¦īļŗłĒå© ņÜ®ņĢĪņØä ņäŁņĘ©ĒĢśņśĆņØä ļĢī Ļ░ÖņØĆ ņĀĢļÅäņØś ĒżļÅäļŗ╣ņØä ņäŁņĘ©ĒĢśņśĆņØä ļĢīļ│┤ļŗż 40ļČä ĒøäņŚÉ ņåīņןņØś ņłśļČäņØ┤ 10ļ░░ ņ”ØĻ░ĆĒĢśņśĆļŗż[7].
ņģŗņ¦Ė, FODMAPsņØĆ ļīĆņןņŚÉ ņé┤Ļ│Ā ņ׳ļŖö ņןļé┤ņäĖĻĘĀņŚÉĻ▓īļŖö ļ¦żņÜ░ ņØ┤ņÜ®ĒĢśĻĖ░ ņóŗņØĆ ļ¼╝ņ¦łļĪ£, FODMAPsņØś ņäŁņĘ©Ļ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ņØ┤ļź╝ ņØ┤ņÜ®ĒĢśļŖö ņןļé┤ņäĖĻĘĀņØś ļ░£ĒÜ©ņ×æņÜ®ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ Ļ░ĆņŖż(ņłśņåī, ļ®öĒāä, ņØ┤ņé░ĒÖöĒāäņåī)Ļ░Ć ļ░£ņāØĒĢśĻ▓ī ļÉ£ļŗż. ņØ┤ļĀćĻ▓ī ņ”ØĻ░ĆĒĢ£ Ļ░ĆņŖżļŖö ļ│ĄĒåĄ, ļ│ĄļČĆ ĒīĮļ¦īĻ░É, ļŹöļČĆļŻ®ņ”Ø(bloating)ņØä ņ£Āļ░£ĒĢ£ļŗż. ĒśĖĻĖ░ Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ņłśņåīņÖĆ ļ®öĒāäņØä ņĖĪņĀĢĒĢśņŚ¼ ļīĆņן ļé┤ ļ░£ĒÜ© Ļ░ĆņŖżļź╝ ņĖĪņĀĢĒĢĀ ņłś ņ׳ņ£╝ļ®░, ļ░£ĒÜ©Ļ░ĆļŖźĒĢ£ ĒāäņłśĒÖöļ¼╝ņØś Ēł¼ņŚ¼ Ēøä ņĢĮ 0-5ņŗ£Ļ░ä ņé¼ņØ┤ņŚÉ ņĀĢņāüņØĖĻ│╝ Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ņØ┤ ņ׳ļŖö ĒÖśņ×ÉĻĄ░ ļ¬©ļæÉņŚÉņä£ Ļ░ĆņŖżĒśĢņä▒ņØ┤ ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, ĻĄÉņ░©Ēł¼ņŚ¼ ņŗżĒŚśņŚÉņä£ļÅä ĻĖ░ņżĆņŗØņØ┤ļź╝ ĒĢśņśĆņØä ļĢīņŚÉ ļ╣äĒĢ┤ ļŗżņ¢æĒĢ£ ņ¦¦ņØĆ ņé¼ņŖ¼ ĒāäņłśĒÖöļ¼╝ņØä Ēł¼ņŚ¼ĒĢśņśĆņØä ļĢī ĻĖēĻ▓®Ē׳ ņłśņåīĻ░ĆņŖżĻ░Ć ņĀĢņāüņØĖĻ│╝ ĒÖśņ×ÉĻĄ░ ļ¬©ļæÉņŚÉņä£ ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, ĒöäļŻ®ĒāäņØś ņäŁņĘ© Ēøä ļŹö ļ¦ÄņØĆ ņ¢æņØś ņłśņåīĻ░Ć ļ░£ņāØĒĢśĻ│Ā, ņĪ░ĻĖ░ņŚÉ Ļ░ÉņåīĒĢśņśĆļŗż[8].
ļäĘņ¦Ė, ņś¼ļ”¼Ļ│Āļŗ╣ņØĆ ņåīĒÖöļÉśņ¢┤ ĒØĪņłśļÉśņ¦ĆļŖö ņĢŖņ¦Ćļ¦ī ņןļé┤ņäĖĻĘĀņØ┤ ņČ®ļČäĒ׳ ņØ┤ņÜ® Ļ░ĆļŖźĒĢ£ ņŚÉļäłņ¦ĆņøÉņØ┤ ļÉśņ¢┤ Ēöäļ”¼ļ░öņØ┤ņśżĒŗ▒ņŖż(prebiotics)ļĪ£ ņ×æņÜ®ĒĢĀ ņłś ņ׳ļŗż. ņŗżņĀ£ļĪ£ 3ņŻ╝ ļÅÖņĢł FODMAPsņØś ņäŁņĘ©ļź╝ ņżäņØĖ Ļ▓ĮņÜ░, ņĀäņ▓┤ņĀüņØĖ ņןļé┤ņäĖĻĘĀņØś ņ¢æņØĆ Ļ░ÉņåīĒĢśņśĆņ¦Ćļ¦ī ņןļé┤ņŚÉ ņ£ĀņØĄĒĢ£ ļČĆĒŗĖļĀłņØ┤ĒŖĖ(butylate)ļź╝ ņāØņé░ĒĢśļŖö Clostridium cluster XIVaņÖĆ ņĀÉļ¦ēņŚÉ ņ£ĀņÜ®ĒĢ£ Akkermansia muciniphilaļŖö ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, ņĀÉļ¦ēņŚÉ ņóŗņ¦Ć ļ¬╗ĒĢ£ Ruminococcus torquesļŖö Ļ░ÉņåīĒĢśņśĆļŗż[4].
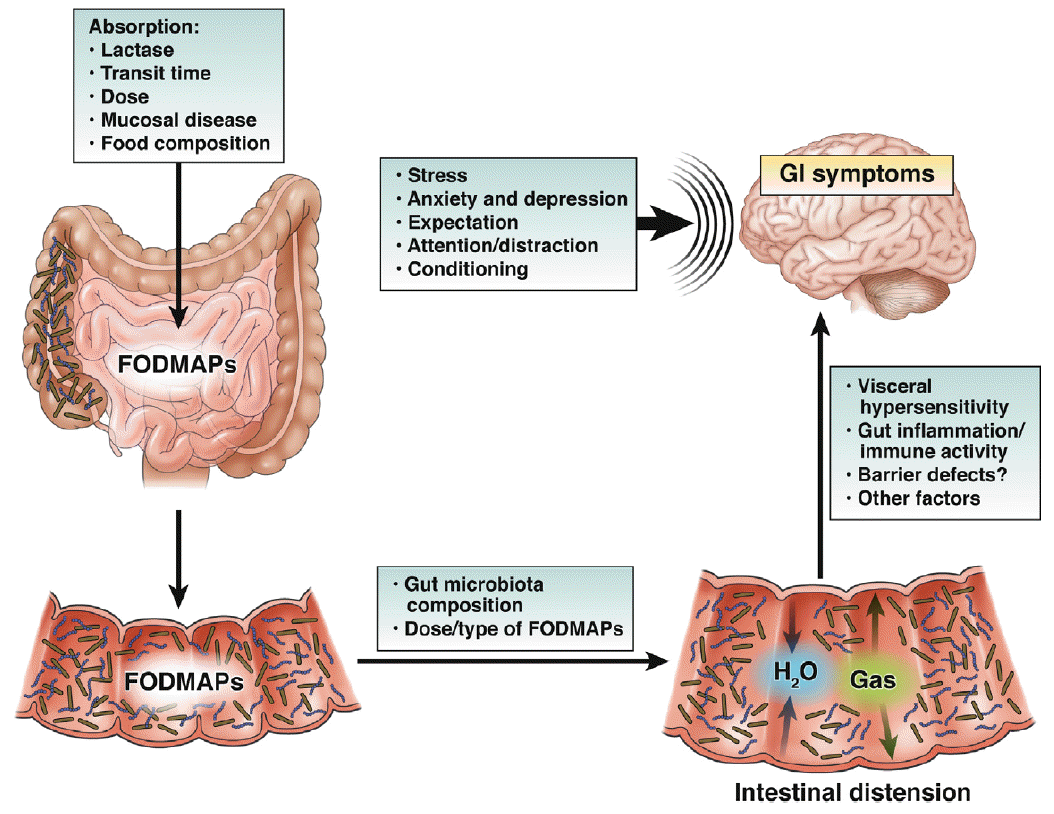
ņĀĢņāüņØĖņØś Ļ▓ĮņÜ░, FODMAPsņŚÉ ņØśĒĢ┤ņä£ ļ░£ņāØĒĢ£ ņןļé┤ ņłśļČäņ”ØĻ░ĆņÖĆ Ļ░ĆņŖż ļ░£ņāØņ£╝ļĪ£ ņØĖĒĢ£ ņ”ØņāüņØĆ Ļ▒░ņØś ļ░£ņāØĒĢśņ¦Ć ņĢŖļŖö ļ░śļ®┤, ĻĖ░ļŖźņä▒ ņ£äņןĻ┤Ć ņ¦łĒÖś ĒŖ╣Ē׳ Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ļŖö ļé┤ņן Ļ│╝ļ»╝ņä▒(visceral hypersensitivity)ņØ┤ļéś ļćī-ņןņČĢ(brain-gut axis)ņŚÉ ļ¼ĖņĀ£Ļ░Ć ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ĒØöĒĢśļ»ĆļĪ£, ņØ┤ļĀćĻ▓ī ļ░£ņāØĒĢ£ Ļ░ĆņŖżņÖĆ ņłśļČäņŚÉ ņØśĒĢ┤ ņČ®ļČäĒ׳ ņ”ØņāüņØ┤ ņ£Āļ░£ļÉ£ļŗż(Fig. 1) [2,5,9-17]. ļśÉĒĢ£ ņןĻĖ░Ļ░ä FODMAPs ņäŁņĘ©ļź╝ ņĀ£ĒĢ£ĒĢ£ Ļ▓ĮņÜ░, ņ”ØņāüņØ┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ ļŗżņ¢æĒĢ£ ņØ┤ļĪ£ņÜ┤ ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłļŗż[4].
ņĀĆFODMAPņŗØņØ┤ņØś ĻĄ¼ņä▒
ņŗżņĀ£ ņ×äņāüņŚÉņä£ ņŗØļŗ©Ēæ£ņÖĆ ņŗØņØ┤ļź╝ Ļ▓░ņĀĢĒĢśĻĖ░ ņ£äĒĢ┤ ļŗ©ņł£Ē׳ Ēö╝ĒĢ┤ņĢ╝ ĒĢĀ ņØīņŗØņØ┤ļéś ĻČīĒĢ┤ņĢ╝ ĒĢĀ ņØīņŗØņ£╝ļĪ£ ĻĄ¼ļČäĒĢśņŚ¼ ĻĄÉņ£ĪĒĢśļŖö Ļ▓āņØĆ ļČĆņĀüņĀłĒĢśļ®░, ņŗØņØ┤ ņĀäļ¼ĖĻ░ĆņØś ļÅäņøĆņØä ļ░øļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż. ņŗØņØ┤ņØś ĻĄ¼ņä▒ ņżæ ĒÅēņåī ņŗØņé¼ļ¤ēņØä ņ£Āņ¦ĆĒĢśļŖö Ļ▓āņØĆ ņżæņÜöĒĢśļ®░, ņŗØņé¼ļ¤ēņØś Ļ░ÉņåīļŖö ņśżĒ׳ļĀż ņŗØņØ┤ ņĪ░ņĀłņØ┤ ĒĢäņÜöĒĢ£ ļīĆņāüĒÖśņ×ÉņØś ņØśņ¦Ćļź╝ Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ļŗż. ļśÉĒĢ£ ņןĻĖ░Ļ░ä ņĀĆFODMAPņŗØņØ┤ļź╝ ņ£äĒĢ┤ņä£ļŖö ņČ®ļČäĒĢ£ ņ╣╝ļĪ£ļ”¼ļź╝ ņĀ£Ļ│ĄĒĢ┤ņĢ╝ ĒĢśĻ│Ā ĻĘĀĒśĢ ņ×ĪĒ×ī ņŗØļŗ©ņØ┤ ĒĢäņÜöĒĢśļŗż. ņŗØļŗ©ņŚÉļŖö ļŗżņä» Ļ░Ćņ¦Ć ņŗØĒÆłĻĄ░(ņ£ĀņĀ£ĒÆł, ņ£ĪļźśĻ│╝ ņ£ĪĻ░ĆĻ│ĄĒÆł, Ļ│╝ņØ╝, ņ▒äņåī, Ļ│Īļ¼╝)ņØ┤ ļ¬©ļæÉ ņČ®ļČäĒ׳ ņĀ£Ļ│ĄļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż. ĻĖ░ļ│ĖņĀüņØĖ Ļ░£ļģÉņØĆ ņŗØņé¼ļ¤ēĻ│╝ ņŚ┤ļ¤ēņØä ĻĘĖļīĆļĪ£ ņ£Āņ¦ĆĒĢśļ®┤ņä£ FODMAPsņØ┤ ļ¦ÄņØ┤ ĒżĒĢ©ļÉ£ ņŗØņ×¼ļŻīļź╝ FODMAPsņØ┤ ņĀüĻ▓ī ĒżĒĢ©ļÉ£ Ļ▓āņ£╝ļĪ£ ļīĆņ▓śĒĢ£ļŗżļŖö Ļ▓āņØ┤ļŗż[18,19].
ņä▒Ļ│ĄņĀüņØĖ ņ╣śļŻīļź╝ ņ£äĒĢ┤ņä£ļŖö ļīĆņāüĒÖśņ×ÉņŚÉĻ▓ī ĻĖ░ļŖźņä▒ ņ¦łĒÖśņŚÉ ļīĆĒĢ£ Ļ░£ļģÉĻ│╝ ņŗØņØ┤ņØś ņżæņÜöņä▒ņØä ņØĖņŗØņŗ£ĒéżĻ│Ā, ņĀĆFODMAPņŗØņØ┤ņØś Ļ░£ļģÉĻ│╝ ņŗØņØ┤ ļ░®ļ▓Ģ, ņŗØļŗ©ņØś Ļ▓░ņĀĢ, ņÜöļ”¼ļ░®ļ▓ĢņØś ņäĀņĀĢ ļō▒ņØä ņל ņØ┤ĒĢ┤ĒĢĀ ņłś ņ׳ļÅäļĪØ ņ¦ĆņåŹņĀüņØĖ ĻĄÉņ£ĪņØ┤ ĒĢäņłśņĀüņØ┤ļŗż. ņØ┤ļź╝ ņ£äĒĢ┤ņä£ļŖö ĒÖśņ×É-ņØśņé¼-ņŗØņØ┤ņĀäļ¼ĖĻ░ĆņØś ņāüĒśĖņ×æņÜ®ņØ┤ ņżæņÜöĒĢśļ®░, ĒÖśņ×ÉņØś ĻĄÉņ£ĪņŚÉļŖö Ļ░£ņØĖļ│ä ņ╣śļŻīļÅä ĒÜ©Ļ│╝Ļ░Ć ņ׳ņ¦Ćļ¦ī ņØśņé¼-ņŗØņØ┤ņĀäļ¼ĖĻ░Ć-ĒÖśņ×Éņ¦æļŗ©Ļ│╝ Ļ░ÖņØĆ ĻĘĖļŻ╣ĻĄÉņ£ĪļÅä Ļ░£ņØĖļ│ä ņ╣śļŻīļ¦īĒü╝ņØ┤ļéś ĒÜ©Ļ│╝ ņ׳ļŗż[20]. ņ¦ĆņåŹņĀüņØĖ ņ”ØņāüĒśĖņĀäņØä ņ£äĒĢ┤ņä£ļŖö ĒÖśņ×ÉņŚÉĻ▓ī ņŗØņØ┤ņĀäļ¼ĖĻ░ĆĻ░Ć ņ×æņä▒ĒĢ£ ņ▓śļ░®ņŗØņØ┤ ņŗØļŗ©ņ£╝ļĪ£ 2-6ņŻ╝Ļ░ä ņŗ£Ē¢ēĒĢśĻ│Ā, ĒÖśņ×Éļź╝ ņ×¼ĻĄÉņ£Ī Ēøä ĒÖśņ×ÉļĪ£ ĒĢśņŚ¼ĻĖł ņŗØļŗ©ņØä ņ×æņä▒ĒĢśļÅäļĪØ ĒĢśĻ│Ā ņŗØļŗ©ņØś ļ¼ĖņĀ£ņĀÉņØä Ēö╝ļō£ļ░▒ĒĢ┤ ņŻ╝ņ¢┤ņĢ╝ ĒĢśļ®░, ĒÖśņ×ÉĻ░Ć ņĀĆFODMAPsņŗØņØ┤ņŚÉ ļīĆĒĢśņŚ¼ ņÖäņĀäĒ׳ ņØ┤ĒĢ┤ĒĢśĻ│Ā ņØ╝ņāüņāØĒÖ£ņŚÉ ņל ņĀüņØæĒĢĀ ņłś ņ׳ņØä ļĢīĻ╣īņ¦Ć ĻĘ╝ņĀæ ļ¬©ļŗłĒä░ļ¦üņØä ĒĢ┤ņŻ╝ļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż. ņŗØņØ┤ ņĀäļ¼ĖĻ░ĆņØś ņŚŁĒĢĀņØĆ ņäŁņĘ©ĒĢ┤ņĢ╝ ĒĢĀ ņŗØĒÆłĻ│╝ ĒÜīĒö╝ĒĢ┤ņĢ╝ ĒĢĀ ņŗØĒÆłņŚÉ ļīĆĒĢ£ ĻĄÉņ£Īļ┐Éļ¦ī ņĢäļŗłļØ╝ ņŗØļŗ©ņ£╝ļĪ£ ņĀĢĒĢ£ ņØīņŗØņŚÉņä£ FODMAPsņØä ņĀ£Ļ▒░ĒĢśĻ│Ā ņóĆ ļŹö ļ¦øņ׳Ļ▓ī ļ¦īļō£ļŖö ļ░®ļ▓ĢņØä Ļ░Ćļź┤ņ╣śĻ│Ā, ļéśņĢäĻ░Ćņä£ļŖö ĒÖśņ×ÉĻ░Ć ņŗØĒÆłĻĄ¼ņä▒Ēæ£ļź╝ ļ│┤Ļ│Ā ņāłļĪ£ņÜ┤ ņŗØļŗ©ņØä Ļ░£ļ░£ĒĢĀ ņłś ņ׳ļŖö ņĀĢļÅäĻ╣īņ¦Ć ļ░£ņĀäņŗ£ņ╝£ ņä▒Ļ│ĄņĀüņØĖ ņ╣śļŻīļź╝ ļ│┤ņןĒĢĀ ņłś ņ׳ļÅäļĪØ ļÅäņøĆņØä ņŻ╝ļŖö Ļ▓āņØ┤ļŗż.
ņŗØļŗ©ņØś Ļ▓░ņĀĢņØ┤ļéś ņØīļŻīņłśņØś ņäĀĒāØņŚÉ ņ׳ņ¢┤ņä£ ņØīņŗØņŚÉ ĒżĒĢ©ļÉ£ FODMAPsņØś ņĀĢļÅäņŚÉ ļīĆĒĢ£ ņ¦ĆņŗØņØĆ ļ¦żņÜ░ ņżæņÜöĒĢśļŗż. ņØĖĒä░ļäĘĻ│╝ ņ▒ģņ×Éļź╝ ĒåĄĒĢ┤ ņĀ£Ļ│ĄļÉ£ ņ×ÉļŻīļŖö ļČłņÖäņĀäĒĢśĻ│Ā ņĀĢĒÖĢĒĢśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ļÅä ņ׳ņ£╝ļ®░, ņØ╝ņāüņāØĒÖ£ņŚÉņä£ Ļ░äĒÄĖĒĢśĻ▓ī ĒÖĢņØĖĒĢĀ ņłś ņŚåļŗż. FODMAPsņŚÉ ļīĆĒĢ£ Ļ░Ćņן ĒÖ£ļ░£ĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŖö ĒśĖņŻ╝ņØś Monash ļīĆĒĢÖņŚÉņä£ļŖö ņŖżļ¦łĒŖĖĒÅ░ņÜ® ņ¢┤Ēöīļ”¼ņ╝ĆņØ┤ņģś[21]Ļ│╝ ņ▒ģņ×É[22]ļź╝ ĒåĄĒĢśņŚ¼ ņĀĢļ│┤ļź╝ ņĀ£Ļ│ĄĒĢśĻ│Ā ņ׳ņ¢┤ ņēĮĻ▓ī ĒÖĢņØĖņØ┤ Ļ░ĆļŖźĒĢśĻ│Ā ņ£ĀņÜ®ĒĢśĻ▓ī ņØ┤ņÜ®ĒĢĀ ņłś ņ׳ļŗż(Fig. 2).
ņĀĆFODMAPņŗØņØ┤ņØś ņ×äņāüņĀü ņ£ĀņÜ®ņä▒
ņ¦Ćļé£ 10ļģäĻ░äņØś ņŚ░ĻĄ¼ļź╝ ņé┤ĒÄ┤ļ│┤ļ®┤, ņŻ╝ļÉ£ ļīĆņāüņØĆ Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ņØ┤ļ®░, ņŗØņØ┤ņĀäļ¼ĖĻ░ĆņØś ļÅäņøĆņØä ļ░øņĢä Ēæ£ņżĆĒÖöļÉ£ ņŗØļŗ©ņØä ņ×æņä▒ĒĢśĻ│Ā ļīĆņĪ░ĻĄ░Ļ│╝ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ņ”ØņāüņØś ļ│ĆĒÖöļź╝ ĒÖĢņØĖĒĢśļŖö ņŚ░ĻĄ¼ņŚÉņä£ ņŗ£ņ×æĒĢśņŚ¼, ņĀÉņ░©ļĪ£ ļ¼┤ņ×æņ£ä ņØ┤ņżæļ¦╣Ļ▓Ć ĻĄÉņ░©ņŗżĒŚśņ£╝ļĪ£ ļ░£ņĀäĒĢśņśĆļŗż(Table 2). ņ¦ĆņŚŁļÅä ĒśĖņŻ╝ņŚÉņä£ ņŗ£ņ×æĒĢśņŚ¼ ļē┤ņ¦łļ×£ļō£, ļČüļ»ĖļĪ£ ņĀäĒīīļÉ£ ņØ┤Ēøä ņä£ņ£Āļ¤ĮĻ│╝ ļČüņ£Āļ¤ĮņØś ņŚ¼ļ¤¼ ļéśļØ╝ņŚÉņä£ļÅä ņ░ĖņŚ¼ĒĢśĻ│Ā ņ׳ļŗż. ņĄ£ĻĘ╝ņŚÉļŖö ļÅÖņĢäņŗ£ņĢäņ¦ĆņŚŁņŚÉņä£ļÅä ņŚ░ĻĄ¼Ļ░Ć ņŗ£ņ×æļÉśĻ│Ā ņ׳Ļ│Ā, ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ļÅä ļ¦ÄņØĆ Ļ┤Ćņŗ¼ņØä Ļ░Ćņ¦ĆĻ│Ā ņŚ░ĻĄ¼ļź╝ ņżĆļ╣äĒĢśĻ│Ā ņ׳ļŗż.
Ēæ£ņżĆĒÖö ņŚ░ĻĄ¼[17]ņŚÉņä£ ņĀĢņāüņØĖĻ│╝ Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ 21ņØ╝ ļÅÖņĢł ņĀĆFODMAPņŗØņØ┤/ņĀäĒśĢņĀüņØĖ ņśżņŖżĒŖĖļĀłņØ╝ļ”¼ņĢäņŗØ ņØīņŗØņØä ņĀ£Ļ│Ą Ēøä ĻĄÉņ░©ņŗżĒŚśņØä ņŗ£Ē¢ēĒĢśņŚ¼ Ļ░üĻ░üņØś ņŗØņØ┤ņŚÉ ļö░ļźĖ ņ”ØņāüņØś ļ│ĆĒÖöļź╝ ļ╣äĻĄÉĒĢśņśĆņ£╝ļ®░, ņĀĢņāüņØĖņŚÉņä£ļŖö ņ¢┤ļ¢ĀĒĢ£ ņóģļźśņØś ņŗØņé¼ņŚÉļÅä ņ”Øņāü ļ│ĆĒÖöĻ░Ć ņŚåņŚłņ£╝ļéś, Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ ĒÖśņ×ÉņŚÉņä£ļŖö ņĀĆFODMAPņŗØņØ┤ Ēøä ņ”ØņāüņØ┤ ĒÖĢņŚ░Ē׳ ĒśĖņĀäļÉ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż(Fig. 3).
ņóģĒĢ®ĒĢśļ®┤, ņĀĆFODMAPņŗØņØ┤ņÖĆ ņŚ░Ļ┤ĆļÉ£ ļīĆļČĆļČäņØś ņŚ░ĻĄ¼ļōżņŚÉņä£ 70% ņØ┤ņāüņØś Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ ĒÖśņ×ÉĻ░Ć ņŗØņØ┤ņØś ļ│ĆĒÖöļĪ£ ņ”ØņāüņØś ĒśĖņĀäņØä Ļ▓ĮĒŚśĒĢśņśĆļŗż(Table 2). ņĀäļ░śņĀüņØĖ ņ”ØņāüņØś ĒśĖņĀäņØĆ ņĀĆFODMAPņŗØņØ┤ļź╝ ņŗ£ņ×æĒĢśĻ│Ā 7ņØ╝ ņØ┤ļé┤ņŚÉ ņŗ£ņ×æļÉśņŚłĻ│Ā, ĒśĖņĀäļÉ£ ņ”ØņāüņØĆ ņĀĆFODMAPņŗØņØ┤ļź╝ ņ¦ĆņåŹĒĢśļŖö ļÅÖņĢł ņל ņ£Āņ¦ĆļÉśņŚłņ£╝ļ®░, ņØ╝ļČĆņŚÉņä£ļŖö ņŚ░ĻĄ¼ĻĖ░Ļ░ä ņØ┤ĒøäņŚÉļÅä ņāüļŗ╣ ĻĖ░Ļ░ä ļÅÖņĢł ņ¦ĆņåŹļÉśņŚłļŗż[12-17]. ņ”Øņāü ĒśĖņĀäņØś ņØ┤ņ£ĀļŖö ņĢ×ņä£ ļ│æĒā£ņāØļ”¼ņŚÉņä£ ņäżļ¬ģļÉ£ ļé┤ņÜ®Ļ│╝ ļÅÖņØ╝ĒĢśļŗż. ņŚ░ĻĄ¼ ĻĖ░Ļ░ä ļÅÖņĢł ņżæļīĆĒĢ£ ļČĆņ×æņÜ®ņØĆ ļ░£ņāØĒĢśņ¦Ć ņĢŖņĢśļŗż.
ņØ┤ņÖĆ Ļ░ÖņØĆ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£ ņĀĆFODMAPņŗØņØ┤ļź╝ Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ ĒÖśņ×ÉņØś ņØ╝ņ░©ņ╣śļŻīļĪ£ ņĀüņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗżĻ│Ā ņŻ╝ņןĒĢśļŖö ĒĢÖņ×ÉļōżņØ┤ ļŖśņ¢┤ļéśĻ│Ā ņ׳ļŗż. ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśņŚłņ¦Ćļ¦ī ņĢäņ¦üĻ╣īņ¦Ć ņĀĢĒÖĢĒĢ£ ļ╣äĻĄÉņŚ░ĻĄ¼Ļ░Ć ļČĆņĪ▒ĒĢśĻ│Ā, ņŚ░ĻĄ¼ņØś ļīĆļČĆļČäņØ┤ ņ×äņāüņĀü ņĀæĻĘ╝ņØ┤ ņĢäļŗī ņāłļĪ£ņÜ┤ ņŗØņØ┤ļź╝ ņŗ£ļÅäĒĢśļŖö ņŚ░ĻĄ¼ņØ┤ļ»ĆļĪ£ ņŗżņĀ£ņ×äņāü ņĀüņÜ®Ļ│╝ļŖö ņ░©ņØ┤Ļ░Ć ņ׳ņØä ņłś ņ׳Ļ│Ā, ņןĻĖ░Ļ░ä ņŚ░ĻĄ¼ ņ×ÉļŻīĻ░Ć ļČĆņĪ▒ĒĢśĻ│Ā, ņåīņĢä ļśÉļŖö ņŚ╝ņ”Øņä▒ņןņ¦łĒÖś ļō▒ņØś ļŗżļźĖ ņ¦łĒÖśņŚÉļÅä ņĀüņÜ® Ļ░ĆļŖźĒĢ£ņ¦Ć ļō▒ņØś ļ¼ĖņĀ£ņĀÉņØ┤ ņ׳ļŗż.
ĒĢ£ĻĄŁņŚÉņä£ņØś ņĀĆFODMAPņŗØņØ┤
ĒĢ£ĻĄŁņŚÉņä£ņØś FODMAPsņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņĢäņ¦ü ĒÖ£ļ░£ĒĢśņ¦Ć ņĢŖļŗż. ĻĘĖ ņØ┤ņ£ĀļĪ£ļŖö ņ▓½ņ¦Ė, ņĢäņ¦ü ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ļŖö ņŗØĒÆł, ņŗØņ×Éņ×¼ņŚÉ ĒżĒĢ©ļÉśņ¢┤ ņ׳ļŖö FODMAPsņØś ņä▒ļČäĒæ£ņŗ£Ļ░Ć ņØśļ¼┤ĒÖöļÉśņ¢┤ ņ׳ņ¦Ć ņĢŖņĢä FODMAPsņØś ĒżĒĢ© ņĀĢļÅäļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ¢┤ļĀĄļŗż. ņÖĖĻĄŁ ņŚ░ĻĄ¼ņŚÉņä£ ļÅäņøĆņØä ļ░øņØä ņłś ņ׳ņ£╝ļéś Ļ░ü ļéśļØ╝ļ│ä ņäĀĒśĖĒĢśļŖö ņŗØĒÆłņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳Ļ│Ā, Ļ░ÖņØĆ ņŗØĒÆłņŚÉņä£ļÅä ļéśļØ╝ļ¦łļŗż ĒĢ©ņ£Āļ¤ēņØ┤ ļŗ¼ļØ╝ ņÖĖĻĄŁņØś ņ×ÉļŻīļź╝ ņØĖņÜ®ĒĢśļŖö ļŹ░ņŚÉļŖö ņĀ£ĒĢ£ņĀÉņØ┤ ņ׳ļŗż. ļæśņ¦Ė, ņ¦łĒÖśņŚÉ ļīĆĒĢ£ ņØĖņŗØņØś ņ░©ņØ┤Ļ░Ć ņ׳ļŗż. ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ņØś ņĀäĒåĄņĀüņØĖ Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ņØś ņ╣śļŻīļŖö ĒÖśņ×ÉņØś ņ”Øņāü ĒśĖņĀäĻ│╝ ņéČņØś ņ¦ł Ē¢źņāüņŚÉ ņ┤łņĀÉņØ┤ ļ¦×ņČöņ¢┤ņĀĖ ņ׳Ļ│Ā, ņĢĮņĀ£ņØś ņ▓śļ░®ņØ┤ ņŻ╝ļÉ£ ņŚŁĒĢĀļĪ£ ņØĖņŗØļÉśņ¢┤ ņ׳ļŗż. ņŗØņØ┤/ņØīņŗØņØĆ ņØśņé¼ņØś ņśüņŚŁĻ│╝ ņ░©ņØ┤Ļ░Ć ņ׳ļŗżĻ│Ā ņāØĻ░üĒĢśļŖö Ļ▓ĮĒ¢źņØ┤ ņ׳ņ¢┤, ņØ┤ņŚÉ ļīĆĒĢ£ ņØĖņŗØņØś ļ│ĆĒÖöĻ░Ć ņŗ£ĻĖēĒĢśļŗż. ņģŗņ¦Ė, ļŗżĒĢÖņĀ£ ņ╣śļŻīņŚÉ ļīĆĒĢ£ Ļ▓ĮĒŚśņØś ļČĆņĪ▒Ļ│╝ ņ¦ĆņøÉņ▓┤Ļ│äņØś ļČĆņ×¼Ļ░Ć ļ¼ĖņĀ£Ļ░Ć ļÉĀ ņłś ņ׳ļŗż. ņĀĆFODMAPņŗØņØ┤ļŖö ĒÖśņ×É-ņŗØņØ┤ņĀäļ¼ĖĻ░Ć-ņØśņé¼Ļ░Ć ļŗżĒĢÖņĀ£ņĀü ņĀæĻĘ╝ņØ┤ ĒĢäņÜöĒĢ£ ļČĆļČäņØ┤ņ¦Ćļ¦ī ņØ┤ņŚÉ ļīĆĒĢ£ Ļ▓ĮĒŚśĻ│╝ ņ¦ĆņøÉņØ┤ ļČĆņĪ▒ĒĢśļŗż. ĒĢśņ¦Ćļ¦ī ļ¦ÄņØĆ ņØśņé¼ļōżņØ┤ ņĀÉņ░© ņØ┤ņŚÉ ļīĆĒĢ£ ĒĢäņÜöņä▒Ļ│╝ ņżæņÜöņä▒ņØä ņØĖņŗØĒĢśĻ│Ā ņ׳Ļ│Ā, ĒĢÖĒÜīņÖĆ ņŗ¼Ēżņ¦ĆņŚäņØä ĒåĄĒĢ┤ ņżæņÜöņä▒ņØä Ļ░ĢņĪ░ĒĢśĻ│Ā ņ׳ļŗż.
ņä£ņ¢æņŚÉņä£ļŖö ņĀĆFODMAPņŗØņØ┤ņØś ņĪ░ļ”¼ļ▓ĢĻ│╝ ņŗØļŗ©ņØ┤ ņØ┤ļ»Ė ņל ņĀĢļ”¼ļÉśņ¢┤ ņ׳ņ¦Ćļ¦ī, ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ļŖö ņĢäņ¦ü ļ¦łļĀ©ļÉśņ¦Ć ņĢŖņĢśļŗż. ĒĢ£ĻĄŁ ļ©╣Ļ▒░ļ”¼ņØś ņżæņÜöĒĢ£ ļČĆļČäņØĖ Ļ╣Ćņ╣śņØś Ļ▓ĮņÜ░, ņ×¼ļŻīņØĖ ļ░░ņČö ņØ┤ņÖĖņŚÉ ļČĆņ×¼ļŻīļĪ£ ļČäļźśļÉśļŖö ļ¦łļŖś, ļ¼┤, Ēīī, Ļ│ĀņČö, ņ▓©Ļ░ĆņĀ£ ļō▒ņØ┤ ļ¬©ļæÉ FODMAPsņØś ĒĢ©ļ¤ēņØ┤ ļåÆļŗż. ļśÉĒĢ£ Ļ╣Ćņ╣ś ņØ┤ņÖĖņŚÉ ļÉ£ņן, Ļ│ĀņČöņן, ņīłņן ļō▒ļÅä ņĮ®ņØś ĒĢ©ļ¤ēņØ┤ ļåÆņĢä ļ¬©ļæÉ FODMAPsņØś ĒĢ©ļ¤ēņØ┤ ļåÆņØĆ ņØīņŗØņ£╝ļĪ£ ļČäļźśļÉ£ļŗż. ļ¦īļæÉļéś ļöżņä¼ņØś Ļ▓ĮņÜ░ļÅä ļ¦īļæÉņåīņŚÉ ļōżņ¢┤ ņ׳ļŖö ņ¢æĒīī, Ēīī, ņ¢æļ░░ņČö, ļ¦łļŖś ļō▒ņŚÉ FODMAPsņØś ĒĢ©ļ¤ēņØ┤ ļåÆļŗż. ņ╣┤ļĀłņØś Ļ▓ĮņÜ░ņŚÉļÅä ņ¢æĒīī, ļ¦łļŖś, ļ▓äņä», ņ¢æļ░░ņČö ļō▒ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ FODMAPsņØ┤ ļåÆņØĆ ņØīņŗØņ£╝ļĪ£ ļČäļźśļÉ£ļŗż. ņżæĻĄŁ ņØīņŗØņŚÉņä£ļÅä ņé¼ņÜ®ĒĢśļŖö ļ▓äņä», ņ¢æļ░░ņČö, ļ¦łļŖś, ņĮ®ņ£╝ļĪ£ ļ¦īļōĀ ņČśņן, Ļ┐Ć, Ļ░üņóģ ņåīņŖż ļō▒ņŚÉ FODMAPsņØś ĒĢ©ļ¤ēņØ┤ ļåÆņ£╝ļéś, ņīĆĻĄŁņłś, ļ®┤ņÜöļ”¼, ņżæĻĄŁļ╣Ą ļō▒ņŚÉļŖö FODMAPsņØś ĒĢ©ļ¤ēņØ┤ ļé«ļŗż. ņØ┤ņÖĆ Ļ░ÖņØ┤ ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ ĒØöĒ׳ ļ©╣ļŖö ļŗżņłśņØś ņØīņŗØņŚÉņä£ FODMAPsĻ░Ć ļ¦ÄņØ┤ ĒżĒĢ©ļÉśņ¢┤ ņ׳ņ¢┤ ņŗØļŗ©Ļ│╝ ņĪ░ļ”¼ļ▓ĢņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ļ░śļō£ņŗ£ ĒĢäņÜöĒĢśļŗż.
Ļ▓░ ļĪĀ
FODMAPsņØĆ ņןĻ┤Ćļé┤ ņłśļČä ņ”ØĻ░Ć(Ļ│╝ļŗ╣, ĒÅ┤ļ”¼ņś¼)ņÖĆ ņןļé┤ Ļ░ĆņŖż ļ░£ņāØ ņ”ØĻ░Ć(Ļ│╝ļŗ╣, Ļ░łļØĮĒāä)ļĪ£ ņØĖĒĢśņŚ¼ Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░Ļ│╝ Ļ░ÖņØĆ ĻĖ░ļŖźņä▒ ņ£äņןĻ┤Ć ņ¦łĒÖśņØś ņ”ØņāüņØä ņ£Āļ░£ĒĢśĻ▒░ļéś ņĢģĒÖöņŗ£Ēé¼ ņłś ņ׳ļŗż. ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņĀĆFODMAPņŗØņØ┤ļŖö Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ņØś ņ”Øņāü(ļ│ĄĒåĄ, ļ│ĄļČĆĒīĮļ¦īĻ░É, ļ│ĄļČĆĻ░ĆņŖż)ņØä ņĀäļ░śņĀüņ£╝ļĪ£(> 70%) ĒśĖņĀäņŗ£ņ╝░ļŗż. ņä▒Ļ│ĄņĀüņØĖ ņĀĆFODMAPņŗØņØ┤ļź╝ ņ£äĒĢ┤ņä£ļŖö ĒÖśņ×É-ņŗØņØ┤ņĀäļ¼ĖĻ░Ć-ņØśņé¼ņØś ļŗżĒĢÖņĀ£ņĀü ņĀæĻĘ╝ļ▓ĢņØ┤ ĒĢäņÜöĒĢśļŗż. ĒĢ£ĻĄŁņØś Ļ╣Ćņ╣ś, ļÉ£ņן, Ļ│ĀņČöņן, ņīłņן ļō▒ņØĆ FODMAPsņØś ĒĢ©ņ£Āļ¤ēņØ┤ ļåÆņĢäņä£ ĒĢ£ĻĄŁņØś Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ ĒÖśņ×ÉņŚÉņä£ ņĀĆFODMAPņŗØņØ┤ļŖö ĒÜ©Ļ│╝Ļ░Ć ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśļ®░, ņØ┤ņŚÉ ļīĆĒĢ£ ļŹö ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






