급성췌장염으로 첫 임상 발현한 1A 병기 췌장암
Stage 1A Pancreatic Cancer Initially Manifesting as Clinical Acute Pancreatitis
Article information
Abstract
췌장암은 불량한 예후를 가지는 대표적인 암 중 하나로 조기 진단이 어렵기 때문에 발견 당시 주변 장기로의 침윤 등으로 인하여 절제 가능한 경우가 적다. 때문에 최근 연구들은 췌장암 발생의 고위험군 설정 및 조기 진단을 위하여 노력하고 있다. 이러한 측면에서 중년 이후에 원인이 뚜렷하지 않은 급성췌장염 발생이 췌장암의 조기 진단의 단서가 될 수 있다는 연구들이 있다. 이번 증례는 원인이 뚜렷하지 않은 급성췌장염이 발생한 66세 남성 환자를 추적 관찰하면서 처음 영상 검사에서 관찰되지 않았던 췌장암을 발견함으로써 근치적 절제를 통하여 림프절 전이를 동반하지 않는 1A 병기 췌장암을 완전 제거할 수 있었고 종양이 주로 췌관 내강을 통하여 진전하는 특징적인 병리 소견을 보였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Pancreatic cancer has a poor prognosis due to the difficulty of early diagnosis. Observation is recommended for early diagnosis of pancreatic cancer in elderly patients with risk factors such as newly diagnosed diabetes and chronic pancreatitis. A 66-year-old male suffered from acute pancreatitis of uncertain etiology. Initial pancreatic imaging showed a main pancreatic duct stricture at the pancreas body/tail junction and minimal duct dilatation without a visible mass. Eight months later, however, pancreatic imaging revealed a pancreatic mass at the previous stricture site with progression of the upstream duct dilation. The patient underwent distal pancreatectomy, and a pathologic examination showed stage 1A pancreatic cancer with a predominantly intraductal spreading pattern. We report a case of stage 1A pancreatic cancer that initially manifested as acute obstructive pancreatitis, which enabled early diagnosis of pancreatic cancer.
서 론
췌장암은 우리나라 주요 암 발생 현황 자료[1]에 따르면 2015년 남녀 전체에서 인구 10만 명당 조발생률 12.4명, 표준화 발생률 7.1명으로 8위에 해당하며, 5년 생존율은 10.7%로 매우 불량한 예후를 가진다고 알려져 있다. 췌장암의 불량한 예후는 첫 번째로 조기 진단을 위한 효율적이고 정확한 진단 수단이 없기 때문에 진단 당시 원격전이나 국소 진행에 의한 혈관 침범으로 약 80%의 환자에서 수술이 불가능하고, 수술을 시행하더라도 환자의 25-30%에서 수술 1년 이내에 국소재발이나 원격전이가 발견되기 때문이다. 두 번째로 수술이 불가능한 환자에서 췌장암의 종양생물학적 특성에 의해 고식적 항암치료 및 표적 치료에 대한 종양 반응이 좋지 않다는 점을 들 수 있다[2].
췌장암은 발생률이 낮고 췌장 자체가 접근이 어려운 장기이므로 위암, 대장암, 간암과 같은 다른 소화기암과 달리 일반인을 대상으로 한 선별 검사가 효과적이지 않다[3]. 이에 임상에서는 췌장암 발생의 고위험군을 설정하여 이들을 대상으로 정기적인 추적 검사를 하는 연구가 활발하게 진행되고 있으며, 췌장암 발생 위험인자로는 만성췌장염, 당뇨 등이 연관되어 있다[3,4]. 한편, 급성폐쇄성췌장염(obstructive pancreatitis)이 일부 췌장암 환자에서 췌장암의 초기 임상 양상이 될 수 있다는 연구들이 발표되고 있다[5,6]. 문헌에 따라 다양하지만 급성췌장염이 발생한 환자의 0.9-3.6%에서 췌장암이 동반된다고 보고되고 있으며[6], 췌장암이 췌관을 기계적으로 폐색시키거나 암세포의 혈관 폐색으로 인한 허혈로 급성췌장염이 발생할 수 있거나 혹은 종양에 의한 췌장효소의 직접적인 활성화로 발생할 수 있다는 병태생리 기전이 제시되었다[5,6].
저자들은 원인이 뚜렷하지 않은 급성췌장염으로 치료받은 병력이 있는 66세 남자를 일정기간 간격으로 췌장 영상을 추적 관찰하였고 이전 영상 검사에서 보이지 않았던 췌장 종양을 조기에 발견해서 수술 절제를 통하여 1A 병기 췌장암을 치료할 수 있었기에 문헌고찰과 함께 보고하는 바이다.
증 례
환자: 66세 남자
주소: 복통
현병력: 8개월 전 발생한 상복부 통증으로 연고지 병원을 방문하였다. 당시 시행한 복부 컴퓨터단층촬영(computed tomography, CT) (Fig. 1A and 1B)에서 췌장 미부가 부어 있고 주위로 염증 소견이 보였지만 췌장 두부 및 체부는 상대적으로 보존되어 있었으며 췌장 미부 주췌관의 미세한 확장 소견이 있었으나 종괴는 관찰되지 않았다. 최근 음주력은 없었고 당시 혈액 검사에서 아밀라아제 201 U/L (30-110 U/L), 리파아제 274 U/L (13-60 U/L)로 상승 소견을 보였지만 간생화학 검사는 정상 소견이었고 담석, 고중성지방혈증, 고칼슘혈증 등의 이상 소견은 발견되지 않아 원인이 뚜렷하지 않은 국소췌관확장이 동반된 급성췌장염으로 진단하였다. 이후 급성췌장염은 내과적 치료만으로 호전되어 퇴원하였고 내원 7개월 전(췌장염 발생 후 1개월째) 촬영한 자기공명영상/자기공명담췌관조영검사(magnetic resonance imaging [MRI]/magnetic resonance cholangiopancreatography [MRCP]) (Fig. 1C and 1D)에서 췌장 체부-미부 경계 부위 주췌관의 협착 소견 및 상류 췌관의 확장 소견이 관찰되었으나, 역시 췌장 종괴는 보이지 않았다. 급성췌장염의 발생 원인이 뚜렷하지 않았고, 특히 주췌관 협착이 동반된 상황에서 간헐적으로 식후 악화되는 상복부 불편감을 호소하여 췌장염 발생 후 5개월째에 복부 CT 검사를 추적하였다. 복부 CT 상 주췌관 확장 소견이 이전보다 진행하였으나 여전히 종괴는 관찰되지 않았다. 이후 증상이 지속되어 본원으로 전원되었다.
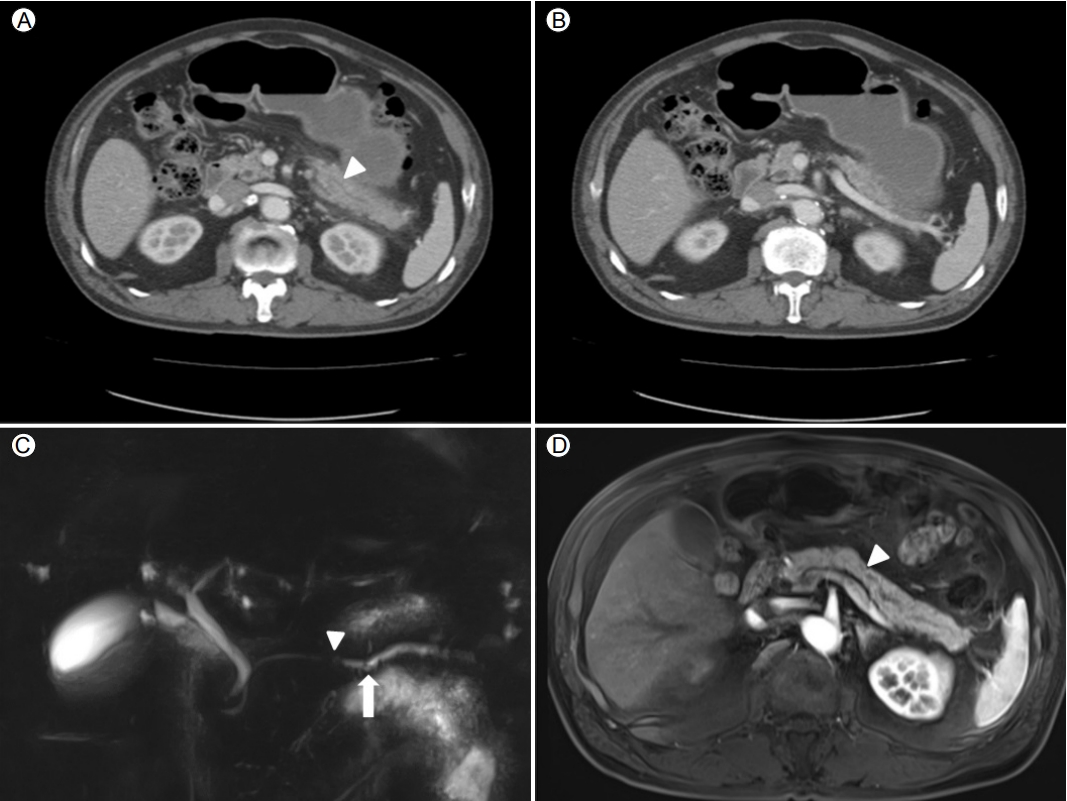
Initial abdominal computed tomography (CT) and magnetic resonance imaging (MRI)/magnetic resonance cholangiopancreatography (MRCP). (A) CT at the time of the acute pancreatitis attack shows minimal dilatation of the pancreatic duct (arrowhead) and peripancreatic infiltration with no visible mass. (B) The pancreatic head portion is relatively spared. (C) One month later, MRCP shows a pancreatic ductal stricture (arrowhead) at the body and upstream duct dilatation (arrow). (D) T1-phase MRI reveals no pancreatic mass at the abrupt narrowing site (arrowhead).
과거력: 내원 10년 전 변이형협심증을 진단받았고 내원 1년 전 고혈압과 당뇨를 진단받고 약제 복용 중이었다.
가족력: 특이사항은 없었다.
사회력: 과거 사회적 음주력이 있었지만 협심증을 진단받은 이후로 최근 10년 동안 금주하였고 20갑년의 흡연력이 있었다.
신체 검사 소견: 혈압은 142/86 mmHg이었고 호흡수는 18회/분, 맥박수는 72회/분, 체온은 36.8℃였고, 체중 70 kg, 신장 159 cm, body mass index 27.76이었다. 흉부 청진에서 심잡음은 없었고 천명이나 수포음도 없었다. 다른 신체검진에서도 특이 소견은 보이지 않았다.
검사실 소견: 일반 혈액 검사에서 백혈구 5,400/mm3, 혈색소 11.7 g/dL, 혈소판 269,000/mm3였다. 생화학 검사에서 아스파르테이트아미노전달효소 26 U/L, 알라닌아미노전달효소 23 U/L, 알칼라인산분해효소 88 U/L, 총 빌리루빈 0.2 mg/dL였다. 아밀라아제는 70 U/L, 리파아제는 51 U/L였고 중성지방은 103 mg/dL, 이온화칼슘은 4.66 mg/dL였다. 종양표지자는 CA 19-9 14.3 U/mL, CEA 2.9 ng/mL로 정상이었다. 혈청 면역글로불린 G 및 G4는 각각 1,180 mg/dL (700-1,600 mg/dL), 86 mg/dL (< 140 mg/dL)였다.
방사선 및 내시경 영상 소견: 복부 CT (췌장염 발생 후 8개월째)에서 주췌관 확장이 이전보다 진행되었으며 MRI/MRCP에서 이전 췌관 협착 부위에 일치해서 약 1.3 cm 크기의 췌장 결절이 새로이 관찰되었다(Fig. 2). 내시경 초음파(endoscopic ultrasonography, EUS) 검사 상에서 MRI/MRCP 소견과 일치되게 저에코성 종양을 관찰할 수 있었으며 22G 바늘(AcquireTM, Boston Scientific Korea, Seoul, Korea)로 세침조직 검사를 시행하였다(Fig. 3). 병리 소견 상 분화도가 좋은 선암으로 확인되어 F-18 fludeoxyglucose 양전자방출단층촬영(positron emission tomography, PET)을 시행하였고, 췌장 결절 부위에 일치해서 SUV 3.0의 고대사성(hypermetabolic) 병변이 관찰되었으며 림프절 및 원격전이 소견은 없어 근치적 절제를 계획하였다.
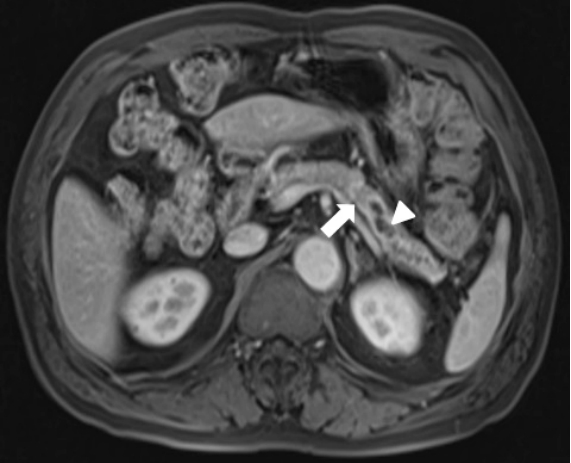
Follow-up magnetic resonance imaging (MRI)/magnetic resonance cholangiopancreatography (MRCP) findings. Eight months after the initial attack of acute pancreatitis, T1-phase MRI/MRCP shows a more dilated main pancreatic duct (arrowhead) and a 1.3 cm lowsignalintensity nodule (arrow) causing ductal obstruction.
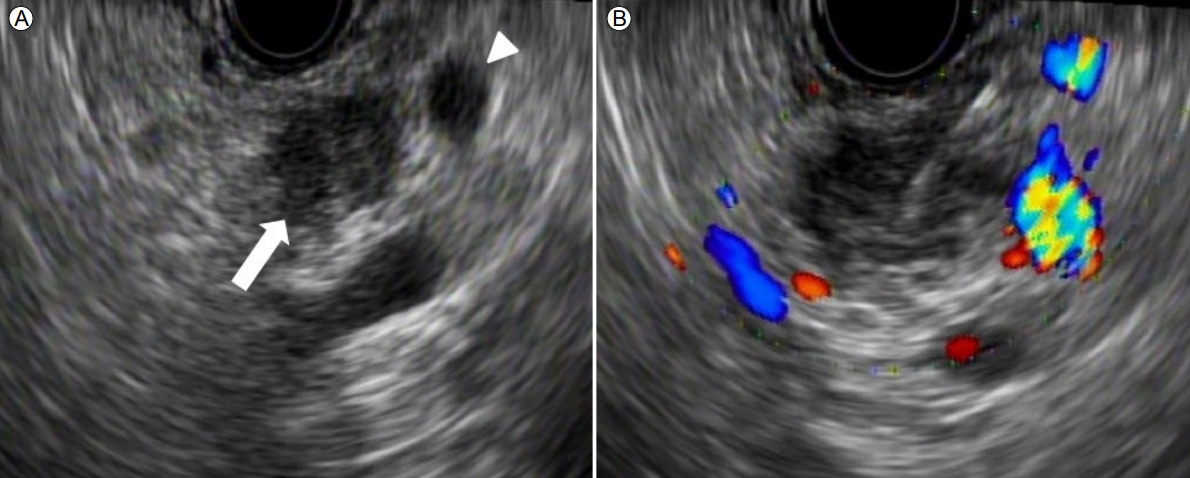
(A) Endoscopic ultrasonographic (EUS) findings show a 1.1 cm ill-defined hypoechoic mass (arrow) and upstream dilatation of the pancreatic duct (arrowhead). (B) EUS-guided biopsy was performed using a 22 gauge core-biopsy needle (Acquire™, Boston Scientific Korea, Seoul, Korea).
치료 및 경과: 환자는 복강경하 원위부 췌장절제술 및 비장절제술을 시행받았고 육안적 소견으로 2.0 × 1.5 × 0.6 cm 크기의 경계가 불분명한 종양과 상류 췌관 확장이 확인되었다(Fig. 4A). 현미경 소견에서 중간 정도의 분화를 보이는 선암 소견이 확인되었는데, 특이한 소견으로 간질 침윤을 보이는 부분이 상대적으로 적고 종양의 대부분이 췌관 내강(lumen)을 따라 진전하는(intraductal spread) 성장 패턴이 관찰되었다(Fig. 4B-D). 종양의 주변부에는 췌장상피내암이 광범위하게 관찰되었으나 췌장 밖 침윤은 관찰되지 않았다(Fig. 4B and 4E). 절제 변연부 침범 및 림프절 전이는 관찰되지 않아 병리학 병기상 T1N0M0, stage 1A로 확인되었다. 환자는 수술 후 별다른 합병증 없이 퇴원하였고, 현재 보조치료요법으로 capecitabine, gemcitabine 항암화학 치료를 시행받고 있으며 3개월째 재발 소견 없이 추적 관찰 중이다.

Pathologic findings of the resected specimen. (A) An ill-defined, speculated mass measuring 2.0 × 1.5 × 0.6 cm (arrowheads) is observed in the body of the pancreas. The main pancreatic duct is dilated upstream of the mass (arrow). (B) The neoplastic glands show low cellularity and are confined to the pancreatic parenchyma (HE, ×12.5). (C) Tumor cells spreading mainly through the preexisting pancreatic duct system (arrowheads) (HE, ×40). (D) A minor part of the tumor shows irregularly infiltrating glands (arrowheads) (HE, ×100). (E) The distal part of the tumor is shown. Pancreatic intraepithelial neoplasia is observed on the left (arrowheads) (HE, ×100).
고 찰
췌장암은 암의 해부 및 생물학적인 특징으로 인하여 대부분의 경우, 발견 당시 외과적 절제가 어려운 경우가 많다[2,3]. 한 연구에서 췌장암 발견을 위하여 10,162명의 일반 인구 집단을 대상으로 CA 19-9과 elastase-1, 복부 초음파 세 가지 선별 검사를 함께 시행하였다. 그 결과 오직 4명(0.04%)에서 췌장암이 발견되었고 이 중 한 명만 수술적 절제가 가능하였다. 췌장암은 최근 그 유병률이 증가하는 추세이지만 아직까지 유병률이 0.01% 정도로 낮아서 일반 인구 집단을 대상으로 시행한 선별 검사는 비용 효과적이지 않다[3]. 그러므로 무증상 일반인에 대한 췌장암 집단검진은 현실적으로 불가능하여 고위험군에 대해서 정기적인 검진을 추천하고 있는 한편, 많은 연구들이 조기 진단을 위한 위험군의 설정과 검사 방법의 발전을 모색하고 있다[4]. 췌장암의 고위험군은 유전적 위험군과 역학적 위험군으로 나뉜다. 유전적 위험군은 유전성 췌장염, Peutz-Jeghers 증후군 등이 포함되어 있고 역학적 위험군은 고령, 흡연, 만성췌장염, 당뇨 등이 연관되어 있다[2,7].
췌장암은 다른 소화기관의 조기 암들과는 달리 조기 췌장암의 기준을 정하기 어렵지만, 종양의 크기가 생존율을 결정하는 중요인자의 하나로 알려져 있다. 최근 한 일본 연구에 따르면 종양 크기가 2 cm 이하이고 종양이 췌장 내에 국한되어 있으며 림프절 전이가 없는 경우(T1N0M0, stage 1A), 수술로 완전히 절제되었을 때 5년 생존율은 68.7%인 반면에 췌장에 국한되어 있어도 종양 크기가 2 cm가 넘으면(T2N0M0, stage 1B) 59.7%이고, 종양 크기가 1 cm 이하인 경우는 5년 생존율이 80.4%에 달한다[8]. 따라서 의미 있는 생존율 연장을 위해서는 1 cm 이하의 진정한 조기 췌장암 발견이 필요하다[8]. 현재 췌장암의 진단을 위하여 임상에서 사용되는 검사들은 복부 초음파, CT, MRI, 내시경 역행성 췌담관 조영술(endoscopic retrograde cholangiopancreatography), EUS, PET검사, 종양 표지자 등이 사용되고 있다[4]. 한 연구에서 EUS가 CT보다 2 cm 미만의 췌장 종괴를 발견하는 데 훨씬 우월하다는 것을 보여주었고, 특히 CT에서 명확한 종괴가 관찰되지 않더라도 주췌관 확장이 관찰되는 경우 EUS를 시행해보는 것을 추천하였다[9]. 다른 연구에서 2 cm 이하의 췌장암 환자군과 2-4 cm 크기의 췌장암 환자군에서 내시경 역행성 췌관 조영술(endoscopic retrograde pancreaticography)을 통하여 주췌관 협착 부위의 솔 세포진 검사와 췌액(pancreatic juice) 채취를 통한 세포진 검사를 시행하였다[10]. 종양 크기가 2 cm 이하의 췌장암 환자에서 본 증례와 같이 주췌관 내강을 따라 종양이 진전하는 패턴이 더 흔히 관찰되었으며(45% vs. 13%), 이들 환자군에서 협착 부위 솔 세포진 검사(70% vs. 50%) 및 췌장액 세포진 검사(75% vs. 44%)의 진단 양성률이 높았다는 소견을 발표하였다[10]. 하지만 급성췌장염이 초기 임상 증상인 췌장암 환자가 어느 정도 되었는지에 대해서는 위 논문에서 언급이 없었다. 본 증례에서 병기 1A의 췌장암이 진단된 이유로 원인이 뚜렷하지 않은 췌장염 때문에 영상 검사를 자주 추적한 이유도 있겠지만, 주로 췌관 내강을 따라 암세포가 진전하는 성장 패턴도 췌장 실질 내에 국한된 초기 병기의 췌장암 발견에 기여했으리라 추측된다. 일반적인 췌장암의 경우, 주로 췌실질로의 침윤(interstitial infiltrative type)과 섬유조직형성(desmoplastic change)이 뚜렷한데 반해서, 본 증례와 같이 주로 췌관 내강으로 암세포가 퍼져나가는 경우(Fig. 4C and 4D), 급성폐쇄성췌장염 발생 가능성이 더 높아진다고 추정된다. 향후 이러한 조직 소견(intraductal spreading type)과 급성폐쇄성췌장염 발생의 연관성에 대한 추가 연구가 필요하다.
이번 증례의 경우, 뚜렷한 원인 없이 급성췌장염이 발생하였고 주췌관 협착이 동반되었기 때문에 비록 초기 영상 검사에서 췌장 종양이 발견되지 않았지만 췌장 영상 검사를 추적하였다. 그 결과 급성췌장염 발생 8개월 만에 시행한 영상검사에서 췌장 종괴를 발견할 수 있었고, 1A 병기의 초기 췌장암을 수술로써 완전 제거할 수 있었다. 그러나 본 증례를 후향적으로 재검토하였을 때, 췌장염 발생 후 5개월째 시행한 복부 CT에서 주췌관 확장이 진행되었을 때 EUS를 시행하였더라면 췌장암 진단 시기를 더 앞당겼으리라 추정된다.
중년 이후 주췌관 협착이 동반된 원인 미상의 급성췌장염의 경우, 비록 췌장 영상 검사에서 종양이 발견되지 않았더라도 종양과 연관된 급성폐쇄성췌장염을 염두에 두어야 하며, 특히 주췌관 협착에 따른 상류 췌관 확장이 진행되었을 때 EUS를 통한 적극적인 조직 검사가 필요하다. 또한 주췌관 협착이 동반되지 않은 경우에도 CA 19-9이 100 U/mL를 초과하였다면 정기적인 추적 검사를 추천한다[6]. 향후 급성폐쇄성췌장염이 첫 임상 양상으로 발현한 췌장암 환자에 대하여 좀 더 많은 증례를 모집하여 임상 소견 및 조직 소견 분석을 통하여 이러한 환자들이 다른 췌장암 환자에 비해 상대적으로 조기에 발견될 수 있는지에 대한 추가 연구가 필요하다.