2019 대한부정맥학회 경피적심혈관중재술을 받는 심방세동 환자에서 항응고 치료 지침
Korean Heart Rhythm Society 2019 Practical Guidelines on Antithrombotic Therapy for AF Patients Undergoing Percutaneous Coronary Intervention or Structural Heart Disease Intervention
Article information
Trans Abstract
The choice of an adequate antithrombotic regimen for atrial fibrillation patients undergoing emergent or elective percutaneous coronary intervention (PCI) should be based on the ischemic event and on the risk of bleeding. Recent randomized controlled trials have consistently demonstrated that dual antithrombotic therapeutic regimens, using non-vitamin K anticoagulants and clopidogrel, are superior to triple or dual therapy with warfarin and aspirin. This report incorporates findings of recent notable studies to provide concrete, clinically useful details and recommendations for bleeding risk assessment and optimal antithrombotic therapeutic strategies after PCI. In addition, we introduce guidelines for antithrombotic management after structural heart disease intervention.
서 론
최근 대규모 역학 및 무작위 연구 후 심방세동 환자에서 급성 관동맥증후군(acute coronary syndrome)이 발생하거나, 또는 경피적관상동맥중재시술(percutaneous coronary intervention, PCI)을 받은 후 치료에 큰 변화가 이루어지고 있다. 이에 발맞추어 유럽 및 미국 등 많은 나라에서 최근 몇 년 사이에 치료 지침을 발표하고 있고[1-6], 국내에서도 이 환자군의 치료 방법에 대하여 다룬 적이 있다[7-10]. 하지만 최근 새로운 관찰 연구와 비타민 K 비의존성 경구 항응고제(non-vitamin K antagonist oral anticoagulant, NOAC)의 무작위 연구 결과에서 리바록사반(rivaroxaban), 다비가트란(dabigatran), 아픽사반(apixaban) 등 NOAC가 와파린에 비하여 지속적으로 장점을 보였고, 삼중요법(triple antithrombotic therapy)은 일관적으로 출혈의 문제점을 보였고, 항혈소판제 중에서 클로피도그렐(clopidogrel)이 아스피린에 비한 장점이 보고됨에 따라 좀 더 자세하게 이를 정리할 필요성이 부각되어 본 치료 지침이 제작되었다.
본 론
최근 발표된 연구의 소개
관찰 연구
한국인에서 심방세동은 심근경색 위험도를 3배 올렸고(위험도 3.1, 95% 신뢰구간 2.22-4.37), 남성에 비해서 여성에서 좀 더 위험도를 높이는 소견을 보였다. 흥미로운 것은 경구 항응고제 및 스타틴 치료는 심방세동 환자에서 심근경색의 위험도를 낮추었다[11]. 국내 PCI를 받는 심방세동 환자는 지난 10년 동안 지속적으로 증가하여, 2015년 기준으로 전체 PCI를 받는 환자의 7%를 차지하고 있다. 하지만 이들 중 38% 정도만 항응고 치료를 받고, 시술 후 1년째 항응고 치료를 받는 비율은 20%가 되지 않으며 대부분 항혈소판제만 투여 받고 있었다[12,13].
기존에 국외에서 발표된 관찰 연구들에서 72% 환자들은 아스피린과 P2Y12 억제제를 복용하는 이중 항혈소판요법 (dual antiplatelet therapy)으로 치료받았고, 26%는 아스피린과 P2Y12 억제제와 경구용 항응고제를 함께 복용하는 삼중요법을 받았고, 2%만이 경구용 항응고제와 아스피린 혹은 P2Y12 억제제를 복용하는 이중요법(dual antithrombotic therapy)으로 치료를 받았다[14]. 기존의 관찰 연구에서 전반적으로 삼중요법은 다른 응고 치료 전략들에 비하여 전체 혹은 주요 출혈의 위험이 높았다. 주요 출혈 위험은 비타민 K 길항제(vitamin K antagonist, VKA)로 치료 환자에게 적절한 항응고제의 치료범위(therapeutic range, TTR)를 유지하지 못하면 증가하였다[15]. 환자 개개인이 갖고 있는 출혈 위험 요소가 출혈의 발생에 관련이 깊었다[15]. 하지만 2016년 심방세동 가이드라인 변경 후 유럽에서 발표된 조사에 따르면 대부분의 환자에서 삼중요법은 4주 정도 사용하며, 이후 12개월은 이중요법을 하며, 1년 이후에는 경구 항응고제만 복용한다고 보고하여 삼중요법의 기간을 줄이고, 이중요법의 기간을 늘리며, 장기적으로 항응고제 단독으로 사용하는 치료 패턴의 변화를 보여주고 있다[16].
항응고 치료와 관련된 새로운 무작위 배정 연구
경구용 항응고제
최근 발표된 리바록사반, 다비가트란, 아픽사반 등 3가지 NOAC의 대규모 무작위 연구와 진행 중인 에독사반의 연구는 표 1에 기술되어 있다. PIONEER atrial fibrillation (AF) PCI 연구에서는 2,124명의 PCI를 시행받은 환자들이 무작위로 이중요법(리바록사반 15 mg qd와 P2Y12 억제제를 12개월 병합, 1군)과 삼중요법(리바록사반 2.5 mg bid와 아스피린 및 P2Y12 억제제를 1, 6, 또는 12개월 병합, 2군) 그리고 일반적 치료(와파린과 아스피린 및 P2Y12 억제제를 1, 6, 또는 12개월 병합, 3군)를 비교하였다[17]. 일반적 치료를 받은 군보다 리바록사반을 투여한 두 군에서 임상적으로 의미 있는 출혈 사건이 유의하게 적었다(1군 16.8%, 2군 18%, 3군 26.7%; p< 0.001). 뇌졸중 예방 효과를 판단하기에는 환자 수가 부족하여 어려우나 심혈관계 원인에 의한 사망이나 심근경색, 뇌졸중에 있어서는 통계적으로 차이를 보이지 않았다.

Randomized trials comparing NOAC vs. VKA in atrial fibrillation patients presenting with acute coronaiy syndrome and/or undergoing percutaneous coronary intervention/stenting
RE-DUAL PCI 연구[18]에서는 2,725명의 PCI를 시행받은 비판막성 심방세동 환자들을 대상으로 이중요법(다비가트란 110 mg 또는 150 mg bid와 P2Y12 억제제)과 삼중요법(와파린과 P2Y12 억제제 및 아스피린)을 비교하였다. 삼중요법에서 아스피린은 1-3개월간 유지되었다. 절반 정도의 환자에서 급성 관동맥증후군이 있었다. 대부분의 환자에서 P2Y12 억제제로 클로피도그렐을 처방받았고, 12%만 티카그레러 (ticagrelor)를 처방받았다. 약물 방출 스텐트를 사용한 환자는 82.6%였다. 일차 결과로 심각한 출혈 또는 임상적으로 유의한 출혈을 확인한 결과, 삼중요법군보다 이중요법군에서 출혈 발생률이 유의하게 적었다. 일차 결과는 110 mg 이중요법군에서 15.4%, 삼중요법군에서는 26.9%였으며(위험도 0.52, 95% 신뢰구간 0.42-0.63; p< 0.001), 150 mg 이중요법군에서 20.2%, 삼중요법군에서 25.7%였다(위험도 0.72, 95% 신뢰구간 0.58-0.88; p< 0.001). 이 연구는 또한 삼중요법에 비하여 다비가트란이 포함된 이중요법의 혈전색전증 사건(심근경색, 뇌졸중, 또는 전신 색전증), 사망 또는 계획에 없던 재관류 치료 등의 복합 사건에 대한 비열등성도 평가하였다. 다비가트란이 포함된 이중요법군에서 복합 사건은 13.7%, 삼중요법군에서는 13.4% (위험도 1.04, 95% 신뢰구간 0.84-1.29; 비열등성 검정에서 p= 0.005)였다. 삼중요법군에 비하여 다비가트란 110 mg 이중요법군에서 스텐트 혈전증, 심근경색 등의 허혈성 사건이 많았으나, 통계학적으로 유의하지는 않았다.
AUGUSTUS 연구[19]는 4,614명의 급성 관동맥증후군 환자나 PCI를 시행받은 환자들을 무작위로 아픽사반 혹은 VKA, 아스피린 또는 위약군 등으로 배정되게 하였다. P2Y12 억제제가 기본적으로 모든 군에서 사용되었고, 이 중 클로피도그렐이 90% 이상을 차지하였다. 현재까지의 연구 중 유일하게 비시술적 치료를 받은 급성 관동맥증후군 환자를 포함하고 있다. 아스피린 유무와 함께 와파린 대비 아픽사반의 출혈 위험도를 비교하는 것이 연구의 주 목적이었다. 중요 혹은 임상적으로 유의한 출혈이 아픽사반 10.5%, 와파린 14.7%로 발생하였고(위험도 0.69, 95% 신뢰구간 0.58-0.81, p< 0.001), 아스피린 16.1%, 위약군 9.0%로 발생하였다(위험 도 1.89, 95% 신뢰구간 1.59-2.24, p< 0.001). 아픽사반군은 사망 혹은 입원의 빈도는 와파린군보다 낮았고(23.5% vs. 27.4%, 위험도 0.83, 95% 신뢰구간 0.74-0.93, p= 0.002), 허혈성 사건은 유사한 빈도를 보였다. 뇌졸중 예방 효과를 통계적으로 검증하기에는 환자 수가 충분하지는 않지만, 아픽사반군에서 뇌졸중의 빈도가 와파린군보다 낮았다(0.6% vs. 1.1%, 위험도 0.50, 95% 신뢰구간 0.26-0.97). 아스피린군은 위약군과 유사한 사망 혹은 입원의 빈도 및 허혈성 사건을 보였다. 그 외 현재 진행 중인 ENTRUST-AF-PCI 연구는 PCI를 받은 심방세동 환자에서 에독사반 및 와파린의 효과를 비교하는 연구가 있다[20].
메타분석에서 삼중요법에 비하여 이중요법에서 출혈이 47% 감소하였다(4.3% vs. 9.0%; 위험도 0.53, 95% 신뢰구간 0.36-0.85) [21]. 주요 심뇌혈관 질환 합병증(10.4% vs. 10%, 위험도 0.85; 95% 신뢰구간 0.48-1.29)과 사망, 심장성 원인에 의한 사망, 심근경색, 스텐트 혈전증, 또는 뇌졸중에 있어서는 이중요법과 삼중요법 간 차이가 없었다.
최근에 발표된 OAC-ALONE [22]은 PCI 시행 1년 뒤 안정적인 심방세동 환자를 대상으로 항응고제(75.2%는 와파린, 24.8%는 NOAC) 단독요법과 항혈소판제와 이중요법을 비교한 무작위 연구로 항응고제 단독요법군이 사망 및 심근경색, 뇌졸중, 전신 색전증, 출혈 등에서 이중요법군에 비하여 비열등 결과를 보여주지 못하였다. 하지만 이 연구는 조기 종료되어서 등록 환자가 부족하여 정확한 결과를 제시하지는 못하였다.
항혈소판제
WOEST 연구는 항응고요법을 하고 있는 환자에서 PCI 후 삼중요법에 비해서 이중요법이 출혈 위험도는 의미 있게 줄이고, 혈전 발생에는 차이가 없음을 보여주었다[23]. PIONEER, RE-DUAL 및 AUGUSTUS 연구에서도 항응고제와 P2Y12 억제제를 사용하는 심방세동 환자에서 아스피린 병용 투여는 이득이 적고 출혈 위험만 올라감을 확인하였다[17,18].
이중 항혈소판요법은 급성 관동맥증후군 환자에서 표준 항혈전요법이다. GEMINI-ACS-1 연구는 이중 항혈소판요법에 아스피린 대신 리바록사반 2.5 mg qd를 사용하여 아스피린을 항응고제가 대체할 수 있다는 개념을 보여주었고, 리바록사반과 클로피도그렐 또는 티카그레러 병합요법이 아스피린과 P2Y12 억제제 병합요법과 비교하여 efficacy endpoints 통계적 차이가 없었지만, 허혈성 사건의 예방을 평가하기에는 숫자가 적었다[24]. COMPASS연구에서는 아스피린 단독요법과 비교하여 리바록사반 2.5 mg bid와 아스피린 병합 요법이 심방세동이 없는 혈관 질환 환자들에서 장기간 허혈성 사건을 예방하는 데 더 좋은 효과를 보였다[25]. 티카그레러 또는 프라수그렐의 표준 용량에서 클로피도그렐과 비교하여 혈소판 억제효과가 커서 아스피린과 병합시 출혈 위험이 크기 때문에 연구가 상대적으로 적은 수 환자에서만 있다[26,27].
주사 항응고제(parenteral anticoagulants)
경구용 항응고제로 치료 중인 심방세동 환자 2,325명을 대상으로 분석한 연구에서 경구용 항응고제를 중지하거나, 중 지하지 않았거나 출혈과 30일 주요 심장사건은 비슷하였다. 그러나 경구용 항응고제를 중지하고 정맥용 항응고제를 투여하는 가교요법(bridging therapy)을 시행받은 환자들은 출혈사건이 높았다[28]. 지금까지 PCI와 관련하여 NOAC의 지속이나 중단이 출혈과 주요 심장사건에 미치는 영향에 대해서 알려진 것은 없다.
급성 관상동맥 질환으로 PCI 시술을 시행하는 경우 이미 경구용 항응고제를 복용 중인 심방세동 환자에게 어떤 정맥용 항응고제(unfractionated heparin, enoxaparin)를 어떤 용량으로 사용할지에 대한 자료도 불충분하다. 계획된 PCI시 INR이 2.5보다 증가되어 있다면 추가적인 정맥용 항응고제는 필요하지 않을 것이다. 반면에 PCI 동안 정맥용 항응고제의 사용은 NOAC를 복용 중인 심방세동 환자에서 마지막 NOAC 복용 시기와 관계없이 권고되고 있다[29].
출혈 위험이 높은 환자에서 스텐트 삽입
약물코팅스텐트 및 금속스텐트
ZEUS 연구는 출혈 위험이 높은 환자에서 zotarolimu 용출 endeavor 약물코팅스텐트가 일반 금속스텐트에 비하여 사망, 심근경색, 목표혈관 재관류를 합친 결과에서 우월함을 보여주었다(위험도 0.76, 95% 신뢰구간 0.61-0.95; p= 0.011) [30]. LEADERS FREE 연구에서는 polymer-free biolimus A9-약물 코팅스텐트가 일차 안전 종점인 사망, 심근경색, 스텐트 혈전증을 감소시키는 것을 보여주었다(위험도 0.71, 95% 신뢰구간 0.56-0.91) [31]. 안전성과 유효성은 장기적으로 경구 항응고 치료가 필요한 환자만을 본 하위그룹에서도 유지가 되었다[32]. SENIOR 연구는 새로운 세대의 약물코팅스텐트 (biodegradable polymer everolimus-eluting stents) 시술을 받은 75세 이상의 고령 환자와 금속스텐트 시술을 받은 환자를 비교하였는데, 17.6%가 등록 당시 심방세동을 가지고 있었다[33]. 사망, 심근경색, 뇌졸중, 목표 병변 재관류를 합친 결과에서 약물코팅스텐트가 유의하게 감소시키는 효과가 있었다(상대 위험도 0.71, 95% 신뢰구간 0.52-0.94; p= 0.02). 출혈은 양 그룹에서 비슷하였다.
이와 같이 새 세대의 약물코팅스텐트의 결과는 일반적으로 환자군과 병변에 따른 하위 그룹과 무관하게 매우 좋았다. 최근 158개 연구의 리뷰에서 새 세대의 약물코팅스텐트는 9-12개월 동안 재협착은 5% 미만이었으며, 스텐트 혈전증은 1%로 모두 비약물 금속스텐트와 초기 약물코팅스텐트에 비하여 매우 낮은 수치를 보였다[34]. 따라서 우월한 재협착 방지 효과를 금속스텐트와 비교할 때, 새 세대의 약물코팅스텐트가 더 짧은 기간의 이중 항혈소판 치료에도 더 높은 혈전증의 위험이 없다는 것을 고려하면 PCI를 받는 심방세동 환자는 반드시 새 세대의 약물코팅스텐트로 치료받도록 권고한다.
생체흡수형 스캐폴드(bioresorbable scaffolds)
생체흡수형 스캐폴드는 목표 병변 재관류 실패의 위험이 높고 추적 관찰 기간 동안 혈전증 위험이 높은데다 기존의 약물코팅스텐트와 비교할 때 1년 내 목표혈관의 심근경색과 스텐트 혈전증이 더 많아 최근에는 거의 임상에서 사용하지 않는다[14].
구조적 심장 질환 중재술에 대한 자료
경카테터 대동맥판막 삽입술(transcatheter aortic valve implantation, TAVI)
대뇌색전증(cerebral embolism)은 TAVI 직후 발생할 수 있는 주요 합병증 중 하나이다. 시술 직후 새로 발생하는 대뇌 허혈성병변은 전체 환자의 60% 이상에서 보고되고, 임상적으로 명확한 뇌졸중은 평균 3% 정도에서 발생한다[35]. 하지만 수술적 대동맥판막 치환술을 받은 환자와 비교할 때 TAVI를 받은 환자의 뇌졸중 위험은 비슷하였다[36-38]. TAVI 후 30일째 뇌졸중 발생률은 0-9%로 보고되고 있다[39]. 뇌혈관 사건 발생에 관련된 요인으로는 판막 장치의 혈전 형성 경향, 스텐트 스트럿의 노출, 고유 판막이 차지하는 판막 주변 공간이 있는 경우 그리고 발작성 심방 부정맥이 있다[35,40]. 관상동맥 질환은 20-70%의 TAVI 환자 존재하고 20-40%에서는 PCI를 필요로 한다. 또한 TAVI 환자의 약 3분의 1에서 심방세동이 발견된다[41].
TAVI 후 항응고 치료에 대한 데이터는 여전히 부족하며 항혈소판제 또는 항응고제의 선택 및 최적 기간에 대한 권장 사항은 주로 PCI 및 개흉 대동맥판막 치환술의 경험을 기반으로 한다. 심방세동 및 관상동맥 질환이 없는 TAVI 환자에서 표준 치료는 저용량 아스피린과 클로피도그렐의 이중 항혈소판제이다. 두 약제를 시술 전 24시간 이내에 시작하고 3-6개월간 유지하며 이후에는 평생 아스피린 단독요법을 유지한다. 하지만 TAVI 후 바로 단일 항혈소판제를 투여받은 환자는 이중 항혈소판제를 투여받은 환자와 비교하였을 때 시술 후 주요 부작용 발생률이 낮았고, 3개월째 생명을 위협하는 중대한 출혈의 위험이 유의하게 감소되었다[42]. 메타분석 결과에서도 이중 항혈소판제는 조기 뇌졸중을 감소 측면에서 이점이 없었고, 주요한 출혈이 증가하는 경향이 나타났기 때문에 항응고 치료 적응증이 없는 모든 환자들에서 시술 후 조기에 단일 항혈소판제를 사용할 것을 제안한다[43].
심방세동이 있고 관상동맥 질환은 없는 TAVI 환자들에서 경구 항응고제 사용은 심방세동 치료 권고안에 따를 것을 권고한다. 이러한 맥락에서 경구 항응고제에 항혈소판제를 추가해야 하는지 여부는 논의되어야 할 부분이다. 조직 대동맥판막 치환술을 받은 환자들의 치료 경험에 따르면 경구 항응고제만으로도 혈전증 발생을 예방할 수 있다. 수술적으로 조직 대동맥판막을 삽입하였을 경우 와파린을 사용하는 것은 일반적으로 3개월 동안 권장되며, 심방세동이 없으면 중단할 수 있다. 현재 진행 중인 연구로는 성공적으로 TAVI를 받은 환자에서 기존의 치료(VKA혹은 단일/이중 항혈소판제)와 아픽사반 5 mg bid의 효과를 비교하는 ATLANTIS 연구가 있다.
심방세동으로 항응고제를 복용하고 있고 최근 PCI를 받은 TAVI 환자들은 TAVI가 아닌 PCI만 받은 환자들과 유사하게 치료해야 한다. TAVI 후 프라수그렐 또는 티카그렐러를 아스피린 또는 NOAC와 조합하여 사용하는 것은 연구된 바 없기 때문에 현재로써는 권고하지 않는다.
뇌경색 및 출혈 위험도 측정
CHA2DS2-VASc 점수체계는 전 세계적으로 심방세동의 뇌경색 위험도 계산에 가장 널리 사용되고 있으며, 관상동맥 질환 및 그로 인한 중재시술을 시행받은 환자에 있어서도 널리 사용되고 있다[44,45]. CHA2DS2-VASc 점수체계에 포함된 ‘V’인 혈관 질환(vascular disease)은 과거의 심근경색증, 말초혈관 질환, 또는 대동맥 죽상반으로 정의되는데, 이는 심방세동 환자에게 추가적인 뇌경색 발생 위험도를 반영하는 데 적합하다.
출혈 위험도 측정 점수체계
출혈 위험도 측정을 위하여 vitamin K antagonist (VKA)를 복용하는 환자들을 대상으로 여러 점수체계가 계발되었는데, 일반적으로 뇌경색과 출혈 위험도는 서로 관련성이 높은데, 그 중 HAS-BLED 점수체계는 CHADS2 점수체계나 CHA2 DS2-VASc 점수체계에 비하여 우월할 뿐 아니라 다른 여러 점수체계에 비하여 유사하거나 다소 우월한 점수체계임이 몇몇 연구에서 확인되었다[46,47].
단순한 출혈 위험도 증가만으로 항응고제를 중단 혹은 보류 해서는 안 된다. 다만 출혈 위험도가 높은 환자, HAS-BLED 점수 3점 이상 환자에서는 좀 더 신중하며 보다 짧은 간격의 정기적인 추적 관찰이 필요하겠다. 매 환자 진료시마다 조절되지 않는 고혈압, 항혈소판제나 NSAID 등의 병용 혹은 잦은 음주 등 조절 가능한 출혈 위험인자들이 있는지 끊임없이 확인하고 필요시 교정을 하여야 한다. 출혈 위험도는 변화할 수 있으므로 재평가가 필요한데, 이는 HAS-BLED 점수의 상승 이후 3개월 이내의 출혈 위험도를 상승시키기 때문이다[48]. 뿐만 아니라 PCI를 시행받는 심방세동 환자를 관리할 때에는 뇌경색, 출혈 위험도뿐 아니라 허혈성 심질환의 악화 위험도를 동시에 평가하는 것이 중요한데, 최근의 후향적 연구들에서 Syntax나 GRACE 점수체계 등이 관상동맥 사건, 사망률 등을 예측하는 데 유용함을 확인한 바 있다[45]. 높은 출혈 위험도를 가진 환자가 Syntax 등의 점수체계 등으로 계산하였을 때 동맥경화 위험도가 낮은 경우에는 삼중요법의 기간을 가능한 줄이고 이중요법으로의 전환을 고려할 수 있겠으며, 항응고제만 단독으로 사용하는 시기 역시 1년보다 더 앞당기는 것을 고려할 수 있겠다[2,49].
출혈 위험도는 높고 상대적으로 뇌경색 위험도는 낮은 심방세동 환자(CHA2DS2-VASc 점수 1점인 남자 또는 2점인 여자)에서는 항응고제 없이 이중 항혈소판요법으로 치료하는 것 역시 한 가지 치료 방법이 될 수 있을 것으로 보인다. 그러나 ACTIVE-W 연구에서 보였듯 이러한 치료법의 선택은 와파린 대비 수치적으로 보다 높은 심근경색을 발생시켰기 때문에 주의가 필요하겠다[50].
최적화된 치료
안정형 협심증에서 관상동맥중재술
심방세동이 있는 안정형 협심증 환자가 관상동맥중재술을 받는 경우만을 대상으로 한 연구는 아직까지 없는 상태이다. 다양한 연구에서 안정형 협심증 환자가 포함된 비율은 0-20% 정도이다. 따라서 안정형 협심증이 있는 심방세동 환자가 관상동맥중재술을 받는 경우 시술 전후 항응고제의 사용, 시술 후 중기에서 장기 항혈전제의 조합과 사용 기간 등은 전체 데이터를 통하여 추정하는 수밖에 없다.
시술시 관리
VKA를 복용하는 경우 중단하지 않고 시술을 하는 것이 여러 연구에서 더 좋은 결과를 보여주고 있다. 한 메타분석에서 항응고제를 중단하지 않고 관상동맥 조영술 또는 중재술을 시행하는 것이 중단하는 경우만큼 안전하였으며 헤파린 가교요법을 하는 경우보다는 더 안전하였다[51]. VKA를 복용하는 환자가 PCI를 받는 경우 대퇴동맥보다 요골동맥을 이용한 시술이 출혈 합병증을 줄일 수 있다.
NOAC를 복용 중인 심방세동 환자가 PCI를 받는 경우는 데이터가 별로 없다. 다비가트란을 이용한 다기관 2상 연구에서 다비가트란군은 헤파린군에 비하여 혈액응고 인자가 증가되어 항응고 효과가 부족한 것으로 나타났다. 임상 경과에서도 구제(bail-out) 항응고요법이 필요한 경우가 높은 경향을 보였다. 하지만 리바록사반을 이용한 다기관 2상 연구에서는 PCI 후에 리바록사반을 투여받은 모든 군에서 헤파린과 비슷한 항응고 효과를 보여주었고, 구제 항혈전제를 투여해야 되거나 카테터와 연관된 혈전이 발생한 경우는 없었다. 30일째 양 군 모두에서 유의한 출혈은 관찰되지 않았다[52]. 이러한 상반된 결과 때문에 안정형 협심증 환자에서 선택적 PCI를 시행하는 경우 NOAC를 중단하지 않고 유지하면서 진행하는 것은 현재 권장되지 않는다. 또한 NOAC를 사용하였을 때 항응고 효과의 불확실성 때문에 혈전성 합병증에 대한 치료가 필요한 경우, 예를 들어 glycoprotein IIb/IIIa 저해제의 투여가 필요한 경우 또는 추가로 헤파린을 투여하는 경우 등에 대해서도 적절한 사용 방법을 잘 모르는 상태이다. NOAC를 사용하는 심방세동 환자에서 시술 중 헤파린을 투여하는 것은 일반적으로 시행되어야 하나 VKA를 복용하면서 INR > 2.0인 경우 헤파린을 추가적으로 투여해야 하는지에 대해서는 불분명하다. 헤파린은 30-50 U/kg 정도의 낮은 용량으로 PCI와 관련된 허혈성 합병증을 예방하는 데 효과적이었기 때문에 출혈성 합병증을 최소화하기 위하여 저용량을 투여하는 것이 낫다[53]. 하지만 대퇴동맥을 이용하여 관상동맥 조영술을 시행할 때는 출혈 위험성이 높아지 므로 PCI를 시행하는 경우에만 저용량의 헤파린을 추가하는 것이 좋을 것으로 판단된다.
삼중요법은 출혈의 위험성이 높기 때문에 관상동맥 조영술 결과를 먼저 확인하고 PCI가 필요할 때 항혈소판제를 추가로 투여하는 것이 바람직할 것으로 보인다. 아스피린은 투여 직후 항혈소판 효과가 나타나지만 클로피도그렐은 600 mg 또는 300 mg을 경구 투여 후 혈소판 억제효과가 나타나기까지 각각 2시간에서 6-8시간이 필요하다[54]. 항응고제를 지속적으로 복용하고 있었고, 항혈소판제는 복용하지 않았던 환자에서 PCI를 시행할 경우 아스피린에 추가하여 클로피도 그렐을 투여할 때 300 mg으로 투여하는 것이 600 mg을 투여하는 것보다 출혈 위험을 줄일 수 있을 것으로 보인다.
급성기 관리
항응고요법 중인 환자에서 급성 관동맥증후군이 발생하거나 PCI 혹은 관상동맥 촬영을 하는 경우에 대해서는 아직 무작위 연구가 없어서 관찰 연구를 근거로 권유한다. 모든 환자는 바로 아스피린 150-300 mg을 경구 투여받아야 한다. 출혈위험을 줄이기 위해서 PCI가 결정될 때까지 P2Y12 억제제는 보류하는 것도 방법일 수 있다[55].
Tissue plasminogen activator 등의 섬유소용해(fibrinolysis)는 금기다. ST elevation MI (STEMI)시 발생 시간과 무관하게 일차 PCI가 가장 좋은 방법이다. 이 경우 요골동맥을 이용하고, 클로피도그렐을 사용하고 PCI 때 600 mg을 한꺼번에 주는 것이 추천된다. 프라수그렐 및 티카그레러는 병합요법시 출혈 위험도가 높아서 일반적으로 추천되지 않는다. PCI시 저용량의 주사 헤파린 사용이 필요하다(e.g. enoxaparin 0.5 mg/kg i.v. 혹은 unfractionated heparin 60 IU/kg) [55].
비ST분절상승심근경색(non-ST elevation MI, STEMI)의 경우 증상 발생 2시간 이내 즉각적 침습적 시술을 하는 경우 STEMI와 동일하게 시술시 관리를 하면 된다. 만약 침습적 시술이 미루어진다면 VKA나 NOAC은 중지하지 말고 유지하다가 시술을 하는 것이 헤파린 가교요법보다 추천된다[51]. VKA 사용 환자의 경우 INR이 2.5 이상이면 헤파린은 주지 않거나, 소량만 주는 것도 좋다. NOAC의 경우 복용 시간과 상관없이 헤파린 추가 투여가 필요하다.
시술 후 그리고 퇴원 후 치료
삼중요법은 주요 심장사건의 다른 조합과 비교하여 주된 출혈의 위험성을 증가시킨다고 지속적으로 보고하고 있다. 대부분의 환자에서 삼중요법이 급성 관상동맥증후군 후 1-6개월 동안 처방되고 있다[2]. 삼중 용법의 적정 사용 기간은 환자의 허혈과 출혈 위험성에 따라 다르다. 하지만 가장 최근 발표된 AUGUSTUS 연구에서는 삼중요법보다 아픽사반(5 mg bid)과 클로피도글렐의 이중요법이 우월한 결과를 보였다. 삼중요법과 이중요법을 할 때 NOAC는 출혈 위험성 측면에서 VKA보다 일반적으로 안전하므로 우선적으로 사용되어야 한다.
출혈의 위험성이 낮은 환자에서 삼중요법은 임상 상황에 따라 3-6개월까지 더 연장될 수 있다[2,56]. 이후 이중요법이 12개월까지 사용되어야 하고, 클로피도그렐이 선호된다. 1년 후에는 항응고제 단독으로 유지하는 것이 이상적이다(Fig. 1). 출혈의 위험성이 높은 경우에는 이중요법이 바로 퇴원시부터 1년 동안 사용될 수 있다[2,56]. NOAC는 사용된다면 뇌졸중 예방을 위하여 허가된 용량 이하의 감량은 권고하지 않고 있다. VKA는 INR을 조금 낮게 유지하되 TTR은 67-70% 이상 되어야 한다. 삼중요법 또는 이중요법 중인 출혈 위험성이 높은 환자에서 프로톤펌프 억제제를 사용하여 위장 보호를 하도록 권고한다[55].
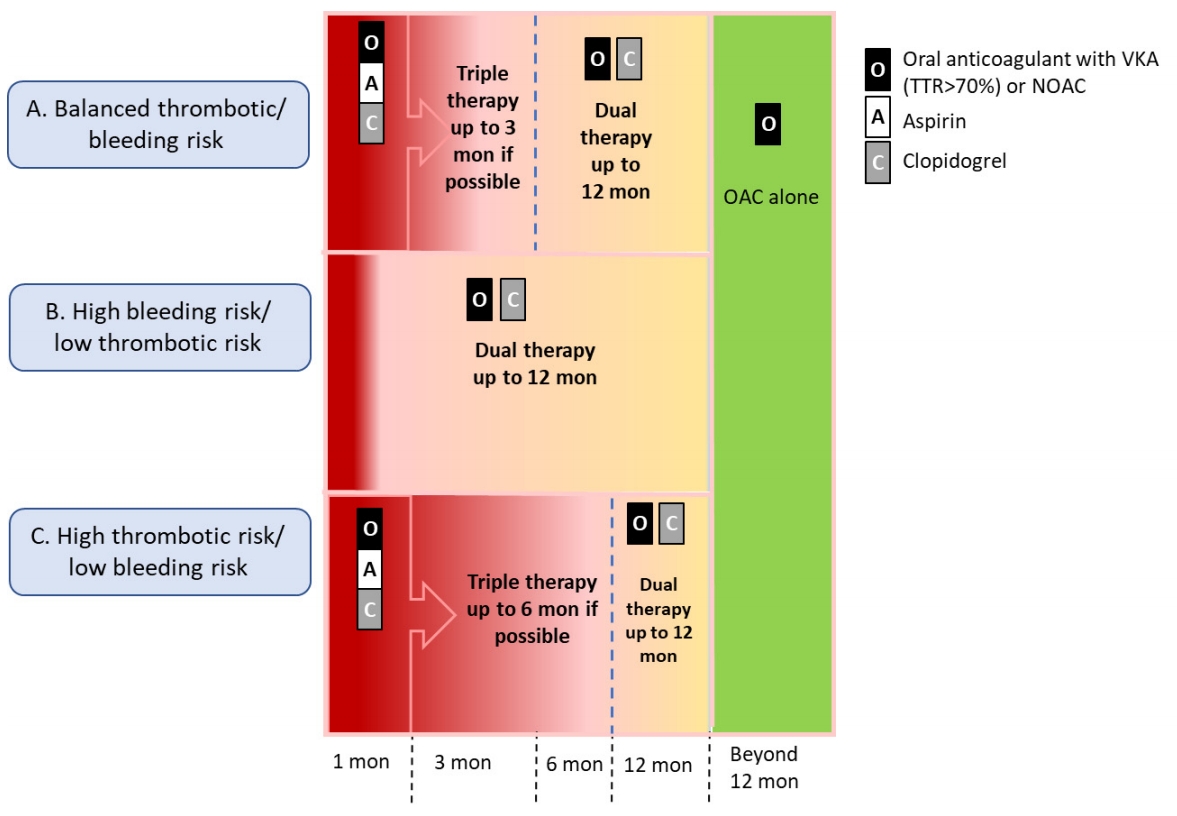
Suggested algorithm for antithrombotic therapy in patients undergoing PCI. PCI, percutaneous coronary intervention; O, oral anticoagulant; A, aspirin; C, clopidogrel; VKA, vitamin K antagonist; TTR, therapeutic range; NOAC, non-vitamin K antagonist oral anticoagulant; OAC, oral anticoagulant.
삼중요법에서 이중요법으로 변경될 때 리바록사반 저용량(15 mg qd)을 사용 중이라면 하나의 항혈전제가 중단될 때 표준용량(20 mg qd)으로 변경해야 한다. 다비가트란은 환자의 출혈과 뇌졸증 위험도를 판단하여 110 mg과 150 mg 모두 선택적으로 사용될 수 있다. 아픽사반은 5 mg bid의 표준용량을 사용하고 감량 기준에 맞는 환자에서만 감량하는 것이 적합하다.
급성 관동맥증후군 환자에서 PCI 이후 조기에 발생한 심방세동
급성 관동맥증후군으로 입원 시술을 받은 환자 약 10%에서 심방세동이 관찰된다. 이 경우 발작성 심방세동과 동일한 위험을 갖는지는 불분명하지만, 일정 기간 항응고요법이 개인별 뇌졸중 위험도를 고려해서 사용되어야 한다. 이들 환자에서 처음 항응고제 사용시 위험도가 높음을 고려해야 한다. NOAC를 사용할 때는 적정 용량 사용이 필요하다.
장기적 관리
1년 후에는 VKA 또는 NOAC 항응고제 단일 요법이 장기간 지속되어야 한다(Fig. 1). 와파린에 대한 과거 자료[57]를 바탕으로 하면, 경구용 항응고제의 효과는 관상동맥 질환 사건 뒤 이차 예방에 있어서 아스피린을 사용한 표준 치료와 유사하다. VKA 단독요법은 VKA 이중요법에 비하여 주요 출혈이 유의하게 적었으며, 2년 후 심혈관 질환에 의한 사망, 심근경색 또는 비출혈성 뇌졸중의 위험에는 차이가 없었다[58,59]. 이러한 VKA의 결과는 NOAC에 있어서도 적용되었다. 따라서 경구용 항응고제와 함께 항혈소판제제의 병합 요법은 허혈 혹은 스텐트 혈전증 위험이 매우 높은 제한된 경우에만 장기간 고려될 수 있다.
경피적심혈관중재술을 받는 심방세동 환자 관리 요약
일반 고려 사항
1. 삼중요법 기간은 짧게 하고, 이중요법으로 변경한다. 삼중요법 기간은 급성 혹은 급성이 아닌 절차, 출혈위험성, 스텐트 유형에 따라 결정한다.
2. 심방세동 환자의 CHA2DS2-VASc 및 HAS-BLED 점수 등을 사용하여 뇌졸중 및 출혈 위험을 평가해야 한다.
3. 출혈 위험이 높고, 혈전 위험이 낮은 환자에게는 경구용 항응고제와 클로피도그렐을 병용하는 이중요법이 초기부터 고려될 수 있다.
4. 리바록사반, 다비가트란 또는 아픽사반과 클로피도그렐 복용의 이중요법은 와파린을 이용한 삼중요법보다 출혈 위험이 낮으나, 뇌졸중 위험 효과는 충분히 평가되지 않았다.
5. 다비가트란 이중요법시 허혈성 사건의 위험을 줄이기 위하여 하루에 2회 150 mg 표준 용량을 사용한다. P-glycoprotein 억제제 복용, 출혈 고위험군 또는 노인 환자에서 다비가트란 110 mg 저용량을 사용한다.
6. 리바록사반 이중요법시 저용량인 15 mg 하루 1회 복용을 사용하며, 특히 중등도 신부전 환자 또는 출혈 위험이 높은 환자의 경우 저용량을 사용해야 한다.
7. 아픽사반 이중요법시 표준 용량인 5 mg 하루 2회 복용을 사용하며, 용량 감량 기준에 맞으면 저용량을 사용한다.
8. 에독사반 이중 및 삼중요법 사용시 표준 용량인 60 mg 하루 1일 복용을 사용하고, 용량 감량 기준에 맞으면 저용량을 사용한다.
9. VKA 이중요법시 INR은 2.0-2.5를 목표로 하며, TTR > 65-70%를 목표로 한다.
10. VKA로 항응고요법을 받던 환자가 혈관중재술을 하면 VKA를 중단하지 않고 시술을 하는 것이 헤파린 가교요법을 하는 것보다 안전하다.
11. 항응고제 투여 환자에서 PCI가 계획되어 있다면 항혈소판제로 전처치하는 것이 적절하다. 하지만 P2Y12 억제제로 전처리하는 것을 혈관 구조를 파악할 때까지 미루는 것이 좋다.
12. 항응고제 투여 중인 환자에서 P2Y12 억제제로는 클로피도그렐이 추천되며, 프라수그렐과 티카그레러는 출혈 위험이 높기 때문에 피해야 한다.
13. 삼중 또는 이중요법시 NOAC은 VKA보다 안전하며 금기사항이 없는 경우 추천된다.
14. CHA2DS2-VASc 점수 2점 이상의 심방세동 환자는 NOAC 복용 중 급성 관동맥증후군 혹은 PCI를 하게되면 혈소판제를 추가하여 12개월까지 복용해야 한다.
15. 1년 후 안정된 혈관 질환이 안정되면 항응고제 단독 사용이 추천된다.
16. 출혈의 위험을 최소화하기 위하여 관상동맥 조영술/PCI를 위하여 요골동맥 접근을 고려해야 한다.
17. 모든 이중요법 환자에서 프로톤펌프 억제제로 위장 보호를 고려해야 한다.
18. 우월한 재협착 방지 및 낮은 스텐트 혈전증으로 PCI시 새 세대의 약물코팅스텐트로 치료를 받도록 권고한다.
긴급이 아닌 또는 안정형 관상동맥 질환을 가진 심방세동
1. NOAC를 복용하던 환자가 긴급이 아닌 PCI를 시행하는 경우 예정된 시술 12-48시간 전 중단을 고려할 수 있다. 중단 시간은 시술 중 약제, 신장 기능 및 표준 국소 항응고요법의 사용에 따라 결정되야 한다. NOAC은 PCI 시술 당일 저녁이나 다음날 아침에 다시 시작해야 한다.
2. 출혈 위험이 낮은(HAS-BLED 0-2) 환자에서 PCI를 시행하는 경우 4주-6개월 동안 삼중요법 후 이중요법을 6-12개월까지 계속해야 한다.
3. 출혈 위험이 높은(HAS-BLED ≥ 3) 환자에서는 삼중 혹은 이중요법은 PCI 후 1개월만 하고, 이중요법을 남은 6개월까지 지속한 후 (N)OAC 단독요법을 한다.
4. 출혈 위험이 매우 높은(예: 최근의 출혈 사건) 환자의 경우, 아스피린을 생략할 수 있으며 NOAC와 클로피도그렐 이중요법을 3-6개월간 계속 투여할 수 있으며, 이후는 (N)OAC 단독요법을 한다.
5. 1년 이후에는 모든 환자에서 항응고제 단독요법이 장기항혈전 치료로 권장되지만, 허혈 위험도가 높은 경우에는 이중요법을 고려할 수 있다.
6. 고위험 환자(예: TAVI 또는 출혈 위험이 높은 중재시술)에서는 48시간 이상 동안 항응고제를 중단하고, 가교요법을 할 수 있다.
7. 가교요법 기간에 항응고 기전이 이중으로 억제되어 출혈 위험이 상승된다. NOAC를 사용하는 경우 모든 가교요법의 시기는 신장 기능 및 특정 NOAC의 약동학에 근거하여 조정되어야 한다.
불안정 협심증과 non ST-elevation MI를 포함한 non-ST elevation-ACS
1. NSTE-ACS가 발생한 항응고제 복용 중인 심방세동 환자의 경우, 아스피린 부하는 STEMI와 동일하게 하고 클로피도그렐이 P2Y12 억제제 중 사용되어야 한다.
2. P2Y12 억제제를 사용한 전처치는 24시간 이내에 조기 침습적인 전략이 필요한 경우 관상동맥 조영술의 시점까지 보류될 수 있다.
3. 조기 침습적 전략은 중등도에서 고위험의 NSTE-ACS를 가진 심방세동 환자에서 치료 결정을 신속하게 하고, 최적의 항혈전요법을 결정하기 위하여 선호되어야 한다.
4. 항응고제와 함께 티카그레러 또는 프라수그렐은 클로피도그렐, 아스피린 및 항응고제 사용 중 발생한 스텐트혈전증, 클로피도그렐 내성 등 특수 상황에서만 고려될 수 있다.
5. 출혈 위험이 낮은 급성 관동맥증후군 환자(HAS-BLED 0-2)에서는 삼중요법은 스텐트 유형에 관계없이 3-6개월을 하고, 이후 12개월까지 이중요법을 한다.
6. 출혈 위험이 높은 급성 관동맥증후군 환자(HAS-BLED ≥ 3)에서는 삼중요법은 스텐트 유형에 관계없이 4주간하고, 이후 12개월까지 장기적으로 이중요법을 한다.
7. 출혈 위험이 매우 높은 급성 관동맥증후군 환자에서는 아스피린은 제외한 이중요법을 3-6개월까지 하고, 다음으로는 (N)OAC를 한다.
8. 1년 이후에는 모든 환자에서 항응고제 단독요법이 장기항혈전 치료로 권장되지만, 허혈 위험도가 높은 경우에는 이중요법을 고려할 수 있다.
Primary PCI
1. 항응고제 투여 환자가 STEMI가 발생하면, PCI를 통한 재관류 예상 시간에 관계없이 primary PCI를 하여야한다.
2. STEMI시 운영자의 전문 지식과 선호도에 따라 시술에 따른 출혈을 피하기 위하여 primary PCI는 요골동맥 접근이 최선이다.
3. 출혈 위험이 낮은 STEMI 환자(HAS-BLED 0-2)에서는 삼중요법은 스텐트 유형에 관계없이 6개월을 하고, 다음으로는 12개월까지 장기적으로 이중요법을 한다.
4. 출혈 위험이 높은 STEMI 환자(HAS-BLED ≥ 3)에서는 삼중요법은 스텐트 유형에 관계없이 4주간 하고, 다음으로는 12개월까지 장기적으로 이중요법을 한다.
5. 출혈 위험이 매우 높은 STEMI 환자(최근의 출혈)에서는 아스피린을 제외한 이중요법을 3-6개월까지 하고, 다음으로는 (N)OAC 단독요법을 한다.
결 론
경피적중재술을 받는 심방세동 환자에서 적절한 항혈전요법의 선택은 허혈성 사건과 출혈의 위험도에 근거하여 결정해야 한다. 최근 몇 년 사이에 중요한 연구들이 발표되면서 NOAC와 클로피도그렐을 이용한 이중 항혈전요법이 와파린과 아스피린을 이용한 삼중 혹은 이중요법보다 월등히 좋음이 밝혀졌다. 본고는 이러한 최근 연구들을 바탕으로 중재시술 후 심방세동 환자에서 출혈 위험도 조사 및 적절한 항혈전요법을 제시하고 있다. 또한 구조적 심장 질환의 중재술 후 항혈전요법의 가이드라인을 제시하고 있다.
Acknowledgements
본 논문은 보건복지부 한국보건의료연구원 연구비 (HI15C1200)의 도움으로 만들어졌습니다. 자료 수집에 도움을 주신 한국 비엠에스제약 의학부 이혜주, 바이엘코리아 최종원, 보령제약 이승연, 한국 다이찌산쿄 박원님께 감사를 드립니다.