제2형 자가면역 췌장염 조직 소견을 보인 들창자증후군에 의한 재발성 췌장염
Recurrent Pancreatitis Caused by Afferent Loop Syndrome with Pathologic Features of Type II Autoimmune Pancreatitis
Article information
Abstract
재발성 췌장염의 드문 원인으로 들창자증후군과 동반된 췌장염이 있을 수 있다. 따라서 원인 불명의 반복적인 췌장염 환자에서 수술력을 확인하고, 기존의 영상 소견을 종합하여 원인을 찾는 시도가 필요하며, 유발 원인에 따라 적절한 치료가 이루어져야 한다. 제2형 AIP는 반복적인 급성췌장염의 형태로도 나타날 수 있어 젊은 환자에서 전형적인 췌장 영상 소견과 조직 소견이 동반된 경우 감별해야 하는 질환 중 하나이지만 종합적인 임상적인 판단이 최종 진단에 가장 중요하다.
Trans Abstract
Afferent loop syndrome (ALS) is a rare cause of recurrent pancreatitis. Recurrent pancreatitis in association with ALS can develop due to impaired outflow of pancreatic juice or reflux of enteric secretions caused by increased intraluminal duodenal pressure. Here, we report a case of ALS presenting as recurrent acute pancreatitis due to chronic intermittent partial obstruction of the third portion of the duodenum caused by postoperative adhesion. Interestingly, pancreatic histology showed a granulocytic epithelial lesion, which is a diagnostic feature of type 2 autoimmune pancreatitis (AIP, idiopathic duct centric chronic pancreatitis [IDCP]). From this case we learned that the diagnosis of type 2 AIP should be made in the appropriate clinical setting.
서 론
급성췌장염은 여러 원인에 의하여 발생할 수 있는 것으로 알려져 있고 담석, 음주는 가장 흔한 원인으로 급성췌장염의 70% 이상을 차지한다. 이 외에도 약물이나 고중성지방혈증, 고칼슘혈증과 같은 대사성 요인, 해부학적 변형, 유전적 요인, 외상, 자가면역 질환 등에 의하여 유발될 수 있다[1].
들창자증후군(afferent loop syndrome)은 드물지만 재발성 췌장염의 원인이 될 수 있다. 들창자증후군은 위공장문합술(gastrojejunostomy)을 시행한 이후 만들어지는 십이지장 및 근위공장으로 이루어지는 수입각의 기계적인 폐색에 의한 배출 장애이다. 폐색의 흔한 원인으로는 유착, 탈장, 각형성(angulation), 위석(bezoar) 등이 알려져 있다. 수술 후 1주일 이내 수입각의 완전 폐색에 의하여 급성 들창자증후군의 형태로 나타나거나 수개월 또는 수년에 걸쳐 발생한 부분 폐색이 원인이 되어 만성 들창자증후군으로 나타날 수 있다. 문헌에 따라 차이가 있지만 위부분절제술 및 위공장문합술(subtotal gastrectomy with Billroth 2 gastrojejunostomy)을 시행한 경우 들창자증후군의 발생률은 0.3-1.0%로 알려져 있다[2]. 급성 상복부 통증, 구출성 담즙성 구토가 특징적이나 진찰 소견만으로는 비특이적이고, 폐쇄성 황달, 담관염, 또는 췌장염이 동반되어 나타날 수 있어 과거 위공장문합술을 시행받은 병력이 있는 환자에서는 한번쯤 들창자증후군을 의심하여 보는 것이 필요하다.
국내에서도 급성췌장염을 동반한 들창자증후군이 보고된 바 있다. 한 증례에서는 위부분절제술 및 위공장문합술을 시행한 지 8년 후 각형성에 유발된 들창자증후군이 췌장염의 형태로 발생하여 내시경을 통하여 각형성을 풀어주어 경과의 호전을 보였고, 다른 증례에서는 위공장문합술 이후 탈장이 원인이 되어 들창자증후군과 동반된 췌장염이 발생하여 수술적 치료를 하였다[3,4]. 저자들은 수술과 연관된 장유착에 의하여 발생한 들창자증후군 환자를 경험하였다. 본 환자는 재발성 췌장염으로 임상 발현하였으며 외과적 수술을 통하여 치료되었고, 췌장 조직 검사 상 제2형 자가면역 췌장염(type 2 autoimmune pancreatitis [AIP] or idiopathic duct centric chronic pancreatitis [IDCP])의 특징적 소견으로 알려져 있는 췌관 내 호중구 침윤(granulocytic epithelial lesion, GEL)이 확인되었기에 문헌고찰과 함께 보고한다.
증 례
61세 남자가 내원 전일 발생한 배꼽 주위, 우상복부 통증으로 응급실에 내원하였다. 40년 전 교통사고로 위부분절제술과 위공장연결술을 시행받았고, 약 1년 전부터 원인이 명확하지 않은 췌장염으로 1년 사이 네 차례 타원에서 입원 치료받은 병력이 있었다. C형간염 보유자로 주기적으로 경과 관찰하고 있었고, 음주력은 없었다.
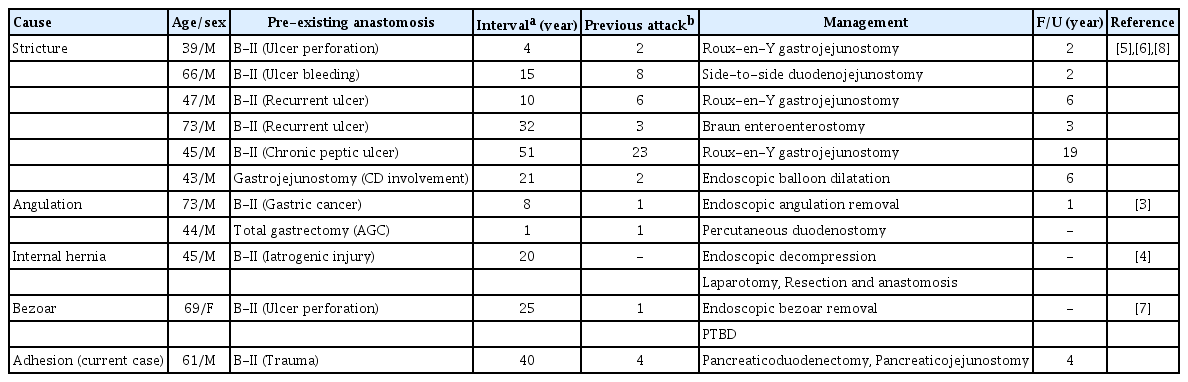
응급실 내원 당시 활력 증후는 혈압 109/73 mmHg, 맥박 74회, 호흡수 20회, 체온 36.8℃였고, 의식은 명료하였다. 신체 검사에서 심한 통증으로 인하여 급성 병색을 나타냈고, 이전 췌장염 발생시와 같은 양상으로 통증이 발생하였다. 두경부, 흉부에서 이상 소견은 없었으나 복부 진찰에서 전 복부에 걸쳐 압통이 동반되었고, 반발 압통은 뚜렷하지 않았다. 일반 혈액 검사에서 백혈구 5,100/mm3, 혈색소 9.3 g/dL, 혈소판 173,000/mm3, C-반응단백 0.11 mg/dL였다. 아스파테이트전이효소 39 IU/L, 알라닌전이효소 28 IU/L, 알카라인 포스파타아제 92 IU/L, 감마-글루타밀트랜스펩티다아제 95 IU/L, 총빌리루빈 0.9 mg/dL, 아밀라아제 1,216 IU/L, 리파아제 2,752 IU/L로 확인되어 급성췌장염의 재발을 의심하였다. 당시 시행한 복부 컴퓨터단층촬영(computed tomography, CT)에서 췌장의 부종과 췌장 주위의 침윤, 체액 저류가 관찰되어 급성췌장염에 합당한 소견을 보였다. 다만 특이하게 십이지장 절단 끝 부위(duodenal stump) 및 십이지장 제2부가 뚜렷하게 확장되어 있으면서 내부에 혈종으로 의심되는 고음영 종괴가 확인되었고, 십이지장 제3부의 협착이 의심되었다(Fig. 1A).
(A) Abdominal computed tomography image at the time of admission to our hospital (fifth attack). A tight stricture at the third portion of the duodenum (D3, arrow) and prominent dilatation of the duodenum (arrowheads) are seen. A round mass suggestive of hematoma is present in the distended second portion of the duodenum (D2). Diffuse pancreatic swelling with peripancreatic fat infiltration and mild pancreatic duct dilatation are evident. (B) Magnetic resonance cholangiopancreaticography image. The duodenal stump and D2 show cyst-like distension (arrowheads). A nonenhancing mass hematoma is seen in the distended duodenum. The main pancreatic duct (arrows) is uniformly smooth without irregular narrowing. The Common bile duct is ligated (empty arrowhead). (C) An endoscopic examination revealed a previous Billroth II operation with subtotal gastrectomy. The lumen of the afferent duodenum is narrowed. The endoscope was unable to pass beyond the third portion of the duodenum
십이지장 협착 부위를 확인하기 위하여 상부위장관내시경과 복부 자기공명췌담관조영술(magnetic resonance cholangiopancreatography, MRCP)을 추가로 시행하였다. 당시 시행한 MRCP 영상에서 주 췌관의 협착은 관찰되지 않았고, 이전 수술로 결찰된 총담관이 확인되었다(Fig. 1B). 상부위장관 내시경에서 잔존 위에 오래된 혈괴가 관찰되었고, 문합 부위에는 특이 소견이 없었으나 십이지장 제3부로 진입하는 내강이 심하게 좁아져 내시경이 통과할 수 없어 유두부에 접근할 수 없었다(Fig. 1C).
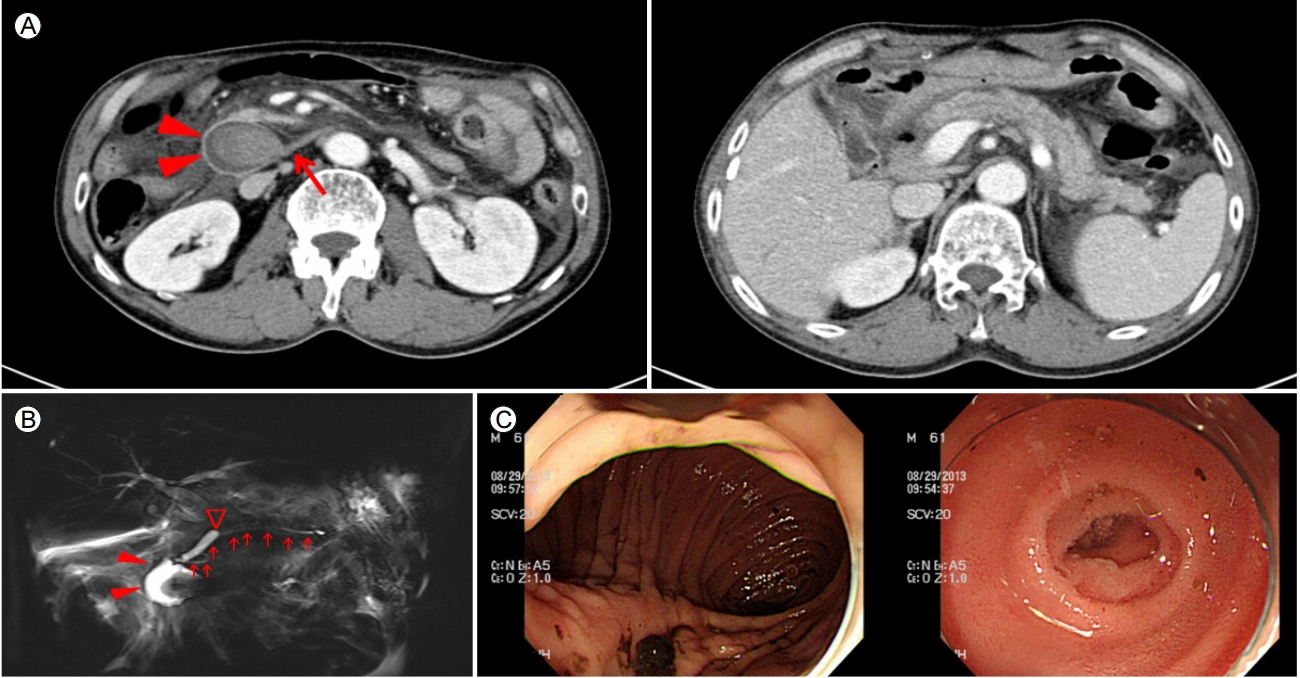
이전에 타원에서 시행한 영상 소견들을 검토하였다. 심한 췌장염으로 타원에 입원하였을 당시 시행한 복부 CT에서 이번 재발 때와 유사하게 십이지장 제2부 확장이 뚜렷하였고, 내부에 혈괴로 의심되는 병변이 동반되었다. 이와 함께 전 췌장에 걸쳐 부종, 침윤, 체액 저류가 관찰되었다(Fig. 2A). 증상이 호전되었을 때 촬영한 CT에서는 십이지장 확장이 이전보다 줄어들면서 췌장염은 일부 호전되는 양상을 보였다(Fig. 2B). 수술 과거력 및 내시경을 포함한 영상 소견을 종합하여 수술과 연관된 십이지장 협착에 의한 들창자증후군과 동반된 췌장염이 반복적으로 발생하였을 가능성이 제일 높을 것으로 판단하였다. 협착 부위로의 내시경적 접근이 어렵고, 협착의 정도를 고려하였을 때 반복적인 췌장염이 발생할 위험성이 높아 수술적 치료를 시행하였다.
(A) Abdominal computed tomography (CT) image obtained during the second attack. Similar to Figure 1A, tight stricture at D3 (arrow) and distended D2 (arrowheads) with internal hematoma are seen. Diffuse pancreatic swelling and peripancreatic infiltration are also noted. (B) Follow up CT image taken when there was no symptom of pancreatitis between attacks. D2 is decompressed, and the pancreas swelling and peripancreatic infiltration are improved.
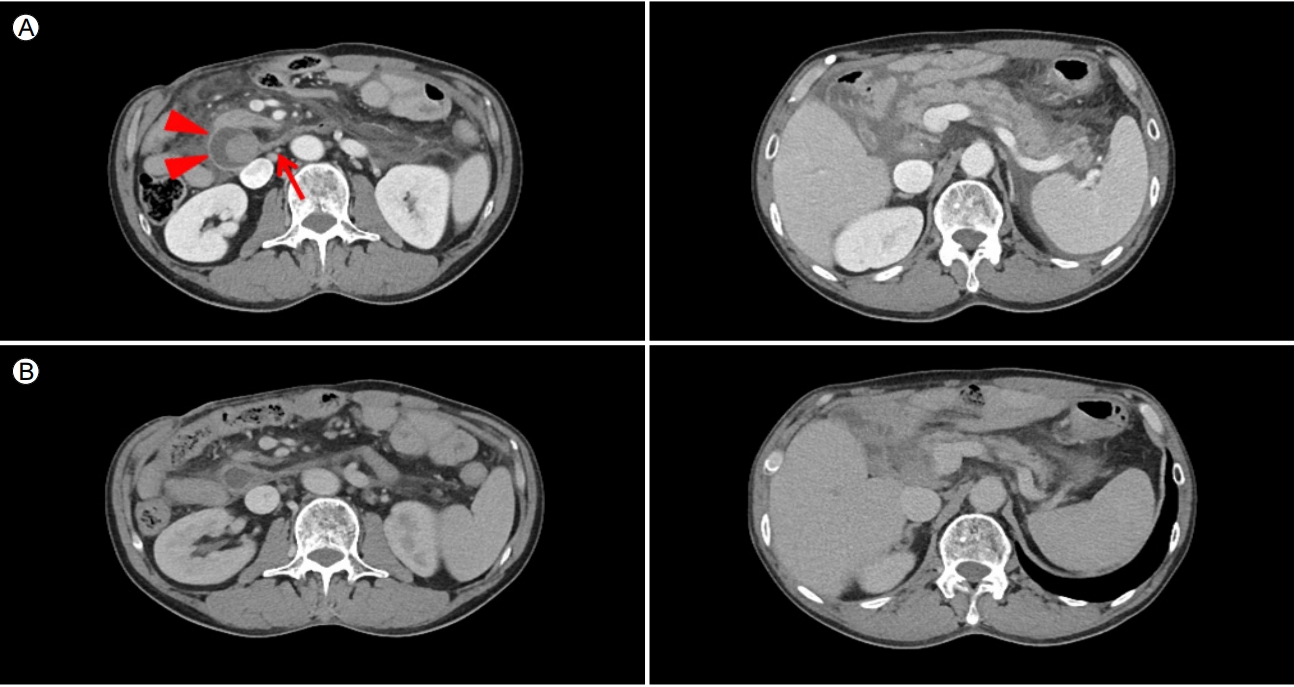
당시 수술장 소견에서 복강 내 심한 유착이 확인되었고, 십이지장 제2, 제3부가 단단하게 유착되어 있어서 수입각(afferent loop)을 포함하여 췌십이지장 절제술(pancreaticoduodenectomy)을 시행하였다. 기존에 담낭공장문합(cholecystojejunostomy)이 되어있던 소장을 절제하여 새로운 담관공장문합(choledochojejunostomy), 췌장공장문합(pancreaticojejunostomy), 공장-공장문합(jejunojejunostomy)도 이루어졌다(Fig. 3).
Schematic anatomic illustration. (A) Pre-existing subtotal gastrectomy and Billroth-II gastrojejonostomy status. The common bile duct and duodenal stump were ligated and cholecystojejonostomy was noted. (B) Surgeries, including pancreaticoduodenectomy, performed for afferent loop syndrome. The remaining pancreas was anastomosed by pancreaticojejonostomy. A new choledochojejunostomy and jejunojejunostomy were performed. S, stomach; P, pancreas; D, duodenum; J, jejunum; C, common bile duct; X, luminal narrowing of the third portion of the duodenum.
육안적 조직 소견에서 췌장 두부의 종괴 소견은 없었고, 췌장 실질의 소엽 구조는 잘 보존되어 있었다. 주 췌관의 협착 및 확장 소견은 보이지 않았다. 현미경으로 확인하였을 때 주 췌관에 림프형질세포, 호중구를 포함하는 만성 염증 세포 침윤이 확인되었다(Fig. 4). GEL이 소엽간 췌관(interlobular pancreatic duct) 내부에 확인되었다. 간질(stroma)에는 림프구, 형질세포, 호산구로 이루어진 염증세포가 밀집되어 침윤되어 있었다. 다수의 호중구가 도관 상피 세포(ductal epithelial cell) 내부 및 내강에 침윤하여 농양을 형성하였다(Fig. 4). 다른 부위에서는 심한 내강 내부의 호중구 침윤에 의하여 소엽간 췌관이 파열되어 있었고, 파열된 췌관으로부터 호중구가 넘쳐(spill over) 간질에 침윤된 염증세포들과 혼재되어 있는 소견을 보였다(Fig. 4). 선방 세포를 포함한 췌장 실질에도 전반적인 호중구 침윤이 확인되어 있었다(Fig. 4). 이러한 조직 소견은 기존에 알려진 제2형 AIP에서 특징적인 GEL 소견과 일치하였다.
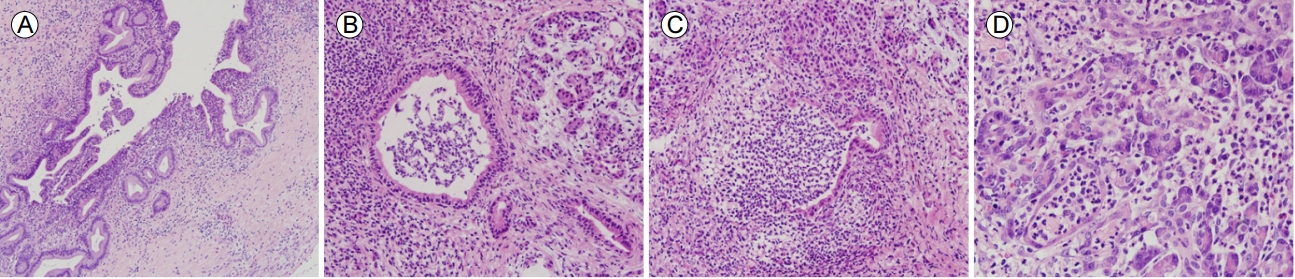
Histopathology of a resected specimen of the pancreatic head. (A) Chronic active inflammatory cell infiltration, including lymphoplasma cells and neutrophils, is noted in the main pancreatic duct (H&E staining, original magnification, ×10). (B and C) Granulocytic epithelial lesions (GELs) in the interlobular pancreatic ducts. (B) Dense mixed inflammatory cell infiltration, consisting of lymphocytes, plasma cells, and eosinophils, observed in the stroma. The interlobular duct shows an intraluminal abscess and neutrophilic infiltration in ductal epithelial cells (H&E staining, ×20). (C) Rupture of the interlobular duct due to a marked neutrophilic luminal abscess. Spilled over neutrophils are mixed with infiltrating stromal inflammatory cells (H&E staining, ×20). (D) Numerous pancreatic parenchymal neutrophilic infiltrations are observed (H&E staining, ×40).
혈청 면역글로불린 G 및 G4는 각각 1,910 mg/dL (700-1,600 mg/dL), 19 mg/dL (<135 mg/dL)로 확인되었다. 조직 검사에서 제2형 AIP에 부합하는 GEL이 확인되었으나 임상 양상, 영상 소견이 자가면역 췌장염에 부합하지 않아 자가면역 췌장염 가능성은 낮다고 결론 내리고, 스테로이드 치료 없이 경과 관찰하였다. 이후 환자는 4년째 췌장염 재발없이 안정적인 경과를 보이고 있다.
고 찰
십이지장 제2부는 후복막에 위치하여 내부 또는 외부적인 요인에 의하여 폐색에 취약하다. 특히 위부분절제술 또는 췌십이지장절제술과 함께 위공장문합술을 시행한 경우 수입각의 말단이 되는 십이지장을 결찰하게 되면서 십이지장 절단 끝(duodenual stump)으로 이루어진 1개의 폐색이 이미 존재하게 된다. 이러한 상황에서 하부의 폐색까지 동반된 경우에는 폐쇄 고리(closed loop)가 형성되면서 들창자증후군이 호발한다. 일반적으로 십이지장 내의 저류된 담즙, 췌액, 및 장액이 간헐적으로 문합부 위쪽으로 역류하며 구토 증상을 일으키지만, 폐쇄 고리가 형성되면 십이지장 제2부의 내강의 압력이 상승하게 되며 이로 인하여 담관 또는 췌관으로 역압(back pressure)이 걸리면서 담관염, 폐쇄성 황달, 췌장염이 동반된다[2].
들창자증후군의 발생에는 수술적인 기법과 수술 후 동반된 합병증이 중요한 영향을 미친다. 수입각이 30-40 cm 이상으로 길거나 잔존 위가 전결장(antecolic) 형태로 문합된 경우 호발한다. 유착 및 협착, 각 형성(angulation), 내탈장(internal hernia), 장염전, 중첩증 등의 수술 후 합병증이 원인이 되어 들창자증후군을 일으킬 수 있다. 그 외의 다른 유발 원인으로는 장결석(enterolith), 위석, 문합 부위 궤양에 의한 반흔, 종양, 복막 전이가 있다[2]. 보존적인 치료가 주를 이루는 급성췌장염과는 달리 들창자증후군에 의한 췌장염의 치료는 담즙과 췌장액의 배출을 원활하게 하고, 수입각 내부의 압력을 정상화하는 것으로 수술 또는 시술을 통하여 폐쇄 부위를 제거 또는 확장, 우회시키는 것이다. 본 증례의 경우 십이지장 제2, 제3부가 췌두부와 심하게 유착되어 있어서 췌두부를 절제하지 않고는 췌장공장문합술을 시행할 수가 없었다. 일반적으로 들창자증후군은 수술(surgical conversion)을 통하여 치료하지만 수술적 치료가 어려운 경우에는 경피적 배액술 또는 내시경적 카테터 삽입을 통하여 증상의 완화를 기대할 수 있다.
들창자증후군과 연관된 췌장염의 증례들을 정리하여 보면 표 1과 같다. 수술 후 유착 및 협착에 의한 증례들에서는 개복술 당시 수입각의 심한 협착이 확인되었다. 수술을 통하여 감압 및 새로운 문합술을 시행한 이후로는 추적 기간까지 추가적인 췌장염 재발은 없었다[5,6]. 전신 상태가 급격히 악화되지 않고 안정되어 있는 경우, 또는 수술을 견디기 어려운 경우에는 내과적 치료를 시도한 증례들도 있다. 8년 전 위암으로 위공장문합술을 시행한 73세 남자에서 원인 불명의 췌장염이 발생한 증례에서는 복부 단층촬영에서 수입각과 담관의 확장 소견이 동반되어 들창자증후군을 의심하였고, 내시경 소견에서 심한 수입각의 각형성이 확인되어 내시경을 이용하여 각형성을 풀어주었다. 진행성 위암으로 1년 전 위전절제술을 시행한 44세 남자에서 발생한 수입각의 각 형성에 의한 췌장염의 증례에서는 내시경 치료를 시도하였으나 각형성과 유착이 심하여 치료가 불가능하였다. 유착의 정도와 암의 재발 가능성을 고려하여 증상 완화 목적의 십이지장조루술(duodenostomy)을 시행하였다[3]. 의인성 장관 손상에 의하여 위공장문합술을 시행한 기왕력이 있는 45세 남자가 복통으로 내원하였고, 복부 단층촬영에서 들창자증후군과 연관된 췌장염으로 진단되었다. 내시경 문합부 직하방에 공장의 협착이 확인되었다. 3일째에는 복통이 심해지며 복막염 증상이 발생하여 개복술을 시행하였다. 수술장 소견을 확인하였을 때 수입각 일부가 수출각(efferent loop)의 후방으로 감돈되어 있었다. 이로 인하여 Treitz 인대 하방 5 cm부터 약 10 cm 가량의 수입각이 허혈로 괴사한 소견이 발견되었으며, 일부 천공이 동반되어 괴사된 소장을 절제하였다[4]. 위석에 의한 들창자증후군과 동반된 췌장염의 증례에서는 내시경을 통하여 위석의 제거를 먼저 시도하였으며, 환자의 생체증후가 불안정하여 응급 경피적담도배액술(percutaneous transhepatic biliary drainage, PTBD)을 추가로 시행하였다. 1주일 뒤 시행한 복부 단층촬영에서 위석의 소실, 수입각 확장이 정상화되어 수술 없이 PTBD 제거 후 퇴원하였다[7]. 들창자증후군 외에도 폐쇄 고리를 형성하여 십이지장 내압을 상승시키는 다른 경우에도 췌장염이 동반될 수 있다. 크론병의 십이지장 침범에 의한 십이지장 협착으로 20년 전 위공장문합술을 시행한 43세 남자에서 원인 불명의 췌장염이 두 차례 발생하여 MRCP를 시행하였다. 기존에 있던 십이지장 상행각(superior angle)의 협착 외에 하행각(inferior angle)에 새롭게 협착이 확인되었다. 췌관과 담관은 정상 소견을 보였다. 십이지장경 소견에서도 상행각 및 하행각의 협착을 확인할 수 있었고, 내시경적 풍선 확장술을 시행하였다. 이후 6년 동안의 추적 관찰 기간 동안 췌장염의 재발은 없었다[8].
본 증례의 환자는 40년 전 위공장문합술을 시행한 과거력이 있고, 이로 인한 십이지장 제3부의 협착이 상부위장관내시경 및 복부 CT에서 확인되었다. 췌장 주변 염증 침윤, 체액 저류가 뚜렷하게 보였다(Fig. 1A). 자가면역 췌장염의 경우는 췌장의 전반적 종대가 있지만 주변 조직으로의 염증 침윤은 동반되지 않거나 있어도 경도로 확인되며, 대부분에서 주췌관 전반의 불규칙한 협착을 보이고 췌액 저류는 드물다. 이번 증례는 수술 이후 발생한 심한 유착으로 인한 십이지장 협착이 들창자증후군을 일으켰고, 이와 동반하여 반복적인 췌장염이 발생한 것으로 진단한 경우이다. 본 증례에서는 총담관이 결찰되어 있고, 담낭공장문합이 시행된 상태여서 담즙의 역류로 췌장염이 유발되었을 가능성보다는 십이지장 내강 압력 상승에 의한 주 췌관의 압력 상승과 장 내용물의 역류가 췌장염 발생에 직접적인 원인으로 작용한 것으로 생각된다. 췌장염 증상이 호전되었을 때 시행한 복부 CT 소견을 보면 십이지장 확장 정도가 감소하고, 췌장의 염증이 호전된 소견을 보였다(Fig. 2B). 그러나 임상적으로 췌장염이 발생하였을 당시에는 십이지장 제2부의 확장이 저명하면서 췌장의 염증과 부종 또한 악화되었다(Fig. 2A). 또한 십이지장 확장이 악화된 경우 이전보다 주 췌관이 확장되어 보이는데(Fig. 1A), 이는 내강 압력 상승에 의하여 2차적으로 주 췌관 압력이 상승하였음을 시사한다. 무엇보다도 수술을 통하여 협착 부위를 절제하였고, 췌관 문합 및 췌액 배액 수술 후 4년의 추적 관찰 시 췌장염의 발생이 없는 것이 확실한 원인 진단의 증거로 생각된다. 다만, 최종 조직 검사 결과에서 제2형 자가면역 췌장염에 특이적으로 알려진 췌관 내 호중구 침윤이 확인되었다.
자가면역 췌장염(AIP)은 크게 제1형(lymphoplasmacytic sclerosing pancreatitis, LPSP)과 제2형(IDCP)으로 나눌 수 있다. 제1형의 가장 흔한 증상은 통증을 동반하지 않은 폐쇄성 황달인 반면에 제2형은 급성 재발성 췌장염이다. 제1형은 면역글로불린 G (immunoglobulin G, IgG)의 아형인 IgG4가 발생 기전에 관련되어 있으며 췌장 이외의 타 기관(침샘, 후복막, 신장, 담관) 침범이 흔하다. 반면에 제2형 AIP는 IgG4와 연관이 없고, 염증성 장질환 이외의 타 기관 침범이 드물다고 알려져 있다. 제2형 자가면역 췌장염의 확진을 위해서는 췌장 조직 소견이 반드시 뒷받침되어야 한다[9]. 이 중 진단적 가치가 있다고 알려진 소견은 췌관 상피세포와 췌관 내강으로 침윤하는 호중구, 소위 췌관 내 호중구 침윤(GEL)을 관찰하는 것이다. 실제로 저자들이 근무하는 병원의 병리 전문의사의 췌장 조직 판독 결과는 제2형 자가면역 췌장염이었다. 본 증례를 통하여 비록 췌장 조직 소견에서 GEL이 관찰된다고 하더라도 제2형 AIP라고 속단하지 말고, 자세한 병력 청취를 포함하는 모든 임상 상황을 종합하여 진단을 내려야 한다는 교훈을 얻을 수 있었다.
급성 재발성 췌장염의 잘 알려진 원인으로는 알코올, 담석, 대사성(고중성지방혈증, 고칼슘혈증) 등의 원인이 있어 종양의 동반이 의심되지 않는 한 일반적으로 췌장 조직 검사를 시행하지 않는다. 따라서 제2형 AIP의 진단적 가치가 있다고 알려진 GEL이 다른 원인의 급성췌장염에서도 보일 가능성은 충분히 존재한다. 최근 일본에서 약물(azathioprine)에 의한 재발성 췌장염 환자(약물의 재투여로 췌장염 유발 확인)에서 췌장 생검 소견 상 GEL이 관찰되었다는 증례가 보고되었으며(Notohara K, Kurashiki Central Hospital, Personal communication 2017), 이는 GEL 소견이 제2형 AIP에서만 특별히 관찰되는 췌장 조직 소견이 아님을 뒷받침해준다. 제2형 AIP의 경우 재발성 급성췌장염으로 병원을 찾는 경우가 적지 않으므로 본 증례 환자의 경우, 자세한 병력 청취와 여러 차례 시행한 영상 소견을 증상과 연관 지어 종합적으로 판단하지 않았다면, 췌장 조직 소견인 췌관 내 호중구 침윤에 근거하여 제2형 AIP로 진단하고 도움이 되지 않는 스테로이드를 장기간 투여할 뻔하였다.
결론적으로 원인 불명의 재발성 췌장염 환자가 이전에 위공장문합술을 시행한 과거력이 있다면 들창자증후군 동반 여부를 확인해 보아야 한다. 다른 원인의 급성 췌장염과는 달리 들창자증후군과 연관된 췌장염의 가장 중요한 치료는 수입각 내부의 압력을 정상화시키는 것으로 들창자증후군을 유발한 원인과 진단 당시 환자의 상황을 종합하여 내과적 시술 또는 수술을 통하여 치료해볼 수 있다.