흡연을 하는 급성 심근경색증 환자에서 일년 후 사망 예측인자
Predictors of One-Year Mortality in Smokers with Acute Myocardial Infarction
Article information
Abstract
목적
흡연은 관상동맥 질환의 위험인자로 잘 알려져 있으며, 흡연을 하는 급성 심근경색증 환자에서 임상적 특성을 파악하고 일년 후 사망 예측인자를 파악하고자 하였다.
방법
2011년 11월부터 2015년 12월까지 KAMIR-NIH에 등록된 13,104예 중 흡연을 하는 5,110예(57.1 ± 11.6세, 남성 95%)를 대상으로 하였다. 그중 흡연자 중에서 생존한 급성 심근경색증 환자를 I군 4,844예(56.5 ± 11.3세, 남자 95.3%), 사망한 급성 심근경색증 환자를 II군 266예(68.9 ± 12.5세, 남자 88.3%)로 분류하여, 각 군 간의 임상적 특징과 관상동맥조영술 소견 및 1년 사망률과 관련된 사망 예측인자를 분석하였다.
결과
사망한 흡연자 그룹은 65세 이상의 고령자가 많았으며, 고혈압, 당뇨병의 유병률이 유의하게 높았다. II군은 흡연 기간과 흡연 갑년에서 I군에 비하여 유의하게 많았다. 다변량 분석 결과 1년 추적 관찰 기간 중 사망사건 발생의 독립적인 인자는 creatine 2 mg/dL 이상, 좌심실구혈률 40% 미만, Killip class II 이상의 높은 Killip class, 65세 이상 고령, 관상동맥중재술 후 TIMI flow II 이하의 낮은 TIMI flow였다.
결론
흡연을 하는 급성 심근경색증 환자에서 1년 후 유의한 사망 예측인자는 65세 이상의 고령, 신장 기능 장애, 좌심실구혈률 저하, 높은 Killip class, 관상동맥중재술 후 TIMI flow 2 이하였다.
Trans Abstract
Background/Aims
It is well known that smoking is associated with clinical outcomes in patients with acute myocardial infarction (AMI). In this study, we aimed to predict the one-year mortality in AMI patients that smoked.
Methods
Of the AMI patients who were enrolled in the Korean Acute Myocardial Infarction Registry-National Institutes of Health study, 5,110 were current smokers (57.1 ± 11.6 years, male 95%), and these patients were included in the present study. Patients were divided into two groups; group I (survival group, n = 4,844, 56.5 ± 11.3 years, male 95%) and group II (deceased group, n = 266, male 88%). Clinical characteristics, coronary angiographic findings, procedural characteristics, and independent factors related to one-year mortality were analyzed.
Results
In group II, the incidence of hypertension and diabetes were significantly higher than in group I, and the patients were significantly older. Patients with history of angina pectoris, myocardial infarction, and heart failure were significantly more common in group II than in group I. Smoking duration and pack-years of smoking were also significantly longer in group II than in group I. Multivariate analysis revealed that creatine > 2 mg/dL, left ventricular ejection fraction < 40%, Killip class ≥ II, age ≥ 65 years, and post-percutaneous coronary intervention thrombolysis in myocardial infarction (post-PCI TIMI) flow ≤ II were independent factors of mortality during the one-year follow-up.
Conclusions
The predictors of one-year mortality in AMI patients with smoking were renal and left ventricular dysfunction, high Killip class, old age, and low post-PCI TIMI flow.
서 론
흡연과 간접 흡연은 많은 질병으로 인한 이환율 및 사망률의 위험요인으로 광범위하게 알려져 있으며[1,2], 관상동맥질환의 위험요인일 뿐만 아니라[3,4] 공중보건학적으로 예방 가능한 요인으로 알려져 있다[5]. 한국인 급성 심근경색증 환자에 대한 등록연구사업인 Korea Acute Myocardial Infarction Registry (KAMIR)의 보고에 의하면 흡연이 우리나라 급성 심근경색증(acute myocardial infarction, AMI) 환자에서 중요한 위험인자 중 하나였다[6]. 흡연량과 흡연 기간은 흡연과 간접 흡연에서 심혈관질환 발생의 중대한 위험요인이다[7]. 흡연은 AMI의 위험요인에도 불구하고 역설적으로 경색 후 사망률이 낮았으며 “smoker’s paradox”로 알려져 있다[7]. 이러한 현상은 관상동맥중재술을 받은 AMI 환자에서 재관류 요법을 시행받은 많은 연구들에서 보고되었다[8-10]. 흡연자는 비흡연자에 비하여 평균 연령이 낮고, 다혈관 질환이 적고, 좌심실구혈률이 낮으며, 동반 질환이 적은 특성을 보였다[11]. 흡연을 하는 한국인 급성 심근경색증 환자에서 사망률에 영향을 미치는 요인을 파악하고자 하였다.
이 연구는 KAMIR-National Institutes of Health (KAMIR-NIH) [12]에 등록된 환자들 중에서 흡연자를 대상으로 생존군과 사망군으로 분류하여, 각 군 간의 임상적 특징과 관상동맥조영술 소견 및 1년 사망률과 관련된 사망 예측인자를 알아보고자 하였다.
대상 및 방법
연구 대상
2011년 11월부터 2015년 12월까지 KAMIR-NIH [12]에 등록된 13,104예 중 흡연을 하는 5,110예(57.1 ± 11.6세, 남성 95%)를 대상으로 하였다. 그중 흡연자 중에서 생존한 AMI 환자를 I군 4,844예(56.5 ± 11.3세, 남자 95.3%), 사망한 AMI 환자를 II군 266예(68.9 ± 12.5세, 남자 88.3%)로 분류하여, 각 군 간의 임상적 특징과 관상동맥 조영술 소견 및 1년 사망률과 관련된 사망 예측인자를 분석하였다.
연구 방법
대한심장학회 50주년 기념 연구사업으로 진행되고 있는 KAMIR의 환자정보기록을 이용하였다. KAMIR 연구는 전남대학병원 생명윤리위원회의 심의(CNUH 05-49)를 통과하여 모든 환자로부터 동의서를 취득한 후에 이루어졌다. 일반적 특성으로는 양 군(생존군, 사망군) 간의 연령, 성별, 체질량 지수(body mass index, BMI), Killip class, 흉통, 호흡곤란, 관상동맥 질환 위험인자로 알려진 고혈압, 당뇨병, 고지혈증, 가족력, 과거력, 흡연력 등의 위험요인 및 염증반응 지표인 white blood cell, 혈당, 심근효소 검사, C-reactive protein (hs-CRP), 지질지표 검사 등 임상적 특징과 관상동맥 조영술 소견 및 1년 사망률과 관련된 사망 예측인자를 분석하였다.
AMI의 정의는 troponin-I, T 혹은 creatine kinase-myocardial band (CK-MB)와 같은 심근효소의 상승과 더불어 허혈의 증상, 심전도에서 ST분절의 변화나 새로 발생한 좌각차단, T파 역위, 병적인 Q파가 관찰될 때, 그리고 영상학적으로 생존 심근의 감소가 새롭게 발견되거나 국소 벽 운동의 감소가 관찰되는 경우로 하였다[13].
과거력이 있는 환자는 협심증이나 심근경색증으로 진단을 받았거나, percutaneous coronary intervention (PCI) 혹은 coronary artery bypass graft를 받은 환자들로 하였다. 관상동맥 조영술에서 병변의 형태는 American College of Cardiology/ American Heart Association system을 사용하여 분류하였다[14]. 조영술에서 혈류의 흐름은 Thrombolysis In Myocardial Infarction (TIMI) flow를 이용하였으며, 원위부가 전혀 조영되지 않을 때를 0, 소량이 조영되나 원위부에 완전히 조영되지 않을 때를 I, 원위부가 완전히 조영되지만 혈류가 느린 경우를 II, 원위부까지 신속하고 완전하게 조영되고 wash out되는 경우를 III로 정의하였다[15]. 다혈관 질환(multi-vessel disease)은 2개 이상 혹은 좌주간지의 관상동맥에서 50% 이상의 협착이 있는 경우로 정의하였다. 적절한 약물 치료는 aspirin, clopidogrel, prasugrel, cilostazol, calcium channel blocker, beta blocker, statin, angiotensin-converting enzyme inhibitor (ACEI)/ angiotensin-receptor blocker (ARB), oral hypoglycemi agent 등을 입원 시 투여받은 것으로 정의하였다.
병원내 합병증은 심인성쇼크, 새로 발생한 심부전증, 빈맥성부정맥, 전도장애, 급성 신부전증, 폐혈증, 다기관 부전증 등의 발생으로 정의하였다. 사망은 심부전증, 다기관 부전증 등 모든 원인에 의한 사망으로 정의하였다. 모든 혈액 검사는 PCI 전의 검사 자료를 활용하였다. 1년 사망률과 관련된 사망 예측인자를 분석하였다.
통계 분석 방법
통계처리는 SPSS-PC version 19.0 (Statistical package for the Society Science, SPSS Inc, Chicago, IL, USA)을 이용하였다. 연속형 변수는 평균 ± 표준편차로 표시하였고, 범주형 변수는 빈도 및 백분율(%)로 기술하였다. 양 군(생존군, 사망군) 간의 비교에 있어 연속 변수에 대하여는 t-test를 이용하여 검정하였고, 범주형 변수에 대해서는 검사의 적절성을 고려하여 chi-square test 또는 Fisher’s exact test 값을 취하였다. 1년 사망률과 관련된 예측인자는 단변량 Cox regression 분석을 통해서 p값이 0.05 이하인 인자들을 다변량 Cox regression에 포함하여 분석하고 hazard ratio (HR)와 95% confidence interval (CI)를 함께 계산하였다. 모든 자료는 p-value가 0.05 이하일 때 유의한 것으로 간주하였다.
결 과
임상적 특성
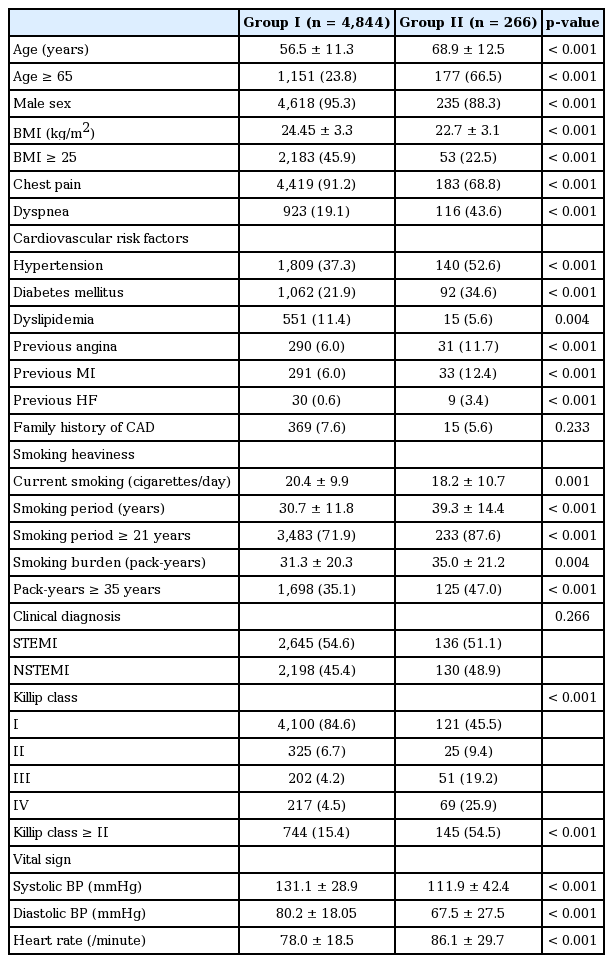
KAMIR-NIH에 등록된 총 5,110명의 흡연자를 대상으로 하였으며 평균 나이는 57.1 ± 11.6세, 남성이 95%였다. I군에 비하여 II군의 평균 연령이 높았으며, BMI는 II군에서 낮았다(p< 0.001). 내원시 증상으로 흉통은 I군에서 많았으나, 호흡곤란은 II군에서 유의하게 많았다(p< 0.001). 심혈관질환의 위험인자인 고혈압과 당뇨병의 유병률은 II군에서 유의하게 많았으나, 고지혈증은 I군에서 많았다. 과거력으로 협심증, 심근경색증, 심부전증 등을 가진 II군에서 I군과 비교하였을 때 유의하게 많았다(p< 0.001). 흡연 기간은 I군에 비하여 II군에서 유의한 차이를 보였다(30.7 ± 11.8 years vs. 39.3 ± 14.4 years, p< 0.001). 흡연 갑년에서도 I군에 비하여 II군에서 유의하게 많았다(31.3 ± 20.3 years vs. 35.0 ± 21.2 years, p= 0.004). Killip class에서 class II 이상은 I군에 비하여 II군에서 더 많았다(15.4% vs. 54.5%, p< 0.001). 생명 징후에서 혈압은 I군에 비하여 II군에서 낮았으나, 맥박은 I군에 비하여 II군에서 높았다(p< 0.001) (Table 1).
심초음파도 및 진단의학 검사 소견
좌심실구혈률은 II군에서 I군보다 유의하게 낮았다(52.9 ± 10.3% vs. 41.5 ± 13.9%, p< 0.001). 내원시 시행한 혈액 검사에서 백혈구, 혈당, 크레아틴, hs-CRP, 당화혈색소는 II군에서 I군보다 유의하게 높았다(p< 0.001). Hemoglobin은 II군에서 낮았다(p< 0.001). 심근효소 검사에서 peak troponin-I, peak CK-MB는 II군에서 높았으며, brain natriuretic peptide (BNP), N-terminal pro-brain natriuretic peptide의 혈중 농도는 I군에 비하여 II군에서 현저히 증가되어 있었다. 총콜레스테롤, 중성지방, 저밀도 및 고밀도 콜레스테롤 수치는 I군에 비하여 II군에서 낮았다(186.1 ± 45.9 mg/dL vs. 166.5 ± 55.8 mg/dL, p< 0.001; 158.6 ± 150.0 mg/dL vs. 122.8 ± 124.4 mg/dL, p= 0.001; 118.3 ± 39.6 mg/dL vs. 102.5 ± 44.0 mg/dL, p< 0.001; 41.6 ± 11.1 mg/dL vs. 39.1 ± 13.8 mg/dL, p= 0.002). Aspirin reaction unit, P2Y12 reaction unit 값은 II군에서 I군에 비하여 유의하게 높았다(Table 2).
입원시 처방 약물
입원시 처방한 약제에서 aspirin, prasugrel, ticagrelor, beta blocker, statin, ACEI, ARB, oral hypoglycemic agent는 I군에서 유의하게 많이 사용하였다. 이와 반대로 clopidogrel, cilostazol는 II군에서 I군에 비하여 더 많이 사용하였다(Table 3).
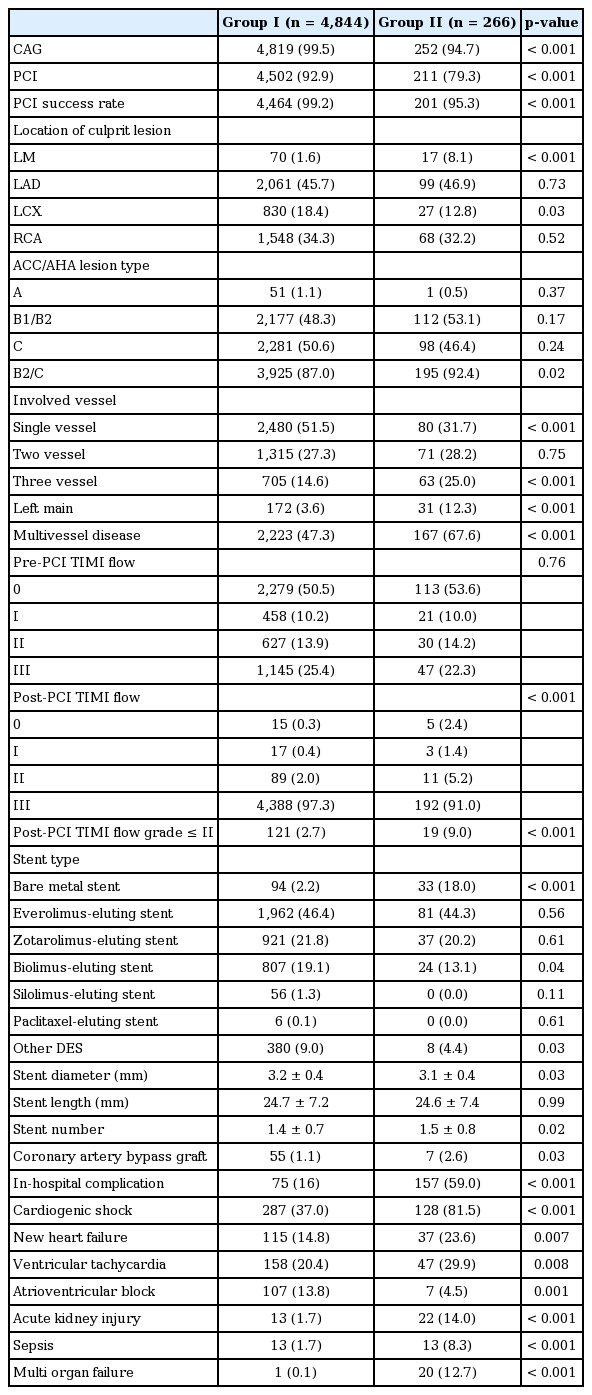
관상동맥 조영술 및 중재술의 특징
관상동맥중재술(percutaneous coronary intervention, PCI) 시행 빈도는 II군에서 유의하게 낮았으며(p< 0.001), PCI의 성공률은 II군이 I군에 비하여 낮았다(99.2% vs. 95.3%, p< 0.001). PCI의 표적 병변혈관에서 좌전하행지, 우관상동맥에 두 군 간에 차이를 보이지는 않았으나, 좌주간지는 I군보다 II군에서 현저히 많았다(1.6% vs. 8.1%, p< 0.001). 관상동맥조영술에서 복잡 병변인 B2/C 형태는 II군에서 I군보다 많았으며(87.0% vs. 92.4%, p= 0.02) II군에서 I군보다 다혈관 질환이 유의하게 많았다(47.3% vs. 67.6%, p< 0.001). PCI 시술 후 TIMI flow ≤ II는 II군에서 유의하게 높게 관찰되었다(2.7% vs. 9.0%, p< 0.001). PCI 시술 시에 사용한 bare metal stent 시술은 II군에서 I군보다 많았다(2.2% vs. 18.0%, p< 0.001). PCI 시술 시에 사용한 stent 내경은 II군에서 I군보다 작았으며, stent 삽입 개수는 II군에서 I군보다 많았다. 입원기간 중 관상동맥 우회술의 시행 빈도는 II군에서 I군보다 높았다(1.1% vs. 2.6%, p< 0.03). 병원내 합병증 발생률은 II군에서 I군에 비하여 유의하게 높았다(16.0% vs. 59.0%, p< 0.001) (Table 4).
사망 예측인자
1년 추적 관찰 기간 중 사망률에 영향을 주는 독립적인 인자는 단변량 콕스 회귀분석 결과 creatine 수치 2 mg/dL 이상, 40% 미만의 좌심실구혈률, Killip class II 이상, 65세 이상의 고령, 기존의 심부전증, 관상동맥중재술 후 TIMI flow II 이하, 21년 이상 흡연, 다혈관 질환, 심근경색증 과거력, 35갑년 이상의 흡연력 등이었다(p< 0.001). 다변량 콕스 회귀분석 결과 1년 추적 관찰 기간 중 사망사건 발생의 독립적인 인자는 creatine 수치 2 mg/dL 이상(HR 2.80, 95% CI 1.63-4.81, p< 0.001), 40% 미만의 좌심실구혈률(HR 3.08, 95% CI 2.14-4.42, p< 0.001), Killip class II 이상(HR 2.39, 95% CI 1.67-3.40, p< 0.001), 65세 이상의 고령(HR 3.84, 95% CI 2.68-5.50, p< 0.001), 관상동맥중재술 후 TIMI flow II 이하(HR 1.99, 95% CI 1.03-3.81, p= 0.03)였다(Table 5).
고 찰
이 연구는 한국인 급성 심근경색증 등록 연구(KAMIR-NIH)에 등록된 급성 심근경색증(AMI) 환자 중 흡연자를 대상으로 생존군과 사망군으로 분류하여, 각 군 간의 임상적 특징과 관상동맥 조영술 소견 및 1년 사망률과 관련된 사망 예측인자를 파악하여 흡연을 하는 AMI 환자의 관리를 위한 기초 자료를 제공하고자 진행되었다. 그 결과 흡연을 하는 AMI 환자에서 일년 후 유의한 사망 예측인자는 65세 이상의 고령, 신장 기능 장애, 좌심실구혈률 저하, 높은 Killip class, 관상동맥중재술 후 TIMI flow 2 이하로 파악되었다. 이 결과는 한국인 심근경색증 환자의 일년 후 사망에 영향을 미치는 인자는 75세 이상의 고령, 입원 기간 중에 지속되는 심실성 빈맥증, 좌심실 부전증, 다혈관질환 등이었다는 연구와 비슷하지만 약간의 차이를 보였으며[16], 65세 이상의 고령 환자에서 일년 사망률에 영향을 미치는 독립적인 인자는 내원시 혈중 creatinine 1.3 mg/dL 이상, 뇌혈관질환, 수축기혈압 < 100 mmHg, Killip class 2 이상, 다혈관질환 그리고 좌심실구혈률 40% 미만으로 이 연구와 약간의 차이를 보였다[17].
최근 우리나라 사망 원인 통계에 의하면 심혈관질환으로 인한 사망이 전체 사망의 2위를 차지하고 있으며, 심장질환으로 인한 사망률이 인구 십만 명당 2004년 36.7명, 2014년 52.4명으로 지속적으로 증가해왔다[18]. 관상동맥질환의 위험인자로는 흡연, 고혈압, 당뇨병, 이상지질혈증 등 여러 가지 요인이 있으며, 이러한 위험인자를 조절하는 것이 관상동맥질환의 예방과 치료에 필수적이다. 한국인 AMI 환자에 대한 등록연구사업인 KAMIR의 보고에 의하면 흡연이 우리나라 급성 심근경색증 환자에서 중요한 위험인자 중 하나이며 흡연율은 줄어들고는 있으나 여전히 높은 흡연율을 보였다[19]. 고령의 AMI 환자는 고혈압, 당뇨병, 울혈성심부전증, 진구성 심근경색증, 말초혈관 질환, 뇌경색증 등이 관상동맥 질환의 위험인자이고, 젊은 AMI 환자는 고지혈증, 가족력, 흡연력 등이 심질환 발생과 관련이 있으나 사망률을 증가시키지는 않는다고 하였다[20]. 비흡연자에서 흡연자에 비하여 고혈압, 당뇨병, 과거력으로 심근경색증이나 심부전증을 가진 환자가 적었으나[21], 이 연구에서 고혈압, 당뇨병, 과거력으로 협심증, 심근경색증, 심부전증을 가진 환자는 I군에 비하여 II군에서 유의하게 높았으나, 1년 사망률 예측을 위한 독립적인 인자는 아니었다.
흡연자의 평균 연령은 비흡연자에 비하여 10년 정도 낮았으며, 남성의 비율은 70% 이상이었다[11,22,23]. 이 연구에서 흡연자는 평균 나이 57.1 ± 11.6세로 다른 연구와 비슷한 결과를 보였으나, 남성의 비율은 95% 정도로 서양에 비하여 높은 흡연율을 보였다. 흡연자 중 사망한 II군의 평균 나이는 68.9 ± 12.5세로서 65세 이상의 고령의 환자 비율이 높았으며, 1년 사망률 예측의 독립적인 인자였다. 고령의 환자는 기저 질환의 동반, 심한 관상동맥질환, 심장 기능 및 전반적인 생리적 기능의 저하로 고령 자체가 사망률의 증가와 관계가 있으며, AMI 환자에서 30%가 높은 조기 사망을 보이며[24], 다혈관 질환과 복잡 병변이 많아 예후가 좋지 않다고 하였다.
Kodaira 등[21]은 흡연자에서 비흡연자와 비교하였을 때에 다혈관 질환과 복잡 병변은 유의한 차이가 없다고 하였으나, 이 연구에서는 다혈관 질환과 복잡 병변은 I군에 비하여 II군에서 유의하게 많았고 1년 사망률 예측을 위한 독립적인 인자는 아니었다.
Kim 등[25]은 AMI 환자에서 흡연량은 평균 24.4 pack year였으며 흡연량이 많을수록 생존율이 높았다고 하였다. 이 연구에서는 흡연 기간은 I군에 비하여 II군에서 유의하게 길었고 흡연 갑년에서도 I군에 비하여 II군에서 유의하게 많았지만, 흡연 기간 및 흡연 갑년이 1년 사망률 예측을 위한 독립적인 인자는 아니었다. 흡연은 급성 심근경색증의 위험 요인에도 불구하고 역설적으로 경색 후 사망률이 낮았으며 “smoker’s paradox”로 알려져 있다[7,23,26].
AMI 환자에서 추정된 사구체여과율은 단기 및 장기 예후와 연관이 있으며[27,28], 신기능이 나쁠수록 적절한 약물 치료나 PCI 시술이 잘 이루어지지 않는다[29]. 이 연구에서 creatine 수치는 I군에 비하여 II군에서 유의하게 높았으며, creatine 수치 2 mg/dL 이상은 1년 사망률 예측을 위한 독립적인 인자였다.
좌심실의 수축기 기능을 반영하는 좌심실구혈률은 40% 미만일 경우 좌심실수축부전으로 정의하고[30], AMI환자에서 40% 미만의 좌심실구혈률의 저하는 급성기 및 장기 예후 예측에 중요함을 설명하였다[31]. 이 연구에서도 좌심실구혈률은 I군에 비하여 II군에서 유의하게 낮았으며, 1년 사망률 예측을 위한 독립적인 인자이었다.
Killip class는 이전 연구들에서 흡연자와 비흡연자 사이에 유의한 차이가 없다는 보고가 많았으나[11,26], 이 연구에서는 Killip class II 이상은 I군에 비하여 II군에서 유의하게 많았으며 1년 사망률 예측을 위한 독립적인 인자였다.
심근경색증으로 인한 미세 혈관 손상과 재관류 손상으로 인한 심근 관류의 저하는 결국 심근내 혈류량의 감소와 함께 미세혈관내 저항의 증가로 혈류의 흐름을 방해하여 심근세포의 괴사를 더욱 촉진하게 된다[32]. 이 연구에서는 관상동맥중재술 후 TIMI flow II 이하는 I군에 비하여 여군에서 유의하게 많았으며, 다변량 분석 결과 1년 사망률 예측을 위한 독립적인 인자였다. TIMI flow가 낮은 군에서 사망률이 높다고 알려져 있으며 심근경색 부위의 크기가 증가되고 낮은 TIMI flow는 심근의 구제가 덜 될 것이고 높은 사망률과 관련이 된다.
이 연구의 제한점은 흡연을 하는 AMI 환자를 대상으로 전향적 등록 연구였으며 몇 가지 주요한 제한점이 있었다. 첫째, 대상자가 흡연자 중에서 생존한 AMI군 4,844예와 사망한 AMI군 266예로서 환자 수에서 불균형인 점, 둘째, 흡연력은 환자에 의하여 자가 보고되었다는 점, 셋째, 등록된 자료를 분석함으로써 흡연 습관과 흡연 기간이 정확한 방식으로 획득하지 못하였다는 것이다. 따라서 추후 장기적 추적 관찰 연구가 필요할 것으로 생각되었다.
결론적으로 KAMIR-NIH에 등록된 흡연을 하는 AMI 환자에서 일년 후 유의한 사망 예측인자는 65세 이상의 고령, 신장 기능 장애, 좌심실구혈률 저하, 높은 Killip class, 관상동맥중재술 후 TIMI flow 2 이하였다. 향후 지속적인 AMI 환자 등록을 통하여 더 많은 환자를 대상으로 연구한다면, 더욱 의미 있는 연구 결과가 나올 것으로 기대된다.