Omalizumab 투여로 호전된 반복적 아나필락시스를 보인 전신 비만세포증 1예
Successful Remission of Recurrent Anaphylaxis after Omalizumab Administration in a Patient with Systemic Mastocytosis
Article information
Abstract
저자들은 빈번한 아나필락시스를 보이는 환자에서 비활동성 비만세포증을 확진하였으며, omalizumab으로 효과적으로 치료하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Mastocytosis is a disorder characterized by abnormal mast cell proliferation and accumulation in one or more tissues. It presents in two major variants: cutaneous mastocytosis and systemic mastocytosis. Because the symptoms are related to mast cells, histamine receptor antagonists and leukotriene receptor antagonists are recommended as therapeutic options. Here, we report a 54-year-old male patient with a history of urticaria pigmentosa who presented with recurrent anaphylaxis. His serum tryptase level was 31.7 ng/mL and mast cell infiltration was observed in his bone marrow. He had frequent attacks of anaphylaxis despite treatment with ketotifen, levocetirizine, and montelukast. Symptoms related to systemic mastocytosis were controlled and the patient exhibited no recurrence of anaphylaxis following the introduction of monthly omalizumab injection. Omalizumab can be considered as a treatment option in patients with systemic mastocytosis unresponsive to conventional oral medications.
서 론
비만세포증(mastocytosis)은 피부를 비롯한 여러 장기에서 비만세포의 비정상적인 증식을 보이는 질환으로 십만 명당 3-13명 정도 발견되는 드문 질병이다[1]. 모든 인종에서 보고되고 있지만 백인에서 보다 많이 보고되고 있다. 우리나라의 경우 일부 증례보고가 있으나 정확한 유병률은 알려져 있지 않다.
비만세포증의 정확한 발생기전은 알려져 있지 않으며, 보통 주로 피부에 국한된 피부 비만세포증(cutaneous mastocytosis)과 피부 외 하나 이상의 장기를 침범하는 전신 비만세포증(systemic mastocytosis)으로 분류한다. 전신 비만세포증은 임상 경과에 따라 서서히 진행하는 비활동성 전신 비만세포증(indolent systemic mastocytosis), 혈액계 신생물과 관련된 전신 비만세포증(systemic mastocytosis with associated hematologic neoplasm), 공격성 전신 비만세포증(aggressive systemic mastocytosis), 비만세포 백혈병(mast cell leukemia)으로 분류된다[2].
전신 비만세포증은 아직까지 완치법이 알려져 있지 않아 대증 치료를 기반으로 하는데, 비만세포를 활성화시키는 상황을 피하고, 히스타민수용체 길항제, 크로몰린, 항류코트리엔제 등을 단독 혹은 병용 투여하여 비만세포 활성화 산물에 의한 증상을 조절한다. 전신 비만세포증의 경우 비만세포 활성화에 따른 알레르기 증상이 나타날 수 있는데, 아나필락시스로 나타날 수 있으므로 이에 대비하여 휴대용 에피네프린을 지참하도록 교육해야 한다[3].
국내에서는 피부 비만세포증 및 공격성 전신 비만세포증은 보고되었던 바 있으나, 비활동성 전신 비만세포증은 아직 보고된 적이 없다[4-6]. 저자들은 반복적인 아나필락시스로 나타난 비활동성 전신 비만세포증을 한국인에서 최초로 확인하였으며 치료를 위해 경구 항히스타민제, 항류코트린엔제와 휴대 에피네프린을 처방하였으나 반복적으로 아나필락시스를 보여 omalizumab을 투여하였고 아나필락시스 발생을 효과적으로 예방한 사례를 경험하였기에, 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 54세 남성
주 소: 복통 및 의식저하
현병력: 집에서 갑작스런 복통과 함께 변의를 느껴 화장실에 가던 중 의식저하를 보여 응급실로 이송되었다. 도착 당시 아나필락시스로 진단하고 급속 수액 공급과 함께 에피네프린 0.3 mg을 근주하였으나 혈압이 정상화되지 않아, 에피네프린 0.3 mg을 추가로 근주하고 생리식염수 2.8 L를 급속 주입하면서 혈압 및 의식이 회복되어 3일 후 퇴원하였다.
과거력: 13년 전 목에 발생한 다수의 반점에 대해 색소성 두드러기(urticaria pigmentosa)로 진단받았으나 별다른 증상이 없어 치료를 하지 않았다. 5개월 전 벌에 쏘인 후 실신하였던 적이 있다.
가족력 및 사회력: 알레르기 질환 가족력은 없었고, 음주 및 흡연력도 없었다.
진찰 소견: 응급실 도착 당시 혈압 82/26 mmHg, 맥박 73회/분, 호흡수 18회/분, 체온 35.6℃였으며 급성 병색을 보였고, 의식상태는 부르면 대답하는 정도였다. 호흡음은 명료하였으며 복부는 부드러웠고 하지 부종은 관찰되지 않았다. 목에 다수의 갈색 반점이 관찰되었으나 다리에 징후(Darier’s sign)는 나타나지 않았다.
검사실 소견: 말초혈액 검사에서 백혈구 6,550/mm3, 혈색소 13.6 g/dL, 혈소판 223,000/mm3, 알칼리인산분해효소 67 IU/L, 아스파르테이트 아미노전이효소/알라닌 아미노전이효소 15/13 IU/L, 칼륨 3.3 mmol/L였다. 혈청 트립신분해효소(tryptase)는 31.7 ng/mL (정상치 < 11.0 ng/mL)로 증가 소견을 보였다. 갑상선기능검사, 부신피질자극호르몬 검사에서 특이 소견은 없었고, 심장초음파 검사에서 정상 심장 기능이 확인되었다. 벌독 알레르기 확인을 위해 시행한 혈청 특이 IgE 검사에서 꿀벌, 호박벌, 말벌에 대해 양성 반응을 보였으며(Table 1), 이 밖에 다양한 알레르겐에 대한 특이 IgE 항체 양성 반응을 나타내었다(Table 2).

Multiple Allergen Simultaneous Test® (MAST®) results for serum specific immunoglobulin E to common allergens
골수 검사 및 조직면역화학 검사: 피부 조직검사에서 혈관 주위에 경도의 림프구와 호산구 침윤이 관찰되었으며, CD117 양성인 비만세포가 관찰되었다. 골수 흡인 검사에서 비만세포가 1.4%로 증가해 있었다. 골수 조직 검사에서 악성 소견은 확인되지 않았으며 다세포성 비만세포 군집이 확인되었고, 면역 화학검사에서 CD25, CD117 양성으로 전신 비만세포증에 합당한 소견을 나타내었다(Fig. 1). KIT 유전자 exon 9, 11, 13, 17에서 의미 있는 돌연변이는 검출되지 않았다.
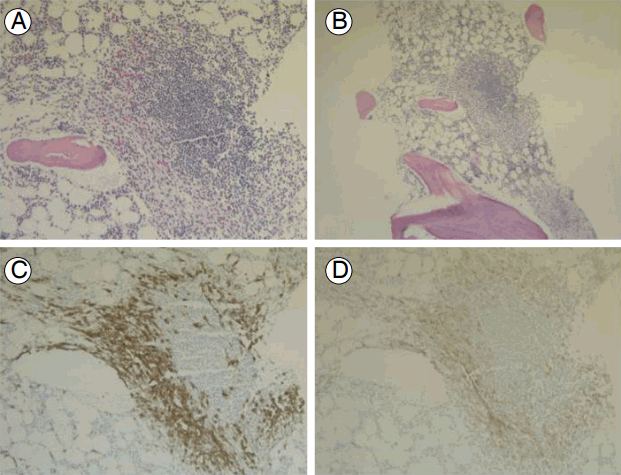
Histological findings on bone marrow sections. Multifocal, sharply demarcated infiltrates consisting of a central core of lymphocytes surrounded by mast cells were observed. (A) Hematoxylin and eosin staining, ×200. (B) Hematoxylin and eosin staining, ×100. (C) Infiltration of spindle-shaped CD25+ mast cells (immunohistochemical staining for CD25, ×200). (D) Infiltration of mast cells with CD117 positivity (immunohistochemical staining for CD117, ×200).
치료 및 경과: 색소성 두드러기에서 서서히 이행된 전신 비만세포증으로 진단하고 휴대용 에피네프린, ketotifen 1.38 mg 1일 2회, levocetirizine 5 mg 1일 1회, ranitidine 150 mg 1일 2회 경구 복용을 시작하였다. 이후 3개월 동안 별다른 증상을 보이지 않아 ketotifen 1.38 mg 단독으로 줄였으나 한 달후 벌에 쏘인 후 심한 어지러움 발생하여 응급실을 방문하였다. 이후 다시 ketotifen, levocetirizine, ranitidine을 유지하였나, 의식소실을 동반한 아나필락시스를 반복적으로 경험하여 항류코트리엔제(montelukast 10 mg 1일 1회)를 추가하였다. 그러나 이후에도 두 차례 더 아나필락시스가 발생하여 4개월간 네 차례 아나필락시스성 쇼크를 경험하였다. 아나필락시스 발생 전 사과, 돈가스, 성분 미상의 감기약 등을 먹은 병력이 있으나, 별다른 유발인자 없이 증상이 발생한 적도 있었다. 평상시 밀가루 음식을 섭취하였을 때 별다른 증상은 없었다. 아나필락시스 발생 횟수가 증가하여 전신 비만세포증의 아형이 비활동성에서 공격성으로 이행되었을 가능성 고려하여 골수검사를 재시행하였으나 악성을 시사하는 소견은 관찰되지 않았다.
혈중 트립신분해효소 수치는 이후 증상이 없는 상태에서 시행한 추적 검사에서도 33.7 ng/mL로 지속적으로 증가되어 있었으며 항히스타민제, 루코트리엔수용체 길항체 투여에도 불구하고 생명을 위협하는 아나필락시스성 쇼크가 반복적으로 발생하여, 증상 예방을 위해 omalizumab 투여를 결정하였다. 이후 omalizumab 150 mg을 월 1회 투약하면서 12개월째 아나필락시스를 포함한 비만세포 관련 증상 없이 양호한 경과를 보이고 있다.
고 찰
비만세포는 주로 점막에 위치하는 면역 세포로, 한 가지 이상의 조직에 과도한 비만세포가 축적되는 비만세포증은 어린이들에게서는 주로 피부에 국한되어 나타나고 청소년기에 접어들면 저절로 소실되지만, 성인의 경우 전신으로 발현되어 평생 지속되는 경우가 많다[7].
전신 비만세포증은 가려움증, 구토, 설사, 복통 및 저혈압을 유발할 수 있으나, 비특이적 증상을 나타내므로 진단이 쉽지 않아 보통 증상 발생 후 진단이 되기까지 10년 이상 소요된다[8,9]. 피부를 비롯하여 위장관, 림프절, 간, 비장, 골수 및 골격계가 증상 발생과 관련되어 있다. 피부 병변은 다양한 형태로 나타날 수 있는데, 색소성 두드러기는 비활동성 전신 비만세포증의 90%에서 관찰된다. 색소성 두드러기는 작고 햇빛에 그을린 듯한 갈색 반점이나 구진으로 나타나는데 압력을 가해 문지를 경우 병변 주위에 두드러기와 홍반이 발생하는 다리에 징후를 보이는 것이 특징적이다. 이 밖에 골격계 침범으로 인한 전신 통증이나 주의력 감소, 기억력 장애, 짜증(irritability) 등 신경정신 증상으로 나타나기도 한다. 간과 비장은 흔히 침범하나 호흡기나 내분비계 장기, 신장 침범은 상대적으로 드물다.
전신 비만세포증 환자들은 알코올, 아스피린, 곤충 자상, 감염 또는 요오드화 조영제에 노출되면 저혈압을 보일 수 있으므로 주의를 요한다[3]. 그러나 세균, 곰팡이, 바이러스 감염위험은 증가하지 않는다.
비만세포증의 발생은 전암유전자(proto-oncogene)로 비만세포 수용체인 KIT (CD117)의 변이와 관련이 있는데, 소아의 경우에는 다양한 KIT 변이가 보고되었으나 성인 전신 비만세포증 환자에서는 대부분 c-kit 유전자의 exon 17번의 점돌연변이(point mutation, D816V)의 유전변형을 보이며, 최근에는 RAS 변이도 보고된 바가 있다[6].
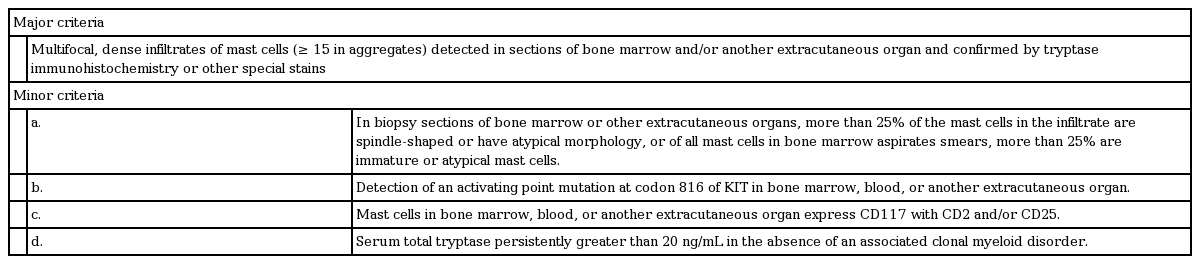
전신 비만세포증은 WHO 진단기준의 주진단 1개, 부진단 1개 이상에 합당하거나, 부진단 3개 이상에 합당한 경우에 진단이 가능하다(Table 3). 피부 병변에서 조직학적으로 비만세포증이 확인되면 골수검사를 하여 전신 비만세포증을 감별해야 하며, 피부 병변이 없더라도 비만세포 관련 증상이 뚜렷하게 있는 경우 혈청 트립신분해효소 수치를 우선 확인하여 전신 비만세포증의 가능성을 평가해야 한다. 말초혈액에서의 KIT D816V를 확인하는 것도 전신 비만세포증의 진단에 도움이 되며, 골수 절편에서 CD117, CD25를 발현하는 비만세포 군집이 확인되면 진단이 가능하다[10]. 본 증례는 반복된 비만세포 관련 증상을 경험한 환자에서 기저 트립신분해효소 수치의 상승과 골수에서 비만세포 군집이 확인되어 전신 비만세포증으로 확진하였다.
최근 벌독(hymenoptera)에 대한 전신 과민반응과 비만세포증의 관련성에 대한 연구 결과들이 보고되고 있다. 벌독 알레르기는 벌독 항원에 대한 특이 IgE 형성 결과 나타나는 전형적인 I형 과민반응으로 알려져 있으나, 전신 비만세포증 환자의 경우 정상인보다 벌독 알레르기의 빈도가 높은 것으로 알려져 있어 벌독에 의한 반복적인 아나필락시스를 보이는 경우 비만세포증 동반 여부를 감별해야 한다. 379명의 벌독에 대한 전신반응 환자를 대상으로 한 연구에서 11.6%가 혈청 트립신분해효소 기저치의 증가 소견을 보였으며, 이 중 65%에서 비만세포의 골수 침입이 관찰되었고, 54.8%에서 KIT 돌연변이가 확인된 바 있다[3]. 피부증상이 없고 혈청 트립신분해효소 기저치가 정상이었던 벌독 아나필락시스성 쇼크 환자 22명을 대상으로 한 연구에서는 77.3%가 골수에서 비만세포증에 합당한 소견을 보였음이 보고된 바 있다[11]. 본 증례의 환자 또한 반복적으로 벌독에 의한 과민반응을 보인 바 있으며, 혈청에서 벌독 특이 IgE가 확인되었다(Table 1). 벌독 아나필락시스 환자의 경우 재발 예방을 위해 벌독 면역 치료를 적극적으로 고려해보아야 한다. 그러나 본 증례와 같이 반복적인 벌독 아나필락시스를 보이는 경우 기저 질환으로 전신 비만세포증이 있는지 의심해보아야 하겠다.
전신 비만세포증은 다양한 혈액암과 감별진단이 필요한데, 말초혈액에서 혈구감소(cytopenia)와 트립신분해효소 수치의 상승이 함께 확인될 경우 골수형성이상증후군(myelodysplastic syndrome), 급성골수성 백혈병(acute myeloid leukemia), 일차성 골수섬유증(primary myelofibrosis) 등의 악성 혈액 질환의 가능성을 고려해야 하며, 호산구증가증이 동반될 경우에는 만성호산구성 백혈병(chronic eosinophilic leukemia)을 감별해야 한다[12]. 서서히 진행하는 비활동성 전신 비만세포증은 빠른 진행을 보이는 공격성 전신 비만세포증으로 이행할 가능성이 있다[7]. 골격계 침범 소견은 피부외 장기 침범 중에서 가장 흔하게 관찰되는데 골수 침범이 가장 많으며 주요 침범 부위는 늑골, 골반, 대퇴골, 상완골 그리고 두개골이다. 흔한 골격계 이상은 비만세포에서 분비하는 물질에 의한 골다공증(osteoporosis) 병변이며 골경화성(osteosclerosis)병변도 관찰될 수 있어 매년 정기적인 골밀도 검사를 권고한다.
전신 비만세포증으로 진단된 환자일지라도 수년간 무증상인 환자들도 다수 있다. 히스타민 관련 증상이 있을 경우 H1 수용체 길항제를 투여해볼 수 있다. 장기간 써야 하므로 졸림이 없는 2세대 항히스타민제를 유지 요법으로 선호한다. 위장관 증상이 있는 경우 H2 수용체 길항제인 ranitidine, cimetidine, famotidine 등을 써볼 수 있다. 또한 항류코트리엔제인 montelukast도 항히스타민제에 추가해볼 수 있다. 이 밖에 FcεRI의 교차 결합(cross-linking)을 막아 비만세포의 활성화를 억제하는 cromoglycate가 주요 치료제로 추천되지만[10] 국내에서는 처방이 불가능하며, 대신 1세대 항히스타민제 중 비만세포 안정화 효과를 가진 ketotifen을 써볼 수 있다.
본 증례에서 ketotifen, levocetirizine, montelukast를 비롯하여 휴대용 에피네프린 펜을 처방하였음에도 불구하고 생명을 위협하는 아나필락시스가 4개월 동안 네 차례나 반복적으로 발생하여 추가 치료로 omalizumab을 투약하게 되었다. Omalizumab은 인간 IgE에 선택적으로 결합하는 단클론성 항체로 알레르기천식 치료제로 승인된 약물이며, 비만세포와 호염기구에서의 FCεRI의 발현을 줄이기도 한다[13]. 따라서 omalizumab은 비만세포의 활성을 줄이며, 히스타민 분비를 줄여 만성 두드러기 치료에 활용이 되고 있다. 장기 침범을 보이며 KIT-D816V (Exon17) mutation이 없는 공격성 전신 비만세포증의 경우, imatinib과 같은 티로신인산화효소 억제제(tyrosine kinase inhibitor) 혹은 세포감소 치료제(cytoreductive agent) 투약을 고려해 볼 수 있으나[14] 본 증례와 같은 비활동성 전신 비만세포증의 경우 급격한 경과를 보이지 않기 때문에 이러한 치료제들보다는 omalizumab으로 알레르기 증상을 조절하는 치료를 우선적으로 고려해볼 수 있겠다.
전신 비만세포증 환자에서 omalizumab의 치료 효과는 잘 알려져 있지 않으나 반복적인 아나필락시스성 쇼크가 발생한 비만세포 활성화 증후군(mast cell activation syndrome) 환자에서 omalizumab 치료 후 완전 관해된 증례가 보고된 바 있으며[13], 본 증례 환자 역시 omalizumab 투약 후 아나필락시스를 더 이상 경험하지 않았다. Omalizumab은 현재 전신 비만세포증에 승인된 치료법은 아니지만, 본 증례를 비롯하여 omalizumab 투약으로 증상 조절된 다수의 증례들이 보고된 바 있어 cromoglycate나 항히스타민제로 조절되지 않는 전신 비만세포증의 경우 치료 약제로 omalizumab을 고려해 볼 수 있겠다.