동종 말초혈 줄기세포 이식 이후 만성 이식편대숙주병으로 나타난 막성 신장병
Allogenic Peripheral Blood Stem Cell Transplant-Induced Membranous Glomerulonephropathy as Chronic Graft-Versus-Host Disease
Article information
Abstract
본 증례는 cGVHD가 있는 환자에서 발생하는 신부전증과는 다르게 acute GVHD로 면역억제제를 투여하고 있는 도중 다른 증상 없이 신증후군 수준의 단백뇨가 발생되어 신조직 검사 후 막성 신장병이 진단되었고, 이후 효과적으로 치료된 결과를 문헌고찰과 함께 보고하는 바이다. 이를 통해 allo-PBSCT 시행한 뒤 증상 없이 단백뇨가 발생한 환자에게는 cGVHD로 유발되는 사구체 질환을 감별 진단에 두고 검사 및 치료를 고려하여야 하겠다.
Trans Abstract
Heavy proteinuria in the nephrotic range is an uncommon, often unrecognized manifestation of graft-versus-host disease (GVHD) following hematopoietic stem cell transplantation. A few isolated case reports have been published in the Korean literature involving a small number of patients who developed membranous nephropathy as GVHD after peripheral blood stem cell transplantation (PBSCT). A 17-year-old female was diagnosed with non-Hodgkin’s lymphoma. Following remission, she underwent allogeneic PBSCT. Shortly thereafter, she developed acute GVHD, which was managed by medical therapy with prednisolone and cyclosporine. Approximately 13 months following PBSCT, the patient developed proteinuria without peripheral edema. Pulsed steroid therapy was initiated three times, but her condition did not improve. Twenty months after PBSCT, she developed nephrotic range proteinuria. A renal biopsy was performed, and the diagnosis was histologically consistent with membranous nephropathy. Because the response to steroids was not satisfactory, the dose of cyclosporine was increased. Approximately 3 months after renal biopsy, the proteinuria disappeared. Given the recent increase in the incidence of GVHD-mediated renal disease, in particular, renal biopsy is indispensable to the diagnosis of nephropathy and to the prevention of disease progression.
서 론
만성 이식편대숙주병(chronic graft-versus-host disease, cGVHD)은 동종 조혈줄기세포이식술(allogeneic hematopoietic stem cell transplantation, HSCT)을 시행한 환자의 60-80%에서 발생하는 후기 합병증 중에 하나로 심각한 이환율과 사망률을 유발한다. cGVHD는 이식 2-3개월 뒤 피부, 눈, 구강, 간, 위장관 및 호흡기계 기관에 발생한다. 일반적으로 HSCT 이후 발생하는 신장기능 저하의 원인은 혈역학적 이상, 약물, 방사선 또는 혈전성 미세혈관병증(thrombotic microangiopathy)으로 인한 신세뇨관 질환이다[1]. 2,136명의 HSCT를 시행받은 환자에 대해 검토한 연구에서 신증의 발생률은 2.4%로 보고하였으며, 이 중 8개의 신증후군 증례를 소개하면서 이러한 사구체 질환은 cCVHD와 연관이 있음을 보고한 예가 있다[2]. 이와 같이, 신장에서의 cGVHD 발생은 드물게 보고되고 있다. 이에 저자들은 동종 말초혈 줄기세포 이식(allogenic peripheral blood stem cell transplantation, allo-PBSCT) 13개월 이후 발생한 신증후군이 막성 신장병으로 진단된 환자의 증례를 경험하여 이를 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 17세 여자
주 소: 단백뇨
과거력 및 현병력: 6년 전 비호치킨 림프종(anaplastic large cell lymphoma, NHL stage III)을 진단받고 항암화학요법(modified BMF [MTX, cyclophosphamide, prednisolone])치료 및 자가 말초혈 줄기세포이식술(auto-PBSCT)을 시행하였다. 1개월 후 재발되어 방사선 치료 및 항암화학요법(ara-C, vinblastine) 시행 후 2년 전 allo-PBSCT를 시행하였다. Allo-PBSCT 시행 1개월 후 등, 허벅지, 양팔의 반구진 및 구강 아구창 양상의 급성 이식편대숙주병(acute GVHD)이 발생하여 전신 스테로이드(prednisolone) 60 mg/day, 사이클로스포린(cyclosporine, CsA) 50 mg/day 투여를 시작하였으며, 9개월 후 전신 스테로이드는 중단하였고 CsA은 75 mg/day 증량하여 지속적으로 복용하였다. CsA 복용 11개월째 혈청 크레아틴 상승 소견으로 Tacrolimus (FK-506)로의 약제 변경을 위해 CsA은 50 mg/day로 감량하였다. GVHD가 발생한지 12개월후 부종 등의 증상 없이 단백뇨가 발생하였다. 내원 2개월전, 1개월 전 2차례 고용량 전신 스테로이드(methylprednisolone pulse therapy [1g])를 투여하였으나 단백뇨가 지속되어 신장 조직검사를 시행하였다.
사회력: 흡연력과 음주력은 없었다.
이학적 소견: 급성 병색은 없었고 혈압 100/68 mmHg, 맥박 100회/분, 분당 호흡수 22회/분, 체온 섭씨 37℃로 측정되었다. 의식은 명료하였고 두경부 검사에서 공막의 황달 소견은 없었고 혀는 말라 있었다. 심폐 청진에서 심음은 규칙적이었고 잡음은 들리지 않았고 양측 폐 청진에서는 이상 소견이 없었다. 복부 진찰 소견은 복부는 편평하였고 경직은 없었으며 장음은 들리지 않았다. 간과 비장의 비대 소견은 없었다. 사지 진찰에서 사지의 함요 부종은 없었으며 신경학적 검사에서도 이상 소견은 없었다.
검사 소견: 혈액 검사에서 백혈구 6500/μL(중성구 53.8%, 림프구 35.0%, 단핵구 7.9%, 호산구 2.9%), 혈색소 12.3 g/dL, 혈소판 265,000/μL, 총 단백질 5.3 g/dL, 알부민 3.4 g/dL, 혈액요소질소 11.2 mg/dL, 크레아틴 0.6 mg/dL, 아스파르테이트 아미노전이효소 29 U/L, 알라닌아미노전이효소 29 U/L, 알칼라인포스파테이트 83 U/L, 총 콜레스테롤 247 mg/dL, 혈청면역글로불린 수치는 면역글로불린 G 727 mg/dL, A 94mg/dL, M 158 mg/dL, 소변 검사에서 단백뇨 4+, 혈뇨 3+, RBC many/HPF, 소변 단백질 크레아틴 비율(spot urine protein/creatinine)은 5.45 g/mg 검출되었다. 항 이중가닥 DNA 항체(anti-double-stranded deoxyribonucleic acid)는 음성, 항핵항체(anti-nuclear antibody)는 1:160 양성이었다. 혈청 보체 수치는 C3 127 mg/dL (90-180 mg/dL), C4 58 mg/dL (9-37 mg/dL)였고 B형 간염 항원 검사 및 C형 간염 항원 검사 결과는 음성이었다.
신장 조직검사를 시행하였고 광학현미경 검사, 면역 형광염색법(immunofluorescence), 전자현미경 상에서 막성 사구체신염(membranous glomerulopathy, MN)이 진단되었다. 광학현미경 검사(Fig. 1A)에서 22개의 사구체(glomeruli)가 포함된 신장 실질 및 수질(renal cortex, medulla) 조직에서 2개가 사구체 모세혈관 벽(glomerular capillary wall)의 수축, 주름진 현상(shrinkage, wrinkling)이 보였고 나머지에서 국소성 분절성 스파이크 형성(focal segmental spikes formation)이 보였으며 사구체 모세혈관 벽이 전반적으로 두꺼웠다. 1개의 사구체에서 국소성 분절성 이중 염색(focal segmental double containing)이 관찰되었다. 은 염색(silver stain) (Fig. 1B)에서 사구체 모세혈관 벽의 구멍(empty hole)이 발견되었다. 혈관사이기질 확장(messangial matrix widening), 혈관사이세포 증식(messangial cell proliferation)은 없었으며 세뇨관, 사이질, 모세혈관에는 이상 소견은 없었다. 면역 형광 염색 분석(Fig. 2A)에서는 9개의 사구체에서 면역글로불린 G, 면역글로불린 M, C3 침착(deposit)이 사구체 모세혈관 벽을 따라 거친 과립모양(coarse granular pattern)으로 관찰되었다. 전자현미경(Fig. 2B)에서는 사구체 기저막을 따라 상피하부층(subepithelial layer)에 전자밀도가 높은 침착물(electron dense deposit)이 보이고 다리세포(podocyte)의 소실(marked effacement)이 관찰되어 MN에 합당한 소견이었다.

Kidney biopsy; Membranous nephropathy. (A) Light micrograph reveals minimal glomerular changes with focal segmental spikes formation (periodic acid-Schiff, ×600). (B) Silver stain shows empty hole of glomerular capillary wall (silver stain, ×600).
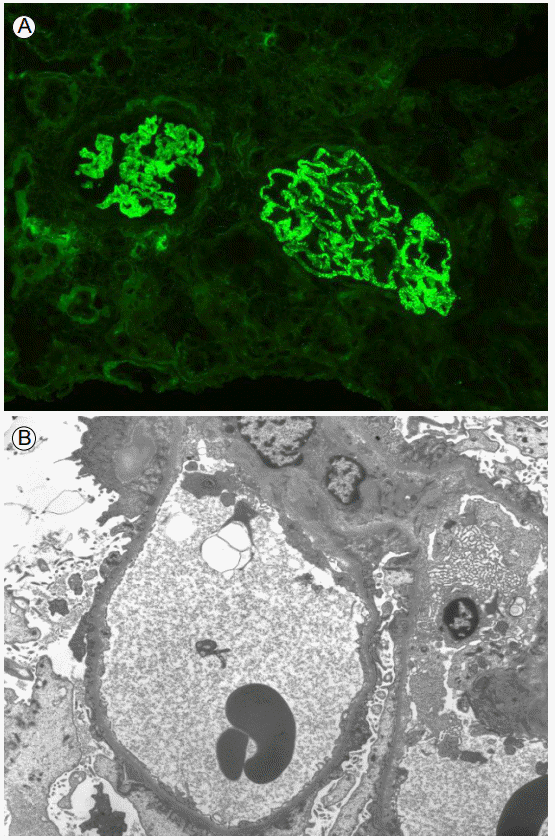
Kidney biopsy. Membranous nephropathy. (A) Immunofluorescence demonstrats granular deposition of C3 along glomerular capillary wall and disclosed granular diffuse positivity for IgG, IgM (immunofluorescence, ×200). (B) Electron micrograph shows dense subepithelial electron deposits and effacement of the foot processes of epithelial cells (electron microscopy, ×15,000).
방사선학적 검사: 심장 비대 혹은 폐부종 소견은 없었다.
임상 경과: 환자는 acute GVHD를 진단받고 12개월이 지난 뒤 단백뇨가 발생되어 고농도 스테로이드(methylprednisolone pulse therapy) (1 g/day)를 연속 3일간 2차례 투여하였고 15개월 후부터 전신 스테로이드(1.5 mg/kg/day), 사이클로스포린(CsA) (2.5 mg/kg/day, 125 mg/day)을 증량하여 투여하였다.
막성 신병증 진단 3개월 뒤 소변 단백/크레아틴 비율(urine protein/creatine ratio)은 6.01에서 0.17로 감소하였다. 혈청 크레아틴 수치는 정상이었다. 이 환자는 CsA (125 mg/day)를 복용하면서 병 진행 소견 없이 추적 관찰 중이다.
고 찰
신장 관련 합병증은 allo-PBSCT의 흔한 합병증 중 하나이며. 급성 신부전의 발생에는 신장 질환, 기저 암 질환, 항암화학요법, 방사선 치료, 신독성 약제 등이 영향을 준다. 따라서 allo-PBSCT 이후의 급성 신부전의 흔한 형태는 급성 세뇨관괴사, 용혈성요독성증후군, 혈전성 미세혈관병증, 방사선 신염 등이다. 하지만 신증후군, 신염증후군과 같은 사구체 질환은 드물게 나타나는데 이는 대개 cGVHD와 연관이 있으며[2], allo-HSCT 환자에서 발생률은 1-4.3% 정도로 보고되고 있다[3]. 본 증례는 acute GVHD가 발생한 환자에서 진단 12개월 후 전신 부종, 거품뇨 등의 증상 없이 단백뇨가 발생하여 MN로 진단된 사례이다.
GVHD는 HSCT의 흔한 후기 합병증으로 이식 후 장기 생존자의 60-80%에서 발생하며 심각한 이환율과 사망률을 유발한다. GVHD는 자가면역 질환의 일환이기 때문에 면역복합체의 사구체 침착이 신손상을 유발하는 것으로 추정된다. 대개 비골수파괴성 치료를 받은 비혈연 기증자로부터 allo-PBSCT를 받은 환자에서 사구체 질환이 많이 발생하는 경향을 보이는데 이러한 환자군에서 면역복합체의 생성이 증가하기 때문이라고 유추된다. 보통 면역억제제를 줄이거나 끊은 뒤 평균 약 1.5개월 후 발생한다. 신부전증의 발생은 allo-HSCT 시행 뒤 약 15.5-24개월 후 발생하는 것으로 보고되어 있다.
GVHD로 인한 신증후군 정도의 단백뇨 발생은 드물며 이중 막성 신장병이 60% 정도이고, 약 15% 정도가 미세 변화성 사구체 신염이며, 나머지는 Immunoglobulin A 신질환, 막성 증식성 사구체 신염, 항호중구세포질 자가항체 관련 신증후군 등이 차지한다[4]. 신부전증이 발생한 환자 중 약 70%에서 cGVHD가 동반되었고 특히 post-HSCT MN의 75-93%는 cGVHD이 동반된 경우였다.
신장 이식 시에 새롭게 발생한 막성 신장병(De novo MN)은 이식신에 발생한다. 이식된 신장의 사구체 다리세포에서 발현하는 주조직 적합성 복합체 또는 비 주조직 적합성 복합체 항원에 대하여 수여자의 동종 반응성으로 인하여 MN이 발생하는 것으로 알려져 있다. 그러나 HSCT를 시행한 후 나타나는 MN의 경우 그 기전에 차이가 있다. Post-HSCT MN에서는 GVHD의 결과로 발생한 면역복합체가 사구체 손상을 유발하는 것으로 추정된다[5]. B 세포 증식 조절이상(B-cell dysregulation), 동종 반응성 T세포(alloreactive T-cell)가 post-HSCT NS와 연관이 있다고 보고되었다[5]. 또한 공여자의 CD4+/Th2 cell과 수여자의 부조직 적합성 복합체 항원과 면역 반응으로 cGVHD가 발생한다고 보고되기도 하였다. 또한 HSCT 전 항암 치료 혹은 방사선 치료가 신손상을 유발할 수 있고 이러한 신손상이 숨어있던 자가 항원을 노출시키거나 변형시켜 donor CD4+ cell을 선택적으로 활성화시켜 면역 반응을 유발할 수 있다고 보고되었다. Müller 등[6]은 사이질에 CD8+ T 림프구가 침윤하여 이식편대 숙주반응과 연관된 신손상을 유발하는 것으로 보고하였다. Seconi 등[7]은 donor T 세포에 의한 TNF-α 생산 증가가 신증후군의 발생에 중요한 역할을 한다고 보고하였다. 결국 HSCT 이후 발생하는 면역복합체의 사구체 및 세뇨관 침착이 신증후군 발생의 주요 기전으로 추정되지만 아직까지 정확한 기전은 밝혀지지 않았다.
HSCT 이후 발생하는 cGVHD와 연관된 신증후군의 확립된 치료지침은 없으나 가장 많이 사용되는 약제는 스테로이드와 CsA이다. 치료 반응도 다양하여 27%에서 완전 반응, 62%에서 부분 반응을 보여주고 있다. 미세 변화 신질환의 환자에서는 약 90%의 치료 반응을 보인다[4]. Beyar-Katz 등[8]은 HSCT 이후 발생한 신증후군이 minimal change disease일 경우 일차 치료로 corticosteroid를 최대 kg당 1 mg까지 사용하고 12-16주 후 단백뇨에 대해 재평가하여 반응이 없을 경우 calcineurin inhibitor나 mycophenolate mofetil, rituximab 등의 다른 면역억제제를 추가하도록 하였으며, MN이나 mesangial prolifeative glomerulonephritis (MPGN), focal segmental glomerulosclerosis 등의 다른 병리학적 진단이 내려졌을 경우에는 처음부터 corticosteroid와 함께 calcineurin inhibitor나 다른 면역억제제를 추가하기를 권고하고 있다.
GVHD로 인한 MN 증례는 국내에서 5예 정도 보고되어 있다[9]. 그러나 본 증례는 타 장기의 cGVHD를 의심할 만한 증상 없이 신증후군 범위의 단백뇨가 발생하여 진단된 점에서 과거 보고되었던 다른 국내 증례와는 차이가 있다. 하지만 2014년 allo-PBSCT 시행 후 타 장기의 cGVHD 발생 없이 MN과 MPGN이 혼재된 신증후군 환자의 증례[10]가 있어 본 환자와 같이 신장 외에 다른 cGVHD의 임상상 없이도 신증후군 범위의 단백뇨가 발생될 수 있음을 유의하여야 한다.
본 증례에서는 PBSCT 시행 1개월 뒤 피부, 구강의 acute GVHD가 발생하였으나 전신 스테로이드 및 사이클로스포린을 사용한 이후 호전되었으며, 단백뇨 발생 당시에는 피부, 눈, 구강, 위장관 및 호흡기계 등의 신장 이외에서는 cGVHD의 다른 증상이 동반되지 않았다. 하지만 단백뇨 발생 1개월전 혈청 크레아틴(Scr) 상승으로 면역억제제의 변경을 위해 CsA를 감량하였고 단백뇨 발생 이후 일시적으로 구강 내 궤양이 악화되었다. 이에, 단백뇨가 최초로 발생한 시점에는 타 장기의 GVHD를 의심할 만한 소견이 없었지만 면역억제제 감량으로 유발된 피부의 GVHD 증상 재발은 본 환자의 막성 신병증이 cGVHD로 인해 발생하였음을 지지해준다. 따라서 본 증례를 통해 allo-PBSCT 시행 후 부종 등의 증상이 없이 신증후군 수준의 단백뇨가 발생한다면 cGVHD로 MN등의 사구체 질환이 발생할 수 있음을 인지하고 정기적인 관련 검사를 시행하여야 하겠다.