전신성 경화증과 동반된 폐암 및 갑상선암 1예
Systemic Sclerosis Associated with Non-small Cell Lung Cancer and Papillary Thyroid Cancer: Case Report and Literature Review
Article information
Abstract
전신성 경화증을 앓고 있는 환자에서 암 발생률은 3-11%에 이른다고 보고되어 있다. 특히 전신성 경화증 환자에서 폐암과 유방암은 유의하게 증가한다고 알려져 있지만 아직 전신성 경화증과 암 발생률의 연관성에 대해서는 논란이 있다. 우리는 전신성 경화증을 앓고 있는 52세 여자 환자에서 비소세포성 폐암, 유두갑상생암종의 중복암을 관찰하였고 매우 드문 증례로 판단되어 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
We report the case of a 52-year-old patient with rheumatic vascular disease (systemic sclerosis), non-small cell lung cancer, and papillary thyroid cancer. Malignant tumors have been described in 3-11% of systemic sclerosis cases. Several studies have demonstrated an increased frequency of cancer, especially lung and breast cancer, in patients with systemic sclerosis, but the association of systemic sclerosis with malignancy is controversial. To our knowledge, however, no case of both lung and thyroid cancer associated with systemic sclerosis has been reported. We present a rare case of double primary cancer in systemic sclerosis, with a literature review.
서 론
전신성 경화증(systemic sclerosis)은 교원질과 같은 세포간질과 단백질의 과도한 축적과 혈관 병변을 특징으로 하는 질환으로서 피부, 폐, 심장, 소화기, 신장, 근 골격계를 주된 병변으로 하는 만성 전신성 질환이다[1]. 미국에선 백만 명당 224건, 영국에선 백만 명당 82건으로 나라마다 차이가 있지만 유병률은 매우 낮은 질병으로 알려져 있다. 병인에는 자가면역, 유전, 호르몬, 환경 요인 등이 병의 발생에 관여한다고 알려져 있으나 정확히 확립된 병인은 아직 없다. 과거에 전신성 경화증 환자의 사망원인은 질병 그 자체였으나 치료의 발달로 인하여 다른 원인에 의한 사망의 비율이 꾸준히 증가하고 있다. 대표적인 예가 악성 종양으로 아직 논란은 있으나 전신성 경화증이 없는 군에 비해서 질병을 가지고 있는 환자에게 악성 종양의 발생률은 유의하게 높았다. 특히 폐암과 유방암의 빈도가 높은 것으로 보고가 되었고 이외에도 비호지킨림프종, 식도암, 간암 등이 비교적 흔히 보고되고 있다[2]. 갑상선암의 병발 여부에 대하여 아직 한국에서 보고가 되지는 않았지만 Antonelli가 시행한 전신성 경화증 환자에서 갑상선암의 발병률에 관한 장기적인 관찰 논문에서 둘 사이의 유의한 연관성이 관찰되었다[3]. 이렇게 다양한 암의 관찰이 되지만 전신성 경화증에 의하여 두 가지 암의 동시 발현이 보고된 적은 없다. 본 저자들은 전신성 경화증을 가진 52세 여자 환자에서 비소세포 폐암과, 갑상선 유두암의 동반된 증례를 경험하여 이를 보고하는 바이다.
증 례
52세 여자 환자가 10년 전부터 서서히 진행되는, 차가운 곳에 있으면 생기는 손이 뻣뻣해지는 증상 및 피부건조 및 경화, 입술주위의 굳음을 주소로 본원 류마티스내과를 내원하여 전신성 경화증을 진단받았다. 진단 후 시행한 흉부 전산화단층촬영에서 폐의 종괴 및 갑상선 종괴가 발견되어 본원 종양내과로 의뢰되었다. 환자는 음주, 흡연력이 없었으며 특별한 감염의 과거력이 없었고 가족력상 특이 사항은 없었다.
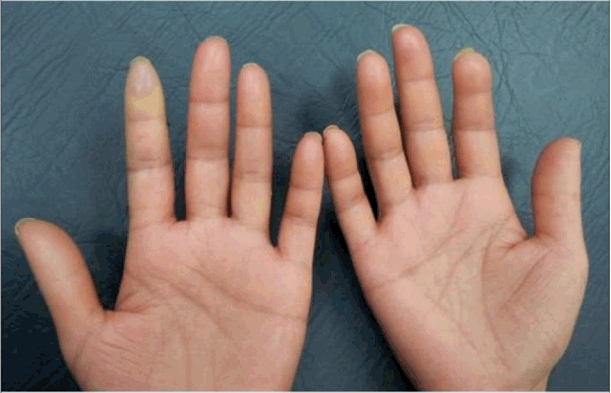
이학적 소견: 환자 입원 당시 만성 병색을 보였다. 입원시 혈압과 맥박은 각각 110/73 mmHg, 80회/분이었고 호흡수는 15회/분, 체온은 36.4ºC를 보였다. 신체 검진상 공막의 황달 및 결막의 이상 소견은 보이지 않았고 목에 만져지는 결절은 없었다. 가슴청진상 양쪽 폐하부로 작은 수포음이 들렸고 양쪽 손의 경한 저림과 통증을 호소하였는데 특히 왼쪽 손의 검지 부분에 상기 증상이 두드러졌고 피부의 경화 소견이 보였다. 양손의 색 변화는 관찰되지 않았고 압통이나 감각 저하가 보이지는 않았다(Fig. 1).
검사 소견: 백혈구 6,100/mm3 (중성구 3,700, 60.3%), 혈색소 12.2 g/dL, 혈소판 228,000/mm3을 보였고 나머지 일반 생화학 검사에서 특이 소견은 보이지 않았다. 적혈구침강속도, C-반응단백 수치는 각각 16 mm/hr, < 0.5 mg/dL로 정상 범위였다. C4 20 mg/dL, C3 104 mg/dL, 항핵항체 양성(antinuclear antibody titration positive 1:310, speckled type), 항-SCL-70항체 양성, 항centromere항체 정상, 항-RNP항체 음성, 항DNA항체 음성을 보였다. 소변 검사상 특이 소견은 보이지 않았다. 갑상선 질환이 의심되어 시행한 갑상선 기능 검사상 thyroid stimulating hormone < 0.01 mIU/L, fT4 1.89 ng/dL, T3 93 ng/dL로 갑상선 기능 저하를 보였다.
흉부 전산화단층촬영: 양쪽 폐에 전반적으로 젖빛유리음영이 보여 간질성 폐질환의 소견을 보였다. 우측폐의 상엽에 2.2 cm의 불규칙한 결절이 보이며 내부는 음영이 낮은 괴사된 부위를 포함한 폐암 소견이 보였다. 우상엽내 분절 및 아분절 기관지 주위로 병적으로 커진 림프절들이 있고, 이 병변들에 의해 우상엽 첨분절 기관지가 거의 막혀있는 상태였다. 늑막 벽의 침범 소견도 관찰되었다(Fig. 2A). 추가로 앞종격에 세포침윤 및 결절음영이 보여 흉선 증생(thymic hyperplasia)이 의심되는 소견이 보였다(Fig. 2B).
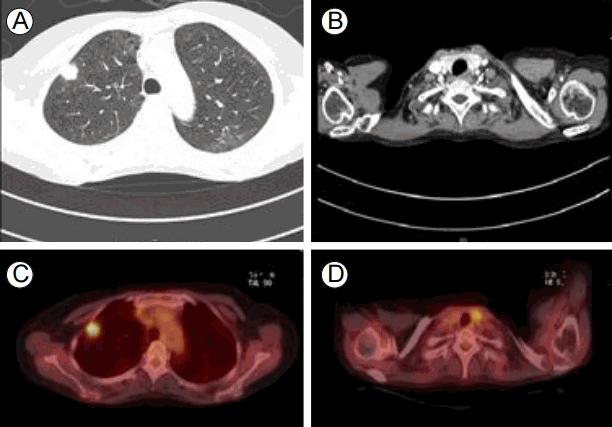
Computed tomography (CT) scan of the chest showing (A) a 2.2-cm primary lung cancer in the right superior lobe and (B) thymic hyperplasia. Axial positron emission tomography (PET) showing increased uptake in the right upper lung (C) and left thyroid lobes (D).
복부 전산화단층촬영, 뇌 자기공명영상, 뼈 스캔: 암의 원격 전이 소견은 없고 특이 소견도 없었다.
양전자 단층촬영: 우측 상부(Right superior)에 폐암으로 보이는 결절이 보였다(Fig. 2C). 갑상선 좌 옆에 두 개의 대사과다상태를 보이는 결절이 보였다(Fig. 2D).
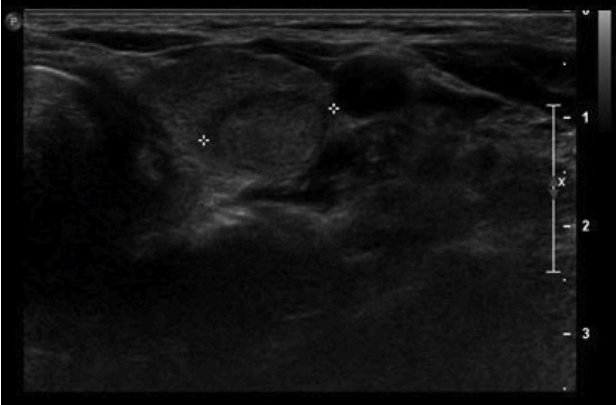
목 초음파: 좌 옆 갑상선의 낮은 극에 1.6 × 1.7 cm 크기의 암이 의심되는 결절이 보였고 양전자 단층촬영에서 대사과다상태를 보이는 부분과 일치하였다(Fig. 3).
병리학적 소견: 우측폐의 우상엽에서 시행한 세포검사에서 분화도가 낮은 선암종이 보였고(Fig. 4A-4D) 상피세포 성장 인자 수용체 유전자(epidermal growth factor receptor gene) 검사에서 돌연변이가 검출되지 않았고, 역형성 림프종 키나아제(anaplastic lymphoma kinase) 유전자 검사에서 돌연변이가 관찰되지 않았다. 좌 옆 갑상선에서 시행한 세포검사에서 유두암종(papillary carcinoma)이 보였다(Fig. 4E-4F).
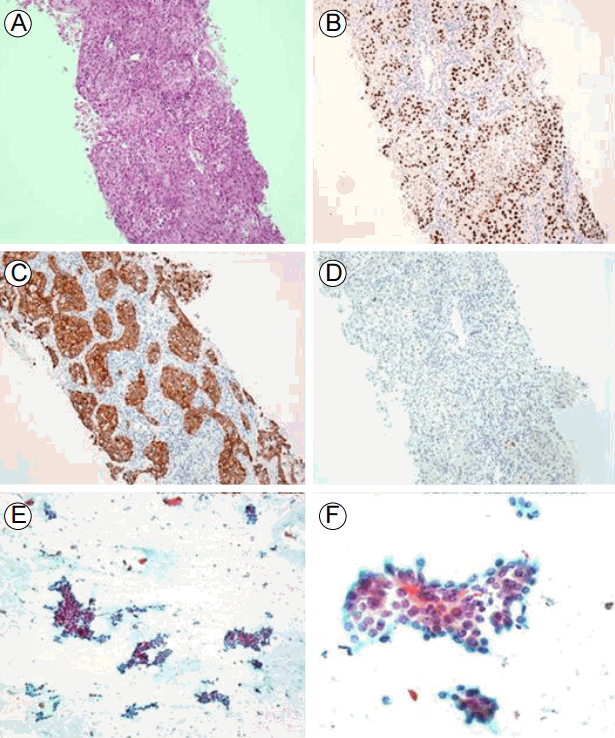
Lung adenocarcinoma in a needle aspiration biopsy (A, H&E ×100) with positive staining for TTF-1 (B) and CK7 (C), but negative staining for P63 (D). (B-D all ×100 magnification). Papillary thyroid cancer showing irregular papillary clusters (E, ×100 magnification) and nuclear membrane irregularity, with many nuclear grooves and intranuclear pseudoinclusions (F, ×400 magnification).
치료 및 경과: 전신성 경화증을 진단받고 폐질환을 감별하기 위해서 시행한 흉부 방사선 소견상 우측 폐 상부의 2.2 cm 정도의 불규칙한 결절이 보였다. 폐암을 감별하기 위하여 흉부 전산화단층촬영을 시행하였고 폐암으로 의심되는 결절이 관찰됨과 동시에 갑상선의 크기 증가가 관찰되었다. 먼저 폐암을 진단하기 위해 폐결절의 생검을 시행하였고 병리학적 소견상 선암종(adenocarcinoma)이 관찰되었다. 폐암의 병기 설정을 위해 양전자 단층촬영을 하였고 늑막 벽의 암침윤 및 다수의 림프절 전이 소견을 보였고 비소세포폐암(non-small cell lung cancer), 선암종, T3N2M1, 병기 4기로 진단되었다. 양전자 단층촬영상 추가로 갑상선에서 결절이 보였다. 갑상선 결절에 대하여 추가로 초음파도 시행하였다. 갑상선 초음파상 갑상선 암으로 의심되는 소견이 보여 결절흡입술을 시행하였고 유두암종으로 진단되었다. 갑상선 유두암종이 관찰되었으나 비소세포폐암도 같이 진단받은 상태로 폐암의 예후가 더 안 좋음을 고려하여 우선 폐암에 대하여 premtrexed, cisplan으로 복합항암요법 2회를 시행하였고 반응평가상 부분관해(partial response)을 보였다. 추가적으로 2회(총 4회) 더 항암 치료하였고 반응평가를 위해 시행한 흉부 컴퓨터촬영에서 림프절의 크기 증가가 관찰되는 암의 진행(progression disease)을 보여 항암요법을 gemcitabine, cisplan으로 변경하였고 2차까지 진행 후 다시 암의 평가를 시행하였다. 반응평가상 암의 흉벽 침범 및 림프절의 크기 증가 등 암의 진행을 보였다. 이후 환자 전신상태 악화로 항암치료를 수행할 수 없어 보전적 치료 중이다.
고 찰
전신성 경화증은 피부만이 아닌 전신 장기의 섬유화를 특징으로 하는 질환으로 작은 혈관의 증식성, 폐쇄성 혈관병증이 동반되고 자가항체에 의한 자가면역 반응이 동반되는 질환이다. 전신성 경화증 환자에서 암 발생이 자주 관찰이 되었었지만 이전엔 암과의 연관성엔 논란이 있었다[4]. 그러나 최근에 시행한 다른 연구에서 대조군에 비해서 전신성 경화증 환자군이 암 발생 위험성이 증가된다고 보고되고 있다[5]. 우리나라에서도 2009년에 Kang 등[6]이 시행한 연구에 따르면 전신성 경화증 환자군이 대조군에 비해 암의 발생률이 4.2배 높다고 보고가 되었다. 전신성 경화증 환자에서 악성종양은 폐암, 유방암의 빈도가 높게 관찰되었고 혈액암, 림프증식성 암 등도 발생하는 것으로 알려져 있다. 2016년 Antonelli가 발표한 연구에 의하면 갑상선 유두암종도 전신성 경화증과 밀접한 관계를 보이고 있다[3]. 우리나라에서도 전신성 경화증에서 폐암 발병은 보고되었고[6] 전신성 경화증에 동반된 그레이브스병, 갑상선 기능저하증, 부갑상선 기능저하증은 각각 1예씩 증례가 소개되었으나[7,8] 전신성 경화증에서 갑상선 암의 발병이 보고된 적은 없고 특히 폐암과 갑상선암의 동시 발병은 다른 문헌에서 찾아 볼 수 없었다.
전신성 경화증에서 암의 발생빈도가 증가하는 정확한 기전은 알려져 있지 않지만 몇 가지 가설들이 제시되고 있다. 첫째로 전신성 경화증 질환 자체가 암 발생의 위험 인자라는 것이다 즉, 경화증에 의해 침범된 부위는 조직학적으로 암이 잘 발생할 수 있다는 가설이다. 사실, 경화증과 암발생의 연관성에 대해선 아직 논란 중으로 몇몇의 연구에서 폐의 경화가 폐암의 발병률을 높이지 않는다는 결론을 내렸다. 반면 다른 논문에선 만성 염증에 의한 폐경화가 폐암 발생의 한 가지 작용기전(mechanism)의 역할을 한다고 보여준다. 폐경화에 의해서 림프관(lymphatic channels)이 막히고 림프관의 기능 상실로 발암물질(carcinogen)이 쌓이게 된다. 이 발암물질에 의해서 전신성 경화증 환자에서 폐경화가 암으로 변화될 수 있다는 것이다. 둘째, 전신성 경화증 환자에서 보이는 악성 종양은 자가항체(autoantibody)와 관련이 있다는 주장이다. 사실 아직 악성 종양과 자가항체의 관련성에 대해서 명확히 밝혀지지는 않았다. 그러나 대규모 연구에서 악성 종양과 전신성 경화증의 진단에서 RNA 중합효소(polymerase) III항체가 관련이 있음을 보여준다. 물론 몇몇의 연구에서 RNA 중합효소 III를 가지고 있는 군과 그렇지 않은 전신성 경화증 환자에서 암의 발생률은 차이가 없음을 보였고 이를 통해 두 질환의 관련성을 부정하지만 다른 많은 연구에서 전신성 경화증 환자 중 자가항체의 역가가 높은 사람에게 악성종양 검사가 필요할 수 있음을 보여주고 있다[9]. 마지막 가설로 전신성 경화증 치료를 위해 사용하는 면역요법 또는 화학요법이 암 발병의 원인으로 지목된다. 시클로포스파미드(cyclophosphamide), 마이코페놀레이트 모페틸(mycophenolate mofetil)은 전신성 경화증에서 쓰이는 면역화학요법이나 시클로포스파미드는 상피, 내피의 증식을 일으켜 종양화시킨다고 보고되고 있고, 방광암의 발암물질로 알려져 있으며, 마이코페놀레이트 모페틸도 발암물질의 역할이 가능한 것으로 보고되고 있다[10]. 최근엔 T세포 및 B세포 표적 치료가 효과가 있다는 보고도 있어 시롤리무스(sirolimus), 알레파셉트(alefacept), 리투시맵(rituximab)의 약제가 쓰이기도 한다. 아직 악성 종양과 이들 약제의 관계성이 보고되지는 않았지만 리투시맵에 의해서 재생불량성 빈혈(aplastic anemia), 발텐스트롬마크로글로불린혈증(waldenstrom macroglobulinemia)의 발병은 보고되고 있어 악성 종양과의 관계성에 대한 추적 관찰 및 연구가 필요하다[9].
본 증례에서 환자는 이미 10년 전부터 서서히 관절통, 레이노 현상 및 양측 손의 피부경화 소견을 보였으며 10년이 지나 본원에서 전신성 경화증으로 진단되었다. 전신성 경화증 진단 당시 시행한 흉부 단층촬영에서 폐의 섬유화 및 폐암이 진단되었고 또한 동시에 갑상선 암이 진단되었다. 이러한 시간적 관계를 생각해 볼 때 전신성 경화증이 폐암과 갑상선 암의 선행 원인이었을 가능성이 높다고 판단된다. 또한 본 증례는 이전의 다른 보고와 달리 전신성 경화증이 서서히 진행하면서 2개의 장기에서 악성 종양이 동시에 발생한 드문 경우이다. 앞에 3가지 가설을 본 증례에 적용해 보면 세번째 가설인 전신성 경화증 치료를 위해 사용하는 면역요법 또는 화학요법이 암 발병의 원인이라는 것은 본 증례의 경우 과거 질병이 서서히 진행되었던 10년 동안 류마티스내과에서 특별한 화학요법을 시행하지 않았으므로 폐암과 갑상선암 동시 발생의 원인이 될 수 없다. 그러나 첫 번째 가설인 전신성 경화증 자체가 암 발생의 위험 인자라는 주장 즉, 경화증에 의해 침범된 부위는 조직학적으로 암이 잘 발생할 수 있다는 가설은 본 증례에 적합한 가설로 사료된다. 환자에게서 10년간 전신성 경화증이 서서히 진행을 하였고 이 과정중에 폐경화에 의해서 림프관(lymphatic channels)이 막히고 림프관의 기능 상실로 발암물질(carcinogen)이 쌓이게 되어 폐암으로 발전한다는 것이다. 또한 아직 기전이 밝혀지진 않았지만 전신성 경화증 환자를 장기(long term) 추적 관찰을 하였을 때 갑상선 유두암의 유병률이 대조군에 비해서 유의하게 높음이 관찰되었고 본 증례의 경우에도 환자에게서 발견된 갑상선 유두암은 전신성 경화증과 관련이 있었을 것으로 생각된다. 두 번째 가설인 악성 종양과 자가면역항체의 관계성은 본원에서 RNA 중합효소(polymerase) III항체는 전신성 경화증 환자에게서 일반적으로 시행하는 검사가 아니라 확인하지 못하였다.
본 저자들이 조사한 바로는 전신성 경화증에서 중복암 발생이 보고된 적은 아직 없다. 이번에 경험한 증례는 전신성 경화증에 동반된 폐암 및 갑상선 유두암으로 항암 치료를 시작한 매우 드문 예이다. 본 증례를 통해서 전신성 경화증에 진단될 시 정기적인 두경부, 흉부 및 복부 컴퓨터단층촬영을 포함한 다른 장기에 대한 면밀한 조사를 통하여 악성 종양을 조기에 발견할 필요성이 있음을 알 수 있다. 또한, 전신성 경화증 환자에서 발생하는 암에 관하여 유전적 연관성에 대하여 체계적인 추가 연구가 필요할 것으로 사료된다.