전이성 대장암 환자에서 Bevacizumab을 사용 후 대장 내시경으로 확인된 허혈성 대장염 1예
Bevacizumab-associated Ischemic Colitis Proven by Colonoscopy
Article information
Abstract
베바시주맙은 여러 고형암 치료를 위해서 사용되고 있는 혈관 내피세포 단일클론 항체이다. 베바시주맙은 기존 화학요법제 보다 낮은 빈도로 부작용을 보이지만, 소화관 천공은 매우 치명적인 부작용이다. 베바시주맙 관련 소화관 천공은 장관내 혈관 구조의 손상과 관련이 있다. 그러나 허혈성 장염은 비특이적으로 증상을 보여서 증상만으로 진단이 어려운 질환이다. 우리는 베바시주맙으로 치료받고 대장 내시경과 병리학적으로 확인된 허혈성 장염으로 진단되었고, 일반적인 지지요법을 통해서 호전된 56세 여자 환자 증례를 보고합니다.
Trans Abstract
Bevacizumab is a monoclonal antibody against vascular endothelial growth factor widely used to treat several types of solid tumor. Although bevacizumab has fewer adverse effects than conventional chemotherapy agents, several serious events have been reported. Gastrointestinal perforation is an infrequent but potentially fatal side-effect of bevacizumab. The major mechanism of bevacizumab-associated gastrointestinal perforation is damage to the intestinal vasculature. However, preceding ischemic colitis is difficult to diagnose due to its non-specific symptoms. We report a case of a 56-year-old male with bevacizumab-associated ischemic colitis proven by colonoscopy and pathologic findings. The patient’s condition improved after general supportive care including bowel rest, intravenous fluids, and intravenous antibiotics. No similar event has been reported since he resumed chemotherapy without bevacizumab.
서 론
Bevacizumab은 vascular endothelial growth factor (VEGF) inhibitor로써, 종양의 신생혈관 발생을 억제하여 효과를 나타내며 전이성 대장암, 폐암, 난소암 등의 치료제로 사용되고 있다. 대장암 환자에서 fluorouracil을 포함한 기존의 항암화학요법에 bevacizumab을 추가할 경우 예후가 향상됨이 증명되었으며, 현재 고식적 항암화학요법(palliative chemotherapy)으로 널리 사용되고 있다[1].
Bevacizumab의 대표적인 부작용으로는 고혈압, 단백뇨, 설사 등이 있으며 드물게 출혈, 동맥색전증, 장천공과 같은 치명적인 부작용이 발생하기도 한다. Bevacizumab 투약 후 발생한 장천공은 대장 허혈과 관련이 있는 것으로 알려져 있으며, 이와 연관된 허혈성 대장염도 드물게 보고된 바 있으나 내시경으로 확인된 경우는 없었다[2]. 저자들은 전이성 대장암으로 bevacizumab을 포함한 항암화학요법 도중 발생한 허혈성 대장염을 내시경 및 병리 소견과 함께 조기에 확인하였으며, 대증요법을 시행한 후 치료된 1예를 경험하였기에 보고한다.
증 례
환 자: 56세 남자
주 소: 좌상복부 통증 및 혈변
현병력: 1일 전부터 발생한 좌상복부 통증과 5차례의 혈변으로 응급실에 내원하였다.
과거력: 5년 전 직장암(pT3N0)으로 술 전 동시항암방사선요법 후 복강경전방절제술 및 보조항암요법을 시행하였다. 추적 관찰 중, 간 전이가 확인되어 4주 전부터 bevacizumab 5 mg/kg, bolus 5-FU 400 mg/m2와 이틀간 5-FU 1,200 mg/m2 지속정주, leucovorin 200 mg/m2, irinotecan 180 mg/m2를 2주 간격으로 투약하였다. 7일 전 항암화학요법 2주기를 투약하였다. 동반된 내과적 질환은 없었다.
가족력 및 사회력: 특이 사항 없음
신체 검사 소견: 내원시 혈압은 143/83 mmHg, 맥박수 87회/분, 호흡수 16회/분, 체온 36.3℃였으며 의식은 명료하였다. 좌상 복부에 압통이 있었으나 반발압통은 없었다. 장음은 정상이었다. 직장수지 검사와 비위관 세척에서 출혈의 증거는 없었다.
검사 소견: 말초혈액 검사에서 백혈구 3,950/mm3, 혈색소 12.6 g/dL, 혈소판 179,000/mm3, 중성구는 66.1%였다. Lactate dehydrogenase가 372 U/L로 상승되어 있었으나 전해질 이상이나 blood urea nitrogen, creatinine의 상승은 없었다. C-reactive protein은 0.97 mg/dL로 약간 상승되어 있었다.
단순 복부 방사선 검사에서 유리 기체 등, 장천공을 의심할만한 소견은 관찰되지 않았다(Fig. 1).
구불결장경에서는 항문연 20 cm에서 40 cm에 걸쳐 미만성의 현저한 충혈과 부종, 접촉성 출혈이 있었으며, 다발성 미란이 함께 관찰되어 허혈성 대장염에 합당한 소견이었다(Fig. 2A). 미란이 있는 병변에서 조직검사를 시행하였다.
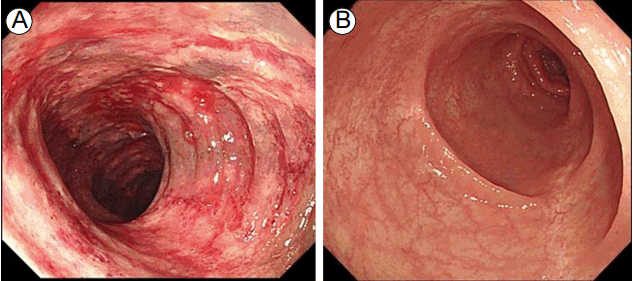
(A) Sigmoidoscopy showing diffuse hyperemic, edematous mucosal change with multiple erosions and easy-touch bleeding from anal verge 20 to 40 cm. (B) After 1 week of treatment, the mucosal damage was totally healed.
조직검사 결과: 점막의 미란과 출혈, 고유판의 피브린 침착이 동반된 허혈성 변화 소견이 있었다(Fig. 3).
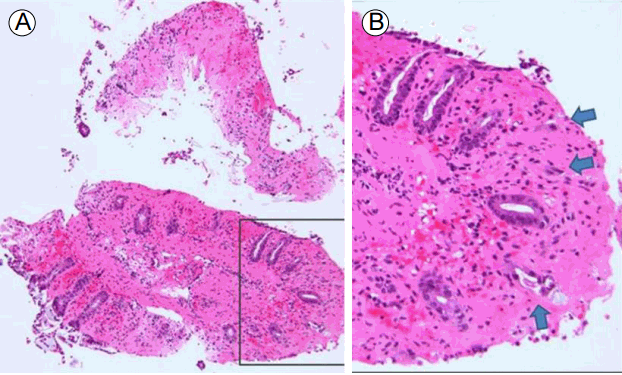
(A) Inflammatory change in the colonic mucosa (×100 magnification, hematoxylin-eosin staining). (B) Enlarged (×400) view of the area indicated by the black rectangle in the left panel showing mucosal erosion and hemorrhage, crypt drop-out, and fibrin deposition in the lamina propria (arrows) (hematoxylin-eosin staining).
치료 및 경과: 금식, 수액공급, 정맥항생제(cefotaxime 2 g tid, metronidazole 500 mg qid) 등 보존적 치료를 시행하였다. 치료 4일 후, 복통이 소실되어 식이를 재개하였다. 치료 7일째 시행한 구불결장경에서는 이전에 관찰되었던 병변들이 소실되어, 허혈성 대장염이 회복된 소견이었다(Fig. 2B).
이후 3번째 항암주기부터는 bevacizumab을 투약하지 않았고, 9차례 항암주기까지 유사한 위장관 부작용은 없었다.
고 찰
허혈성 대장염은 60대 이상의 노인 인구에서 주로 발생하며, 장의 허혈성 손상의 가장 흔한 형태이다. 대부분의 경우 특정 원인을 찾지 못하나, 고혈압, 당뇨, 허혈성 심장 질환, 뇌혈관 질환, 혈관수축성 약물 등이 위험 인자로 알려져 있다[3]. 치료로는 금식, 광범위 항생제를 투약하며 일반적으로 보존적 치료에 잘 반응하나, 일부에서 장경색, 장천공 등 심각한 합병증이 발생할 수 있다.
Bevacizumab을 투약받는 환자 12,294명을 대상으로 한 메타분석에서는 장천공이 0.9%, 이로 인한 사망률이 21.7%로, bevacizumab을 사용할 경우에는 특히 주의가 필요하다[4]. Bevacizumab 투약 환자에서 발생하는 장천공의 기전에 대해서는 여러 가설이 있다. 첫째, 실험용 쥐에서 VEGF를 억제한 결과 소장의 혈관밀도가 34% 감소함이 관찰되었으며, 줄어든 혈액공급으로 인하여 점막이 손상될 수 있다[5]. 둘째, VEGF를 억제할 경우 nitric oxide의 생산이 줄어들어 혈관수축을 일으킨다는 보고가 있으며 이 또한 장점막의 손상과 관련이 있다[6]. 마지막으로, 장천공이 발생한 환자의 병리조직에서 세동맥의 혈전색전증이 발견되는 경우가 있어, 혈전색전증도 관련이 있을 것으로 생각된다[7]. 이러한 기전들이 허혈성 장염 발생기전과 공통되며, 이러한 손상의 정도에 따라서 보존적 치료가 가능한 허혈성 장염과 수술이 필요한 괴사성 장염 및 장천공까지 다양한 소견이 나타날 수 있다. Bevacizumab을 투약한 환자에서 장천공은 대개 bevacizumab 투약 후 6개월 이내에 발생한다고 알려져 있다[8]. Bevacizumab을 투약한 전이성 대장암 환자의 대규모 전향적 관찰 연구인 BRiTE study에서, 천공 환자의 2/3가 천공부위의 종양, 장폐색, 복강내 농양, 게실 등 기저 병변이 있는 부위에서 발생하였다고 보고하였다[9]. 이러한 장천공의 위험 인자로는 steroid 사용, 원발암의 종류, 위궤양, 골반부위 방사선조사력이 있다[10].
Bevacizumab 2회 투약 후 허혈성 대장염이 발생하였으며, 다른 위험 인자가 없어 bevacizumab 투약과 관련된 것으로 판단하였다. 모호한 증상으로 응급실에 내원하였으나 빠른 내시경 및 조직학적 진단으로 보존적인 치료를 시작하였고 합병증 없이 순조롭게 회복되었다.
기존 보고들에서는 bevacizumab 투약 후 발생한 허혈성 대장염을 computed tomography (CT)로 진단한 경우가 많았다[10]. CT는 장간막동맥의 혈전을 확인하는데 유용하며 복막자극징후, X-ray에서 유리된 공기(free air)가 보여 장천공이 의심되는 경우 먼저 시행하여야 한다. 내시경은 출혈 병소과 치료 내시경을 시행할 수 있고, 병소의 조직을 얻을 수 있다는 장점이 있다. 또한, 추적 내시경으로 병소의 변화를 CT보다 더 자세히 알 수 있다. 본 증례에서는 복막자극징후가 없고 혈변이 주증상으로, 구불결장경을 시행하여 허혈성 대장염을 진단하였다.
Bevacizumab 투약 환자에서 대장의 허혈성 변화는 장천공으로 이어질 수 있다. 항암 치료를 받는 대장암 환자에게 발생한 허혈성 대장염의 경우 모호한 증상인 경우가 많아 진단이 늦어질 수 있다. 따라서 bevacizumab을 투약하는 환자에게 허혈성 대장염이 발생할 수 있다는 것을 인지하고, 자세한 진찰과 내시경 등의 검사를 통해 빠른 진단, 적절한 치료가 이루어질 때 장천공을 예방할 수 있을 것이다.