전이성 유방암의 호르몬 치료
Hormone Therapy for Metastatic Breast Cancer
Article information
Trans Abstract
The treatment of metastatic breast cancer depends on the patient’s condition, site of metastasis, and molecular subtype of cancer. Hormone receptor-positive patients, which account for 60-70% of all breast cancer patients, have the advantage of having an effective, less-toxic, hormone therapy treatment. Hormone therapy should be used actively because it is very useful in terms of the patient’s quality of life, by increasing the response rate and delaying the progression of cancer. Recently, studies have examined the mechanism of resistance to hormone therapy. We need to combine various target therapies to overcome resistance. The development of therapeutic agents based on molecular biological characteristics should help to improve the survival of patients with metastatic breast cancer.
서 론
유방암은 우리나라 여성암 중 갑상선암에 이어 두 번째로 흔한 암으로 2013년 국내 통계에 의하면 10만 명당 68명에서 발생하고 여성암 사망 원인 5번째를 차지하고 있다[1]. 전이성 유방암은 비교적 항암화학요법에 좋은 반응을 보여 중앙 생존 기간도 2-3년으로 길지만 완치율은 아직도 매우 낮다. 따라서 전이성 유방암의 치료 목표는 부작용을 최소화하면서 생존 기간을 연장하고 암으로 인한 증상을 완화하여 삶의 질을 향상시키는 것이다. 다른 암과 달리 유방암의 치료는 종양의 특성과 환자의 상태에 따라 호르몬 치료, human epidermal growth factor receptor-2 (HER-2) 표적요법 및 항암화학요법을 선택하여 사용할 수 있다. 이에 전이 병변이 광범위하지 않고 호르몬 수용체 양성인 환자의 경우엔 독성이 적은 호르몬 치료가 항암화학 요법보다 우선적으로 선택될 수 있다[2]. 호르몬 수용체 양성 유방암은 전체 유방암의 60-70%를 차지하며 음성 유방암에 비해 예후가 좋고 호르몬 치료에 잘 반응하는 것으로 알려져 있다. 특히 재발까지의 기간이 2년 이상으로 길고 내부 장기에 전이가 없어 병의 진행 속도가 느릴 것으로 예상되는 경우에는 오랜 기간 효과적으로 호르몬 치료를 유지할 수 있다. 이를 기반으로 현재 사용 중인 호르몬 치료제의 종류와 임상적 사용, 내성극복에 대해 알아보고자 한다.
호르몬 치료제의 종류와 부작용
유방암의 호르몬 치료는 1896년 Beatson이 폐경 전 유방암 환자에서 우연히 난소적출술 후 유방암의 진행이 억제되는 것을 확인하면서 여성 호르몬과 유방암은 연관되어 있고 이를 치료로 이용할 수 있다는 가능성을 제시하였다[3]. 이 후 여성호르몬이 유방암 발생 및 진행에 관여함을 확인하고 이를 표적으로 치료제들이 개발되었다. 종양세포에서 발현되는 호르몬 수용체는 에스트로겐 수용체(estrogen receptor, ER)와 프로게스테론 수용체(progesterone receptor) 두 가지로 구분할 수 있고 두 가지 모두 양성으로 확인된 경우 70%의 환자에서 호르몬 치료에 반응함을 알 수 있었다[4]. 한 가지 치료제에 반응을 보이던 중 내성이 확인되어 질병이 진행된 경우 다른 기전의 호르몬 치료에 반응할 수 있으므로 질병의 경과가 빠르지 않다면 순차적으로 호르몬 치료를 시행할 수 있다.
현재 임상에서 사용되는 호르몬 치료제는 표 1과 같고 작용기전에 따라 크게 세 가지로 구분할 수 있다(Fig. 1). 첫 번째로 에스트로겐 수용체와 경쟁적으로 결합하여 길항제(antagonist)로서의 역할 혹은 수용체의 하향조절을 유발함으로써 항종양 효과를 나타내는 약제다. 에스트로겐의 작용을 방해하는 약제에는 선택적 에스트로겐 수용체 조절제(selective estrogen receptor modulator, SERM)인 타목시펜(tamoxifen), raloxifene, toremifene 등이 있고, 이 약제들은 유방암에서 대부분 에스트로겐 길항제(estrogen antagonist) 역할을 한다[5]. 최근에 개발된 fulvestrant는 에스트로겐 유사작용이 없는 에스트로겐 수용체 하향조절제(estrogen receptor downregulator)로 SERM과 달리 길항제의 활성이 없고, 에스트로겐 수용체에 결합하여 유방암 세포에서 에스트로겐 수용체 단백질이 급속히 손실되도록 함으로써, 에스트로겐의 효과를 억제하는 것으로 알려져 있다[6,7].
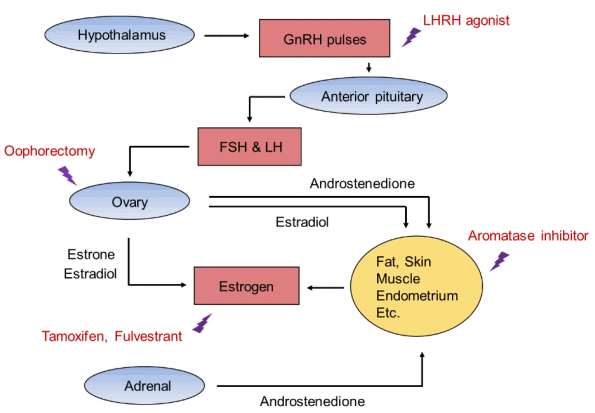
Female sex-hormone production and hormone therapy. In premenopausal women, GnRH secreted from the hypothalamus stimulates FSH and LH production in the anterior pituitary gland. FSH and LH stimulate follicle growth in the ovaries. LH also plays a role in the development of ova and stimulation of estradiol production. In comparison, in postmenopausal women, estrogen is produced by aromatase in fat, skin, and muscles. A lightning bolt indicates the site of action of each hormone therapy. GnRH, gonadotropin-releasing hormone; LHRH, luteinizing hormone-releasing hormone; FSH, follicle-stimulating hormone; LH, luteinizing hormone.
두 번째로 에스트로겐의 생성을 억제시키는 방법으로 아로마타제 억제제(aromatase inhibitor)가 대표적이다. 이는 부신피질에서 생성되는 스테로이드에는 영향을 주지 않으면서 생식샘, 지방, 근육, 뇌 등에 존재하는 에스트로겐 합성에 필수적 효소인 아로마타제를 억제함으로써 여성호르몬의 수치를 낮추어 항암 효과를 나타낸다. 아로마타제 억제제 개발의 순서에 따라 세대를 구분할 수 있으나 1, 2세대 아로마타제억제제인 aminoglutethimide, formestane 및 fadrozole은 부신부전(adrenal insufficiency)이나 알도스테론 억제를 일으키는 등의 부작용이 있어 현재는 부작용이 적고 효과가 우수한 3세대가 주로 사용되고 있으며 anastrozole, letrozole, exemestane이 있다[8]. Anastrozole과 letrozole은 비스테로이드성 제제로 아로마타제와 가역적 반응을 보이는 반면, exmestane은 스테로이드성 제제로 비가역적으로 말초 변환을 억제시키는 특징이 있다[9]. 이러한 아로마타제 억제제는 난소의 기능이 없는 폐경 후 유방암 환자에서는 효과적일 수 있으나 폐경 전 환자에서는 난소의 기능이 유지됨으로 오히려 에스트로겐 생성을 증가시킬 수 있으므로 사용하기 어렵다. 따라서 폐경 전 유방암 환자에서는 에스트로겐의 주 생산 장소인 난소를 기능적(ovarian suppression) 혹은 완전한 제거(ovarian ablation)를 통해 혈중 에스트로겐의 농도를 낮추는 전략이 필요하다. 영구적으로 난소의 기능을 억제하는 방법에는 수술적 난소절제술, 방사선 요법이 있고 황체형성호르몬분비호르몬(luteinizing hormone-releasing hormone, LHRH) 유사체인 goserelin은 뇌하수체로부터 나오는 신호를 방해하여 일시적인 난소 기능을 억제한다[10].
셋째는 성호르몬 치료법으로 progestin이나 고용량 에스트로겐을 사용할 수 있다. Progestin 제재로 megestrol acetate, medroxyprogesterone acetate와 안드로겐 제재인 fluoxymesterone이 사용될 수 있으며 고용량 에스트로겐인 diethylstilbestrol, ethynyl estradiol 등이 가능하나 임상적으로 많이 사용되지는 않는다.
폐경 전 후의 전이성 유방암의 호르몬 치료로 가장 대표적인 타목시펜은 여성호르몬 감소로 인해 부작용이 발생되며 주로 50세 이상의 폐경 후 여성에서 더 흔히 관찰된다. 폐색전증, 심부정맥혈전증, 뇌경색, 백내장과 자궁내막암 같은 중대한 부작용은 흔하게 발생되지 않으나 주의를 기울여야 하며 흔하게는 구역, 우울감, 안면홍조, 질건조, 질분비 등이 자주 발생한다[11]. 폐경 후 여성에서 사용되는 아로마타제 억제제는 안면홍조, 관절통을 비롯한 근골격계 증상이 가장 빈번하게 발생되나 자궁내막암이나 혈전증의 빈도는 타목시펜보다 의미 있게 낮다. 하지만 간혹 골다공증과 골절의 위험이 발생되므로 정기적인 골밀도 측정과 예방적 치료가 필요하다[12].
폐경 전 유방암 환자의 호르몬 치료
이전에 보조 치료로 호르몬 치료제를 사용하였던 폐경 전 환자에게는 난소 기능 억제제인 황체형성호르몬분비호르몬유사체(LHRH agonist)를 단독 또는 폐경 후 환자에 준한 내분비 치료와 병행하여 투여하거나 수술이나 방사선조사를 통한 난소절제술을 시행할 수 있다. 이전에 호르몬 치료제를 사용하지 않았다면 타목시펜의 단독투여, 또는 난소절제술이나 gonadotropin-releasing hormone (GnRH) 유사체와 병용투여하거나, 난소절제술이나 GnRH 유사체를 폐경 후 환자에 준한 기타 내분비 치료와 병용하여 시행할 수 있다[13].
호르몬 수용체 양성인 폐경 전 유방암 환자에서 타목시펜은 표준요법이다. LHRH 유사체는 호르몬 수용체 양성인 전이성 유방암 환자에서 난소적출술과 비교하여 치료 반응률, 무진행 생존 기간과 전체 생존 기간의 차이는 없으나 수술치료에 비해 안면홍조 등의 부작용은 흔하지만 LHRH 유사체 사용을 중단하였을 때 난소 기능이 가역적으로 회복되는 장점이 있다[14]. LHRH 유사체 단독요법에 비교해서 타목시펜을 동시에 사용하는 것이 더 효율적일 것이라는 기대 하에 몇 개의 연구들이 진행되었고 이에 대한 메타분석 결과가 보고되었다[15]. LHRH 유사체 단독에 비해 병합요법은 치료반응률(odd ratio = 0.67)이 우월하고, 무진행 생존 기간(hazards ratio = 0.70)과 전체 생존 기간(hazards ratio = 0.78)의 향상을 보여 폐경 전 호르몬 수용체 양성인 유방암 환자에서 일차치료의 표준으로 확립되었다[13]. 폐경 전 여성에서 LHRH 유사체 단독요법과 폐경 후 여성에서 사용되는 아로마타제 억제제를 병합하는 연구는 많지 않지만 몇몇 2상 연구를 통해 그 가능성은 확인이 되어 고려해 볼 수 있다. 하지만 더 많은 환자를 대상으로 하는 대규모 연구 결과로 확인되기 전에는 임상에서 두 약제를 병합하여 사용하는 것은 추천되지 않는다[16,17]. 그 외 수술적 방법과 방사선 조사를 이용한 난소절제술이 폐경 전 전이성 유방암의 치료에 이용되었고 타목시펜과 동등한 효과를 보임이 확인되었다[18]. 하지만 젊은 여성에 있어 장기적인 호르몬 감소를 통한 부작용 등을 고려해 볼 때 좀 더 신중한 결정이 필요하다.
폐경 후 유방암 환자의 호르몬 치료
이전에 호르몬 치료를 시행받은 적이 없거나 보조 호르몬 치료 종료 후 1년 이상 경과된 폐경 후 재발 및 전이성 유방암 환자에게는 아로마타제 억제제 또는 선택적 에스트로겐 수용체 조절제가 적절한 1차 호르몬 치료법이다. 과거 폐경 후 여성에서 타목시펜이 호르몬 치료의 일차 요법제로 여겨져 왔으나, 아로마타제 억제제와 에스트로겐 수용체 하향조절제 등이 개발되면서 다수의 임상 연구가 진행되었고 이를 기반으로 치료의 지침으로 확정되었다[13]. 1990년대 후반부터 2000년대 중반까지 진행된 대규모 3상 연구들을 보면 기존의 표준요법으로 알려진 타목시펜, megestrol acetate에 비교하여 3세대 아로마타제 억제제가 우수한 치료 반응과 일부 생존 기간의 연장이 입증되었고 부작용 측면에서도 우월함이 확인되었다[19-22]. 이는 25개의 비교 연구, 8,504명을 대상으로 메타분석한 결과에서도 3세대 아로마타제 억제제를 사용한 환자들의 생존율(hazards ratio = 0.87) 및 반응률의 효과가 입증되어 폐경 후 전이성 유방암 환자에서 1차 치료제로서 자리잡게 되었다[23].
에스트로겐 수용체 하향조절제인 fulvestrant의 초치료 효과를 확인하기 위한 연구들이 진행되었다. 폐경 후 전이성 유방암 환자를 대상으로 고용량(500 mg)의 fulvestrant는 anastrozole인만큼 효과적이며 무진행 생존 기간 측면에서 fulvestrant가 더 우수(23.4개월 대 13.1개월)하여 고용량 fulvestrant도 1차 내분비 요법으로 고려할 수 있겠다[24,25]. 최근에는 1차 치료로 타목시펜을 우선으로 사용하지 않기 때문에 의미는 적으나 250 mg의 fulvestrant와 타목시펜 비교한 연구 결과 두 약제 간의 부작용은 유사하였고 유효성이나 생존율에는 차이가 없었다[26]. 이후 연구자들은 폐경 후 전이성 유방암의 치료에 있어 1차 치료로 저용량(250 mg) fulvestrant를 anastrozole과 병행투여하는 것이 어떨지에 대한 관심을 가지고 두 개의 대규모 연구를 진행하였다. SWOG0226 [27]은 무진행 생존 기간과 전체 생존 기간을 연장 효과가 확인되었으나 FACT 연구[28]에서는 병용요법의 효과를 입증하지 못하였다. 동일한 치료제를 비교한 연구에서 상이한 결과가 나타났지만 하부그룹 비교에서 볼 때 이전에 보조 타목시펜을 복용하지 않아 호르몬 치료에 노출이 적은 환자들에서는 어느 정도 효과가 있을 것으로 생각된다.
이전에 선택적 에스트로겐 수용체 조절제를 투여받았으며 호르몬 치료 종료 후 아직 1년 이상 경과되지 않은 폐경 후 재발 및 전이성 유방암 환자에게는 아로마타제 억제제나 fulvestrant를 2차 호르몬 치료를 시행할 수 있다. 2차요법으로 anastrozole과 fulvestrant을 비교한 3상 연구에서도 전체 생존율의 차이가 없이 유사한 효과를 확인하여 이전에 호르몬 치료를 시행받은 환자에서도 충분히 고려할 수 있는 치료제로 생각된다[29]. 또한 이전에 아로마타제 억제제로 치료받았던 경우에 있어서도 저용량 fulvestrant가 exemestane과 동등한 효과를 입증하였다[30]. 2차 치료에서 고용량과 저용량 fulvestrant의 비교 연구에서는 고용량 fulvestrant에서 무진행 생존 기간이 더 우수하여 부작용이 증가되지 않는다면 고용량을 사용하는 것으로 권고하고 있다[31]. 그 외에 megesterol acetate, fluoxymesterone, 고용량 에스트로겐제(ethinyl estradiol) 등의 사용을 고려해 볼 수 있으나 근거 자료는 부족하다.
호르몬 치료의 내성 기전
전이성 유방암 환자의 호르몬 치료시 20% 정도의 환자들은 처음부터 반응하지 않고 내성(de novo resistance)을 보인다. 또한 호르몬 치료제의 종류에 따라 반응률의 차이는 선택적인 내성(agent selective resistance)을 설명할 수 있고 초기에 반응을 보이던 경우에도 지속적인 사용에 따라 결국에는 내성(acquired resistance)을 획득하게 된다.
초기 실험실 연구는 타목시펜의 내성 기전을 확인하고자 노력을 하였다. 최근까지 다양한 연구 결과들을 간단히 정리하면 타목시펜 내성에 대한 원인으로 에스트로겐 수용체의 상실[32], ERα와 ERβ의 다양한 발현, CYP2D6 유전형의 변이에 의한 활성화 대사물인 endoxifen의 혈중 농도 감소[33,34], 보조 억제 인자인 nuclear receptor corepressor가 감소, 보조 활성 인자의 활성화 등[35,36]이 제안되나 에스트로겐 수용체와 인간상피수용체-2 (HER-2)와의 crosstalk가 가장 주목받고 있다[37]. 이에 대한 설명은 에스트로겐 수용체와 HER-2가 동시에 발현되어 있을 때는 타목시펜이 에스트로겐의 길항제가 아닌 작용제로 작동하는 것이 아닐까 제안하고 있다.
아로마타제 억제제가 내성을 획득하는 기전에 대한 연구도 진행되었다. 첫째로 설명할 수 있는 이론적인 가설은 유방암의 종양세포내 이질성(intratumoral heterogeneity)으로 암세포 중에는 호르몬 수용체의 유무 및 치료 반응이 다양하다는 것이다. 두 번째는 호르몬 치료가 지속됨에 따라 치료에 적응을 하고 결국에는 에스트로겐에 대한 과민성(hypersensitivity)을 얻는 것으로 설명하고 있다[38].
호르몬 치료제와 표적 치료제의 동시치료
에스트로겐 수용체와 성장인자 수용체 신호전달 사이의 crosstalk가 호르몬 치료의 내성에 중요한 역할이 알려져 이를 극복하기 위한 병합요법이 다양한 약제를 이용하여 진행되었다[39].
성장인자 수용체 신호전달을 표적으로 시행된 연구들을 살펴보겠다. 우선 TAnDEM은 HER-2 양성 및 호르몬 수용체 양성인 전이성 유방암 치료로 anastrozole과 trastuzumab을 병용한 최초의 무작위 3상 연구로 anastrozole 단독투여에 비해 무진행 생존 기간, 전체 생존 기간을 유의하게 향상시킴을 입증하였다[40]. 상피성장인자수용체(epidermal growth factor receptor, EGFR)와 HER-2를 동시에 억제하는 lapatinib을 추가한 letrozole, lapatinib 병합요법과 letrozole 단독군을 비교한 3상 시험에서도 병합치료군에서 무진행 생존 기간(8.2개월 대 3.0개월)의 유의한 향상이 있음을 확인되었고 질병의 진행위험을 29% 감소시켰다[41]. 비소세포폐암의 치료제로 많이 사용되고 있는 gefitinib은 EGFR을 선택적으로 차단하며 EGFR의 돌연변이가 확인된 경우 치료 효과가 있음이 알려져 있다. 이를 호르몬 수용체 양성 유방암 치료에 병합하여 내성을 극복하고자 하는 연구들이 진행되었다. 동물 모델에서 아로마타제 억제제와 gefitinib을 병합하여 종양 성장을 지연시키는 결과를 확인하여 임상 연구가 진행되었다. 2010년 Cristofanilli 등[42]이 보고한 결과 호르몬 수용체 양성, 폐경 후 전이성 유방암 환자에서 anastrozole과 gefitinib을 병용하였을 때 위약군에 비해 무진행 생존 기간(14.7개월 대 8.4개월)의 차이를 확인하였으나 원래 계획된 환자를 모집하지 못하였고 매우 적은 환자들만이 분석되어 결과를 신뢰하기 어렵다. 또한 선행요법 연구[43]에서는 gefitinib을 추가함으로써 임상적, 생물학적 반응을 확인하지 못하여 현재로서는 EGFR 억제제는 호르몬 치료의 내성을 극복하기 위한 병합 치료제로서의 가능성은 떨어진다.
성장인자 신호전달 경로의 하부를 차단하는 약물들에 대한 연구가 진행되었고 대표적으로 PI3K 경로를 차단하는 molecular target of rapamycin (mTOR) 억제제가 효과적임이 확인되었다. 1차 호르몬 치료에 실패한 호르몬 수용체 양성, 폐경 후 유방암 환자 724명을 대상으로 exemestane과 everolimus의 병용요법 효과를 비교하였다. 병합요법시 단독요법에 비해 유의하게 무진행 생존 기간의 연장(10.6개월 대 4.1개월)되었으나 구내염, 빈혈, 피로감, 고혈당, 폐렴 등의 부작용이 증가됨을 확인하였다[44]. 이와 유사한 결과는 2상 연구인 TAMRAD 연구[45]에서 타목시펜과의 병합에서도 확인되어 내분비 치료의 내성 기전에 PI3K/mTOR 경로와 에스트로겐 수용체 경로 사이의 crosstalk가 작동함을 입증하는 간접적인 근거로 생각할 수 있다. 하지만 세 번째 시행된 HORIZON 연구는 letrozole에 temsirolimus 추가하여 시행하였으나 생존 기간의 향상을 확인하지 못하여 중도에 연구를 중단하였다[46].
혈관 신생을 억제하는 약제를 동시에 투여하여 내성을 극복하고자 하는 연구들이 진행되었다. 몇몇 전임상 연구와 후향적 연구를 통해 종양 조직의 혈관내피 성장인자가 높을수록 호르몬 치료 반응이 감소됨을 확인할 수 있었다. 이를 기반으로 bevacizumab과 호르몬 치료제를 병합하는 2상 연구로 안전성과 유효성을 입증하여 3상 연구가 진행되었다. 호르몬 수용체 양성 전이성 유방암 환자를 대상으로 letrozole 혹은 fulvestrant 단독과 bevacizumab 병합요법을 비교하였다. 2012년 San Antonio Breast Cancer Symposium에서 무진행 생존 기간의 향상(18.4개월 대 13.8 개월, 위험비 0.83)을 발표하였고 이후 추적 결과가 발표되어 이에 대한 추가 연구가 진행될 것으로 생각된다[47].
가장 최근에 발표되고 임상에서 사용되는 사이클린 의존성 키나아제 4/6 억제제(cyclin-dependent kinase 4/6 inhibitor, CDK 4/6 inhibitor)는 암세포 분열과 성장을 조절하는 세포주기 G1 주기에서 CDK 4/6를 선택적으로 억제함으로써 암세포의 증식을 막는 역할을 한다. PALOMA-1 연구[48]는 전이성 유방암 여성의 초치료로 letrozole과 palbociclib (CDK 4/6 inhibitor)의 병용 효과를 비교한 연구이다. Palbociclib 125 mg을 경구로 21일간 투여, 7일 휴약의 병용치료를 letrozole 단독요법과 비교 결과 무진행 생존 기간(20.2개월 대 10.2개월)이 2배 정도 연장되었고 객관적 반응률 또한 병용군(55% 대 39%)이 높게 나타났다. 또한 폐경 전 후의 전이성 유방암 환자의 2차 치료로서 고용량 fulvestrant와 병합에서도 무진행 생존 기간의 연장 효과(9.2개월 대 3.8개월)가 입증되었다[49]. 하지만 3등급 이상의 백혈구감소증이 절반 이상의 환자에서 발생하는 부작용이 나타나 사용시 주의를요한다[48].
결 론
전이성 유방암의 치료는 환자의 상태, 전이 부위, 암세포의 분자생물학적 특징에 따라 치료법을 선택한다. 전체 환자의 60-70%를 차지하는 호르몬 수용체 양성 환자는 항암화학요법뿐 아니라 호르몬 치료라는 효과적이며 부작용이 적은 치료제를 사용할 수 있는 장점이 있다. 이러한 호르몬 치료제는 치료율 증대와 암의 진행을 최대한 지연시킴으로써 환자의 삶의 질 측면에서 매우 유용하므로 적극적으로 이용해야 하겠다. 최근에 호르몬 치료제의 내성 기전에 대한 활발한 연구가 진행됨에 따라 다양한 표적치료제와의 병합치료가 확대되고 이를 임상에서 적용할 기회가 늘어나는 추세다. 향후 분자생물학적 특성 및 유전자 아형에 따른 치료제를 개발하기 위한 연구가 지속되어 전이성 유방암 환자들의 생존율 향상에 기여할 것으로 기대된다.