관류 장애 하행 대동맥박리에서 굴뚝술을 통한 대동맥 스텐트 이식편 치료
Thoracic Endovascular Repair by Chimney Technique for Aortic Dissection with Malperfusion Syndrome
Article information
Abstract
관류 장애 증후군이 동반된 근위부 거치 부위가 짧은 B형 급성 대동맥박리에서 수술적 교정 대신 경피적으로 주 스텐트 이식편을 삽입하고 굴뚝술을 이용하여 짧은 거치 부위를 극복하였으며 관류가 저하된 각 분지혈관으로 개별적 스텐트를 삽입하여 좋은 결과를 얻었기에 보고하는 바이다.
Trans Abstract
A perfusion deficit of the aortic branch vessels in a patient with a type B aortic dissection is a challenging complication, as it leads to hemodynamic instability and doubles the mortality rate; however, the optimal management strategy in these cases remains controversial. Although surgical repair is still performed as the standard, endovascular approaches have been used recently as alternatives because of the high rate of perioperative complications. Herein, we report a patient with a type B aortic dissection and compromised renal and iliac arteries who was successfully treated by thoracic endovascular repair and insertion of a percutaneous stent. In addition, we adopted the chimney technique to preserve blood flow to the left subclavian artery due to the short proximal landing zone.
서 론
하행 대동맥에 국한된 B형 대동맥박리는 합병증을 동반하지 않은 경우 수축기 혈압의 조절과 대동맥 벽에 전달되는 부하(dP/dt)의 감소를 목표로 하는 내과적 치료가 원칙이다[1]. 그러나 지속성 혹은 재발성 통증, 대동맥 확장 또는 진행성 박리 등이 동반되면 내과적 치료만으로는 예후를 불량하게 만들 수 있어 수술적 또는 경피적 혈관성형술을 이용한 교정을 시도하게 된다[1,2]. 특히 본 증례 환자의 경우와 같이 주요 혈관의 다발적 폐색으로 말초 장기 및 사지 허혈이 동반된 경우라면 향후 심각한 후유증이 예상되므로 즉각적인 관류가 요구된다. 이러한 상황에서 지금까지는 수술적 교정이 치료의 근간을 이루고 있으나, 수술 후의 높은 사망률이 보고되었고 분지혈관들을 각각 대동맥에 연결해야 하는 기술상의 어려움이 있을 수 있으며 전신적인 컨디션 저하로 수술 자체의 고위험군에 속하는 등의 문제로 최근에는 스텐트 이식편(stent graft)으로 유입열상(entry tear)을 막고 분지혈관에 스텐트 시술을 통하여 분지혈관의 관류를 개통시키고자 하는 노력이 시도되고 있다[1-3]. 본 증례의 B형 대동맥박리는 좌쇄골하동맥 직하방부터 시작된 광범위한 병변이 관찰되었고, 근위부 거치 부위(landing zone)는 짧았으며 우측 신장 및 양측 장골 동맥을 침범하여 관류 장애 현상(malperfusion syndrome)을 동반하고 있었다. 저자들은 짧은 스텐트 이식편 거치 부위를 극복하기 위하여 굴뚝술(chimney technique)을 적용한 경피적 분지혈관 및 대동맥내 스텐트 이식편 삽입으로 성공적인 관류를 경험하였기에 이를 보고하는 바이다.
증 례
74세 여자가 4일 전부터 시작된 흉통 및 배부 방사통을 주소로 응급실로 내원하였다. 30년간의 흡연력 및 음주력이 있었으나 그 밖의 특이 과거력이나 가족력은 없었다. 생체 징후는 혈압 180/90 mmHg, 맥박 69회/분을 보였다. 생화학 검사에서 Hb 11.8 g/dL, blood urea nitrogen 15.8 mg/dL, creatinine 1.48 mg/dL였고 심전도 및 흉부 X선 검사에서 특이 소견은 관찰되지 않았다. 응급으로 시행한 컴퓨터단층촬영 결과, 좌쇄골하동맥(left subclavian artery) 직하방 근처의 대동맥궁부터 양측 총장골동맥(common iliac artery)까지 침범한 광범위한 B형의 대동맥박리가 관찰되었다(Fig. 1A and 1B). 우측 신장동맥(right renal artery)은 진강(true lumen)에서 기시하나 내막판(intimal flap)의 역동적 폐쇄로 관류에 장애를 유발하고 있었고 이로 인해 우측 콩팥의 조영 결손이 관찰되었다. 양측 족배동맥의 맥박은 잘 촉지되었으므로 우측 신장동맥만 경피적 스텐트 삽입을 시행하고 나머지 병변에 대해서는 베타차단제를 기반으로 한 약물 치료를 병행하면서 경과 관찰을 하기로 결정하였다. 좌측 총대퇴동맥을 경피적으로 천자한 후 8 Fr sheath를 삽입하고 8 Fr RDC (guiding catheter, Cordis, Miami, FL, USA)를 우측 신장동맥 기시부에 위치시켰고 0.014 inch guidewire를 진입시킨 후 풍선도자 확장술 후에 Hippocampus 풍선팽창형 스텐트(5 × 24 mm, Medtronic, Roncadelle, Italy)를 우측 신장동맥에서 가강을 가로질러서 대동맥내의 진강으로 연결되도록 대동맥 안으로 충분히 빼내어 가교가 되도록 삽입하였고, 우측 신장동맥의 혈류 회복을 확인하였다(Fig. 2). 이후 환자는 소변량이 유지되고 안정된 상태를 보였으나, 입원 5일째 갑작스런 양 하지 저림을 호소하였고 양측 족배동맥의 맥박은 거의 촉지되지 않았으며 피부색의 변화가 관찰되었다. 당시 혈압은 135/70 mmHg, 맥박 55회/분으로 확인되었다. 즉시 컴퓨터단층촬영을 재시행하였고 내막판의 역동적 폐쇄 및 혈전이 진행하여 가강에 의하여 진강이 눌려서, 신장동맥 하부의 대동맥과 양측 총장골동맥의 혈류가 거의 차단되어 말초 관류 장애를 보이고 있었고 하행 대동맥 주변에 혈종으로 생각되는 음영이 증가하여서 응급으로 경피적 혈관내 대동맥 스텐트 이식편 삽입술을 시행하기로 결정하였다(Fig. 1B-1F). 내막 유입열상(intimal tear) 부위를 스텐트 이식편으로 덮어서 진강에서 가강으로 가는 혈류를 막아서 총장골동맥의 완전 폐색된 혈류를 복원하고자 하였다. 이 환자는 내막판 파열 부위가 좌쇄골하동맥에서 5-7 mm 아래에 위치하여서 스텐트 이식편 시술을 위한 최소한의 근위부 거치 부위가 15 mm 미만이고 중풍과 사지마비를 야기할 수 있는 좌척추동맥이 우세한(left vertebral artery dorminent system) 환자여서 스텐트 이식편이 좌쇄골하동맥의 혈류를 차단하는 경우에는 굴뚝술을 사용하여 스텐트 이식편을 시술하기로 결정하였다. 우측 대퇴동맥은 가강에서 기시하고 좌측 대퇴동맥은 진강에서 기시하여 진강으로 스텐트 이식편을 진입시키기 위하여 좌측 총대퇴동맥 및 좌상완동맥을 경피적으로 천자한 후 각각 7 Fr 및 6 Fr sheath를 삽입하였다. 좌상완동맥은 굴뚝술을 시행하는 경우에 준비하기 위하여 천자하였다. 좌측 총대퇴동맥을 통하여 0.035 inch Lunderquist extrastiff 유도철선(Cook Inc, Bloomington, IN, USA)을 상행 대동맥에 위치시켰고, 좌상완동맥을 통하여 marked pigtail 유도관(Cordis, Miami Lakes, FL, USA)을 대동맥궁의 좌쇄골하동맥 분지부까지 진입시킨 후 조영술을 시행하였다(Fig. 3A). 대동맥박리의 근위부는 좌쇄골하동맥 직하부까지 진행되어 있어 스텐트 이식편 삽입시 근위부 거치 부위가 짧을 것으로 평가되었으며 좌척추동맥은 크기가 큰 좌척추동맥이 우세한 형태(left vertebra artery dorminent system)였다(Fig. 3B). 순차적으로 큰 sheath를 사용하여 좌대퇴동맥을 확장시켜 18 Fr sheath로 변경한 후 SEAL 스텐트 이식편(40 × 150 mm and 38 × 150 mm, S&G biotech, Seongnam, Korea) 2개를 겹쳐서 삽입하였고 근위부는 좌쇄골하동맥 직하부에 맞추려고 시도하였다(Fig. 3C). 혈관조영술 확인시 스텐트 이식편으로 유입열상은 완전히 덮여 있었다. 그러나 좌쇄골하동맥의 기시부가 스텐트 이식편에 의하여 대부분 덮여 좌척추동맥의 관류를 방해할 것으로 판단되었으므로, 굴뚝술(chimney technique)을 적용하기로 하였다(Fig 3D). 좌상완동맥을 통해 좌쇄골하동맥에서 대동맥궁으로 pigtail 유도관을 0.035 inch Terumo 유도철선(Terumo, Tokyo, Japan)으로 바꾼 후 SEAL 스텐트 이식편(12 × 70 mm, S&G biotech, Seongnam, Korea)을 대동맥 스텐트 이식편과 나란히 굴뚝술을 사용하여 거치하였고 이후 시행한 조영술상 누출(endoleak) 없이 혈류는 잘 유지되고 있었다. 사용한 스텐트 이식편이 스텐트 이식편 본래의 크기로 저절로 복원력을 가지는 nitinol로 제작된 것이어서 추가적인 풍선확장술은 없이 굴뚝술은 시술되었다(Fig. 3E). 하지혈류의 개선을 보기 위하여 스텐트 이식편 시술 후 15분 뒤 찍은 대동맥조영술에서, 좌측 총장골동맥의 가강에 의한 폐색은 80% 정도의 잔여 협착이 남았었고, 우측 총장골동맥은 완전폐색을 보이고 있었다(Fig. 3F). 양측 총장골동맥의 혈류를 복원하기 위하여 5 Fr multipurpose 유도관(A&A MD, Seongnam, Korea)과 0.035 inch Terumo 유도철선(Terumo, Tokyo, Japan)을 삽입하였다. 좌측 총장골동맥의 진강은 협소하였으나 큰 저항 없이 유도철선을 진입하였으며, 완전폐색을 보인 우측 총장골동맥에 입구 부위에 유도관을 위치시켜서 유도철선과 함께 가볍게 밀자 쉽게 우측장골동맥의 진강으로 진입이 가능하였고, 진입된 유도관을 통하여 조영제를 주입하였을 때 진강혈류의 일부를 확인할 수 있었다. 유도철선을 우측 얕은 대퇴동맥(right superficial femoral artery)까지 진입시킨 다음 양측 총장골동맥까지 Fox Cross 풍선도자(4 × 40 and 6 × 40, Abbott, Beningen, Switzerland)로 확장시켰고, Absolute Pro 자가팽창형 스텐트(10 × 100 and 10 × 80, Abbott, lakeside Drive Santa Clara, CA, USA) 두 개를 양측 총장골동맥에 각각 삽입하였다(Fig. 3G). 이후 촬영한 조영술상 누출 소견 없이 총장골동맥의 관류가 회복된 소견이 관찰되었다(Fig. 3H). 환자는 입원 19일째 합병증 없이 퇴원하였고, 퇴원 2개월 및 10개월째 시행한 컴퓨터단층촬영상 흉복부 대동맥의 진강 혈류가 잘 유지되어 있고 가강은 폐쇄되었으며, 우측 신장동맥과 좌쇄골하동맥 및 양 하지의 혈류도 유지되는 소견을 보였다(Fig. 4). 크레아티닌 수치는 0.8-1.2 mg/dL로 정상 수준에서 유지되었다. 환자는 12개월이 지난 현재까지 증상 재발 없이 추척 관찰 중이다.
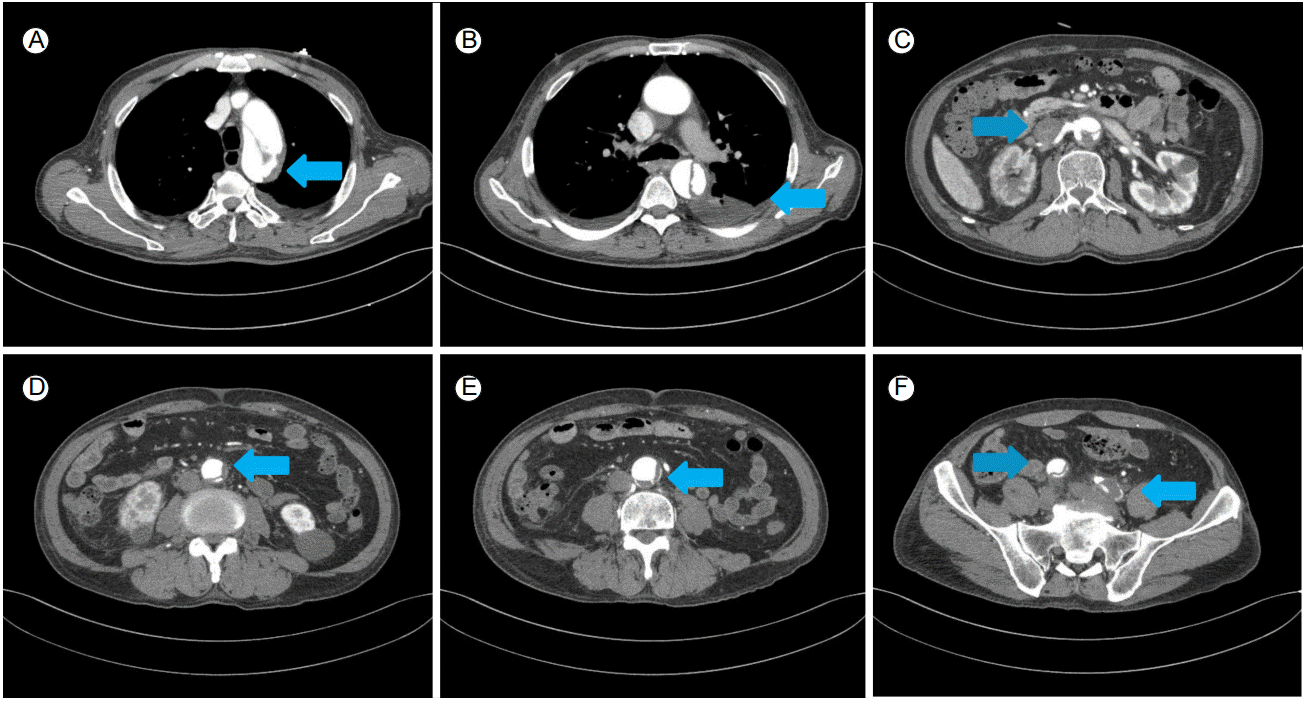
Contrast-enhanced computed tomography (CT) scan shows aortic dissection extending from the left subclavian artery (arrows in A) to both common iliac arteries (arrows in D-F). Hematoma around the dissected lesion is noted (arrow in B). Right renal stent is shown in the right renal artery (arrow in C).
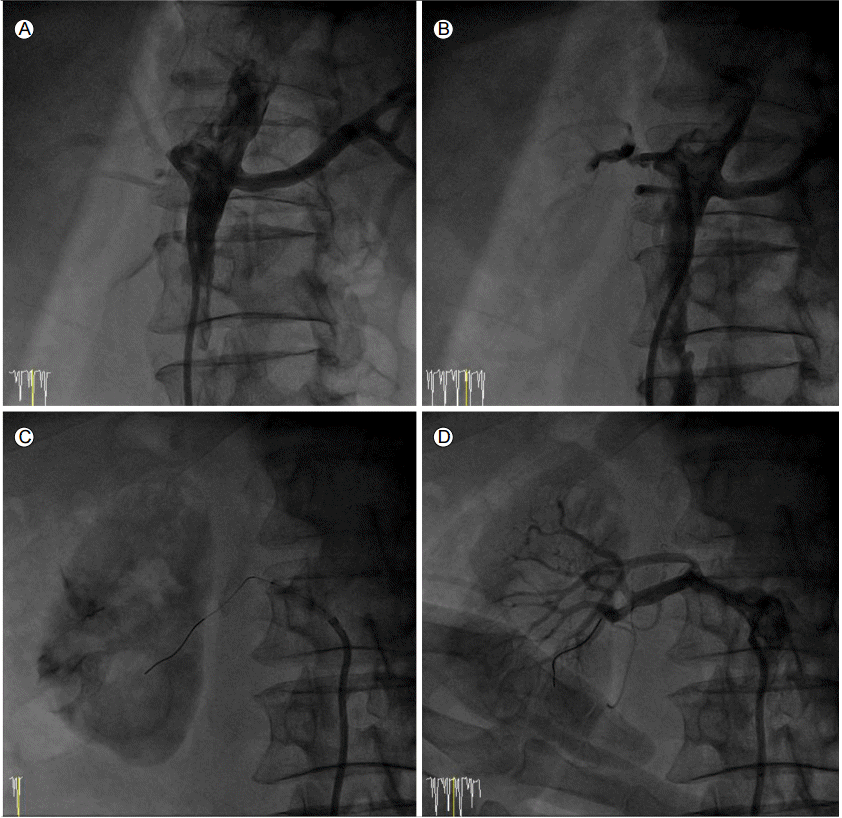
Procedural steps for stenting a compromised right renal artery. Aortography before the procedure shows compromised right renal artery (A). A guiding catheter was positioned near the ostium of the right renal artery (B). Pre-dilatation was achieved with a 4 × 40 mm Aviator balloon (C). A 5 × 24 mm hippocampus stent was implanted, and the right renal artery was recanalized (D).

Procedural steps for endovascular aortic repair using the chimney technique. Aortography before deploying the stent-graft (A). The stent-graft was advanced from the left femoral artery to the aortic arch. The stent-graft was positioned at the aortic arch, and a pigtail catheter was advanced into the aortic arch from the left subclavian artery (C). Aortography after deploying the stent-graft. The proximal entry tear was completely covered, but the proximal part of the stent-graft was almost totally covered by the ostium of the left subclavian artery. Arteriography shows the left dominant vertebral artery, which originated from the left subclavian artery (B). An additional stent-graft was inserted at the left subclavian artery through a left brachial approach using the chimney technique (D). Final aortography shows no endoleak (E). Right common iliac artery was totally occluded due to the dissected flap (F). Blood flow through the true lumen was noted when the catheter was advanced into the ostium. The 10 × 100 and 10 × 80 mm Absolute Pro stents were deployed at the right and left common iliac arteries, respectively (G). Final aortography shows good flow from the aorta to both femoral arteries (H).
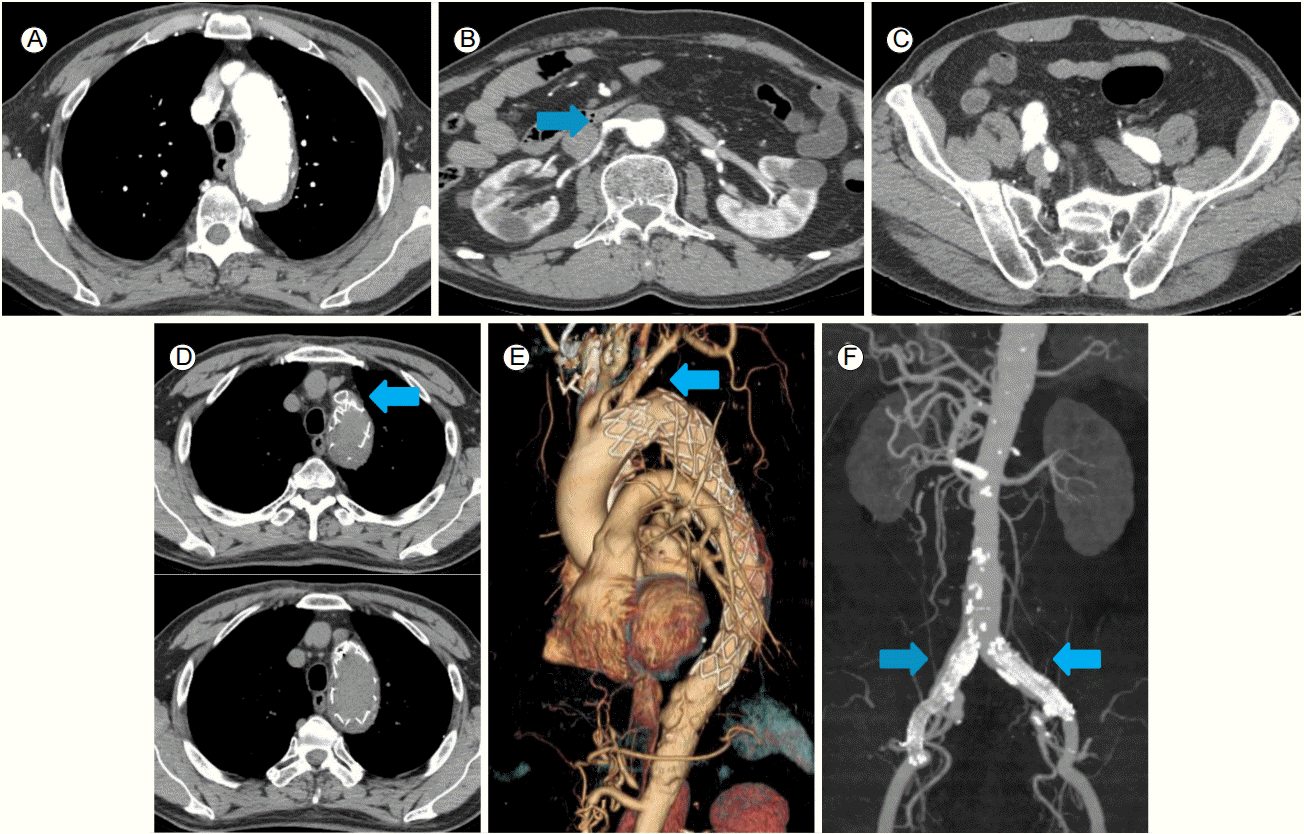
Follow-up contrast-enhanced computed tomography scan 10 months after the procedure. Well-deployed stent-grafts are shown at the aortic arch (A, D, and E) and left subclavian artery (arrows in D and E). Stents inserted into the right renal artery (arrow in B) and both common iliac arteries (arrows in F) were intact and completely recanalized.
고 찰
급성 B형 대동맥박리 환자 중 박리가 대동맥 벽을 따라 파급되어 주요분지를 침범함으로써 야기되는 관류부전증후군은, 약 15-42%의 비율로 드물지 않게 동반되며 침범 혈관에 따라 급성 신부전, 장간막허혈 및 괴사 또는 하반신 마비 등을 야기하여 사망률을 60% 이상 높이는 것으로 보고되고 있어 즉각적인 관류가 요구된다[1,2]. 이러한 경우 수술적 치료가 우선적으로 이루어지고 있으나 분지혈관의 관류시까지 시간이 많이 소요되고 개복 또는 개흉, 심장 외 순환 및 대동맥 차단이 불가피하며 이미 수술 고위험군에 속하는 경우가 많아 술 후 초기 사망률은 30-80%로 높게 보고된다[2,3]. 이에 따라 최근에는 혈관내 중재시술(endovascular treatment)을 통한 치료가 그 대안으로 시도되고 있는데 현재 사용되는 기법으로 스텐트 이식편의 삽입(stent graft), 창냄술(fenestration) 그리고 분지혈관의 개별적 스텐트 삽입(selective stenting)이 있으며, 분지혈관으로의 혈류가 진강과 가강의 어느 쪽과 연결되어 있는지 등의 해부학적 구조를 면밀히 파악하여 방법을 선택해야 하며 개별적 환자 상태에 따라 이들 중 두 가지 이상의 조합을 이용하기도 한다[4,5]. 이 중 스텐트 이식편의 경우 진강에 삽입하여 유입 열상을 막아 진강을 확장시킴으로써 역동적 폐쇄로 인한 분지혈관의 관류를 회복시키는 것이 목표이며 주요 분지혈관이 진강에서 기시하는 경우 유용하게 이용될 수 있다. 이 방법은 또한 가강의 혈전 형성을 촉진하며 대동맥의 재형성 (remodeling)을 유도한다는 점에서 가장 이상적인 방법이라 할 수 있겠다[4,6]. 그러나 분지혈관의 혈류가 가강에서 일부 또는 전부 나가게 된다면 스텐트 이식편의 삽입만으로는 분지혈관으로의 혈류를 보존할 수 없게 되는데, 만일 분지혈관이 진강과 가강 모두에서 혈류를 공급받는 경우 진강과 가강 사이의 내막을 needle을 사용하여 통과시킨 후 유도철선을 보내고 큰 크기의 풍선도자를 사용하여 진강과 가강 사이의 혈류를 통하도록 개통시킴으로써 관류를 유지하고자 하는 창냄술을 적용할 수 있다. 그러나 분지혈관의 혈류가 약한 경우 혈류 흐름이 충분하지 못할 수 있고 장기적으로 보았을 때 원위부 내막판으로 인한 말초 색전이나 동맥류를 형성할 가능성이 높은 단점이 있다[1,7]. 개별적 스텐트 삽입법은 분지혈관의 정적 폐쇄에 의한 관류 저하나 내막판의 박리에 의해 분지부와 대동맥 진강 사이가 분리된 경우에 분지혈관과 대동맥 진강이 연결될 수 있도록 가교를 만들어주는 방법인데 스텐트의 혈전이나 재협착 등의 장기적 성적에 대해서는 좀 더 많은 연구가 필요하다[1,5].
본 증례에서는 우측 신장동맥의 혈류복원을 위하여 개별적인 스텐트를 삽입하였고, 좌쇄골하동맥 유입열상의 시작 부위부터 횡격막 위치의 대동맥까지 스텐트 이식편을 시술하여서 진강에서 가강으로 가는 혈류를 막아서 진강의 혈류를 복원시켰고, 분지혈관에 혈류가 복원되기를 15분 정도 기다렸다. 그러나 하행대동맥의 진강 혈류는 회복되었으나 가강에서 혈류를 공급받는 우측 총장골동맥은 완전폐색을 보이고 있었고 좌측 총장골동맥은 80% 정도의 잔여 협착이 남아서 양측 총장골동맥에 각각 개별적인 스텐트를 삽입하였고 조영술상 성공적인 관류를 확인하였다. 우측 신장동맥과 우측 총장골동맥처럼 완전폐색을 보이는 혈관도 실제는 가강에 의하여 눌려진 것이므로 유도철선이 쉽게 통과되어 스텐트의 삽입은 쉽게 되었다. 스텐트 이식편으로 대동맥 근위부의 유입열상을 막아도 원위부에 유입열상이 추가로 있는 경우가 많으므로 증례처럼 하부의 총장골동맥 등의 혈류는 회복되지 않아서 추가로 스텐트 시술을 하는 경우도 많다.
증례에서와 같이 대동맥궁을 침범한 대동맥박리의 경우 고전적으로 수술적 교정이 우선시되어 왔으나 술 후 합병증 발생의 위험이 높아 최근에는 혈관내 중재 시술을 통한 교정이 시도되고 있다[8]. 그러나 대동맥궁에 상지와 두뇌로 향하는 주요 분지 동맥이 위치하고 있어 시술시 스텐트 이식편의 적절한 근위부 거치 부위를 확보하기가 쉽지 않을 뿐만 아니라 분지혈관의 관류 저하에 따른 상지 허혈이나 뇌졸중, 사지마비 등의 주요 합병증 발생의 위험이 높아 시술시 정확한 해부학적 분석이 요구된다. 짧은 근위부 거치 부위를 극복하고 대동맥궁의 주요 분지 혈류를 보존하기 위해 최근 창냄형(fenestrated)이나 분지형(branched) 스텐트가 개발되었으나 아직 한계가 많아 임상적으로 널리 도입되기까지는 좀 더 많은 연구가 필요하겠다[8,9]. 이러한 상황에서 적용할 수 있는 방법이 굴뚝술(chimney technique)인데, 대동맥궁에 스텐트 이식편을 삽입한 다음 주요 분지혈관에서 대동맥궁으로 미리 진입시켜 둔 유도철선을 따라 추가적인 스텐트 이식편을 삽입하는 방법이다[10]. 본 증례에서처럼 근위부 거치 부위가 좌쇄골하동맥에서 15 mm 이상 확보가 어려운 경우에, 2010년 가이드라인에 따르면 응급환자가 아닌 정규시술인 경우에는 뇌혈관조영을 통해 척추동맥의 주행을 확인하여 우회순환이 좋지 않거나 좌측 우세 척추동맥일 경우 좌경동맥에서 좌쇄골하동맥으로 연결하는 수술(left carotid artery to left subclavian bypass operation)을 병행하는 하이브리드 술식이 권유된다[1]. 그러나 응급으로 시술을 시행하게 되는 경우라면 좌쇄골하 동맥을 희생시키거나, 좌쇄골하 동맥의 혈류를 보존하기 위하여 굴뚝술을 시도해 볼 수 있다. 본 증례의 경우에는 스텐트 이식편 근위부 거치 부위가 15 mm 이하이고, 좌척추동맥이 우세하여 좌쇄골하동맥을 희생시키는 것은 중풍의 위험성이 증가하여서 대동맥 스텐트 이식편과 나란히 좌쇄골하동맥에 스텐트 이식편이 시술되었고 좌척추동맥을 스텐트 이식편이 막지 않도록 주의하면서 시술되었다. 본 증례에 사용된 스텐트 이식편의 골격은 스텐트 모양으로의 복원력을 가지는 nitinol로 되어있어서 추가적인 풍선확장술 없이 endoleak가 없는 것을 확인한 후 시술을 마쳤다. 그러나 스테인리스(stainless steel)로 만든 스텐트 이식편의 경우 스텐트 모양을 만들기 위한 추가적인 풍선확장술이 필요하다. 추가적인 풍선확장술을 시행할 경우에는 대동맥의 압력으로 인하여 대동맥의 스텐트 이식편의 이동이 일어나는 경우도 가끔 있으므로 주의가 필요하다.
굴뚝술의 경우 좌경동맥에서 좌쇄골하동맥으로 연결하는 수술 없이 두 개의 스텐트 이식편을 나란히 시술할 수 있는 장점이 있다. 그리고 스텐트 이식편 시술 시에 우연히 경동맥, 좌쇄골하 동맥을 막았을 때 응급으로 이 혈관들을 보존하기 위하여 시술이 가능하다. 그러나 장기간 추적 관찰한 논문에 따르면 굴뚝술의 경우 뇌졸중 발생의 위험이 3-10%로 높고 대동맥궁과 분지혈관의 스텐트 이식편이 평행하게 놓임으로써 약 18%에서 누출(endoleak)이 발생하는 것으로 보고되고 있어 시술 후에도 세심한 관찰이 요구되고 적절한 환자의 선택이 중요할 것으로 생각된다[9,10].
본 증례는 B형 급성 대동맥박리 환자에서 근위부 거치 부위가 5-7 mm로 짧고 좌측우세 척추동맥을 가진 환자였고 우측 신장동맥 및 양측 총장골동맥의 분지혈관의 관류 저하가 동반된 경우이어서 경피적으로 굴뚝술을 사용한 스텐트 이식편을 시술하여 좌쇄골하동맥과 좌측 척추동맥의 혈류를 보존하였고, 개별 혈관 스텐트 삽입으로 우측 신장동맥과 양측 총장골동맥의 관류에 성공한 좋은 결과를 얻었다.