HIV 감염 진단의 최신 지견
Update on Laboratory Testing for Diagnosing HIV Infection
Article information
Trans Abstract
Generally, laboratory testing for human immunodeficiency virus (HIV) is done for three reasons: for individual diagnosis and clinical management; to ensure the safety of blood or tissue products; and for public health surveillance. Many HIV-infected patients are unaware of their infections. The early diagnosis of infection is critical for medical and public health reasons. Its diagnosis is a two-step process that requires the sequential use of a highly sensitive screening test, followed by a highly specific confirmatory test. HIV-testing technology continues to evolve, with various tests currently available. This article reviews the current status of and recent advances in HIV testing.
서 론
국내에는 1985년 이래로 2014년까지 누적으로 총 11,204명이 사람면역결핍바이러스(human immunodeficiency virus, HIV)로 진단받았으며 2013년 이후로는 매년 1,000명 이상의 HIV 감염 환자가 발생되고 있다[1]. 미국에서 시행된 한 연구에서는 미국 HIV 감염자의 약 21%는 HIV로 진단되지 않은 채로 살아가고 있다고 보고되었다. 또한 HIV 감염으로 진단된 환자의 약 반수가 처음 병원을 방문하였을 때의 CD4+ 세포수가 200 cell/µL 미만이며, 병원을 다니는 환자의 1/3은 추적 소실된다고 보고하였다[2]. 국내에는 자료가 부족하지만, 한 연구에 의하면 처음 병원을 방문한 환자의 약 51%가 CD4+ 세포수가 200 cell/µL 미만이며 이 중 약 33%는 추적이 되지 않는다고 보고하여 미국과 유사한 추세를 보였다[3,4]. 환자의 진단이 늦어져 HIV 감염을 모르고 살아가는 기간이 길거나 병원에서 추적 소실되면 그 기간 동안 HIV를 타인에게 전파시킬 위험성이 증가한다. 또한 최초 감염 후 급성기 동안 HIV 환자는 전염력이 매우 높은 시기이지만 항체 검사가 음성으로 나오므로 조기 진단이 어렵다. HIV 진단은 환자를 조기에 진단하고 치료하는 것 외에도 역학적 감시나 헌혈공여자 선별 검사를 위해서도 중요하다. 본 종설에서는 HIV 진단을 위한 선별 검사 및 확진 검사 그리고 최근 국내 지침에 대해 알아보고자 한다.
HIV 분류 및 면역 반응
HIV는 HIV-1, HIV-2 두 가지 유형으로 분류된다. HIV-1은 침팬지 또는 고릴라로부터 HIV-2는 검댕맹거베이(sooty mangabeys)로부터 사람에게 따로따로 전파된 것으로 여겨지고 있다[5]. HIV-1은 다시 M, N, O, P 4개의 군으로 나뉜다. 현재 전 세계적인 acquired immune deficiency syndrome (AIDS) 유행은 주로 HIV-1 M군에 의해 일어나고 있다. HIV-2는 전 세계에서 보고되고 있지만 소수이며 주로 서아프리카에 국한되어 유행하고 있다. HIV-1 M군에는 여러 가지 아형이 있으며 지역마다 유행하는 아형이 서로 다르다. 아형 C는 사하라 이남 아프리카, 인도 등에서, 아형 CRF01_AE는 동남아에서 가장 흔하다. 반면, 미국, 유럽, 호주 등 서부 선진국에서는 아형 B가 가장 흔히 발견된다[5]. 우리나라에서는 B형이 대부분을 차지하고 있다[6].
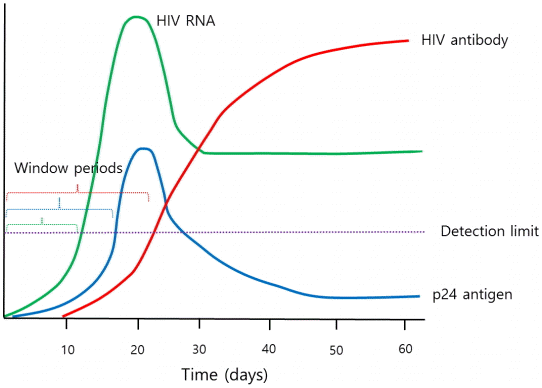
HIV 감염 후 HIV에 대한 항체는 대게 감염 후 3-6주 이내에 나타나기 시작해서 12주 내에 거의 형성된다. 창기간(window period)은 HIV 감염 후부터 HIV 감염의 증거가 나타날 때까지 기간으로 정의된다. 이 시기는 전염력이 높지만 진단이 잘 되지 않는 보건학적으로 매우 취약한 시기이다. 창기간은 검사 방법에 따라 다르며 기술의 발달로 창기간은 점점 줄어들고 있다. 초창기 항체 검사로는 창기간이 약 2개월로 길었지만, 3세대 항체 검사는 22일, P24 항원 검사는 16일, 핵산 검사로는 10-14일까지 줄어들게 되었다(Fig. 1) [7].
선별 검사
HIV 진단을 위한 선별 검사로는 효소결합면역흡착측정법(enzyme-linked immunosorbent assay, ELISA)이 주로 이용된다. 1985년 최초로 HIV ELISA 검사가 미국식품의약국(FDA) 승인을 획득해 헌혈 공여자의 선별 검사와 에이즈 역학 조사에 이용되었다[8]. 이러한 1세대 HIV ELISA 검사에서는 감염된 세포 용해물을 사용하였다. 2세대 HIV ELISA에서는 재조합 항원 및 합성 펩티드를 사용함으로써 검사의 민감도가 향상되었고 위양성률이 감소되었다. 그 후, 1989년 p24 항원 검출법이 FDA로부터 승인되었고 1991년부터는 HIV-2 항원이 HIV ELISA 검사에 포함되었다. 이러한 초기 HIV ELISA 검사는 주로 서구에 흔한 아형 B를 검출하기 위해 개발되었고 개발도상국 및 후진국에 더 흔한 non-B 아형에는 민감도가 낮았다. 그 후, 효소에 연결된 HIV 항원을 이용한 샌드위치항체법을 이용한 3세대 HIV ELISA가 개발되어 민감도 및 특이도가 현저히 향상되었고 창기간도 줄어들었으며 non-B 아형도 더 잘 검출할 수 있게 되었다. 2001년 핵산법이 헌혈공여자 선별에 승인되었고 창기간이 더 줄어들었다. 3세대 HIV ELISA에 p24 항원을 결합한 4세대 HIV ELISA가 2010년에 FDA 승인을 획득하였다[9,10]. 현재 주로 사용되는 4세대 HIV ELISA는 항체 생성 전이라도 p24 항원만 양성이면 양성으로 나오므로 창기간을 더 줄일 수 있게 되었다.
통상 사용되는 ELISA 검사는 검체를 검사실로 보내서 검사실 장비를 이용해 검사하므로 검사 과정이 복잡하고 결과가 나오기까지 시간이 걸린다. 이러한 단점을 보완하기 위해서 쉽고 빠른 신속 검사들이 개발되었다. 신속 검사법들은 진료현장에서 추가 장비 없이 시행할 수 있고 대게 15-30분 이내에 신속히 결과를 알 수 있어 신속한 결과가 필요한 상황에서 유용하지만 민감도가 더 낮거나 창기간이 더 길 수 있다. 혈액을 이용한 검사의 단점 때문에 타액, 정액, 소변 등 다양한 다른 검체를 이용한 검사법이 개발되고 있다[11]. 구강점막 검체를 이용한 신속항원 검사(Oraquick®, OraSure Technologies Inc., Bethlehem, PA, USA) 등은 가정에서 혼자 검사할 수 있으며 최근에는 쇼핑몰 등에서도 구입 가능하다. HIV 항체에 대한 입자응집 반응(particle agglutination assays)도 선별 검사로 이용할 수 있으며 ELISA보다 시행하기가 쉽고 장비가 적게 필요하여 자원부족국가에서 사용하기에 장점이 있다[12].
선별 검사에 이용되는 혈청 검사는 민감도와 특이도가 모두 높게 고안되지만 민감도가 높은 것이 더 중요하다. 음성인 경우를 양성으로 진단하는 위양성보다 양성인 경우를 음성이라고 진단하는 위음성의 영향이 더 크기 때문이다. 민감도와 특이도가 모두 높은 검사라도 위양성 및 위음성 결과는 생길 수 있다. 위음성의 가장 큰 원인은 초기 감염의 창기간에 있는 경우이다. 감염 후 일단 항체가 생기면 항체는 평생 지속되므로 만성 감염에서 위음성인 경우는 매우 드물지만 예외적으로 환자 상태가 너무 진행하여 항체역가가 너무 낮아 검출되지 못하는 경우, 항체가 생성되기 전에 급속히 진행하는 경우, 너무 빨리 항레트로바이러스 치료를 시작해서 항체 생성을 지연시키는 경우 등에 위음성이 나타날 수 있다. 위양성인 경우는 위음성인 경우보다 흔하며 검사 방법, 환자의 동반 질환 등 여러 가지 원인에 의해 생길 수 있다[13]. 만성 음주, 류마티스 질환 등의 만성 질환 외에도 뎅기열, 말라리아, B형 간염 등의 급성 감염이 동반된 경우에도 생길 수 있는 것으로 알려져 있다[14]. 민감도 및 특이도가 매우 높은 경우라도 양성예측도(검사 양성인 경우 중에서 실제 환자인 분율)와 음성예측도(검사 음성인 경우 중에서 실제 환자가 아닌 분율)는 유병률에 영향을 많이 받는다. 그러므로 우리나라처럼 HIV 감염 유병률이 낮은 국가에서는 양성예측도는 낮고 음성예측도는 높게 되므로 선별 검사에서 양성인 경우 중에 실제 환자의 빈도는 낮다.
혈청 검사 외에 HIV 진단을 위한 선별 검사로 사용되는 것으로는, p24 항원 검사, 핵산 검사 등을 이용할 수 있으며 선별 검사로는 ELISA 검사에 부가하여 사용된다. 핵산 검사는 HIV-1을 검출하기 위해 사용할 수 있으며, 혈청 검사에 비해 창기간을 줄일 수 있으나 숙력된 검사자가 필요하며 비용이 많이 드는 단점이 있다. 국내에도 2005년부터 헌혈 공여자의 선별 검사에 핵산증폭 검사를 이용하고 있다[15].
확진 검사
확진을 위해 가장 많이 사용되는 검사법은 웨스턴블롯 검사(western blot test)이며 99% 이상의 특이도를 가진다. 웨스턴블롯 검사는 서로 다른 분자량을 가진 여러 HIV 항원들이 각각 특정 항체를 생성하며 각각은 웨스턴블롯 상에서 각각의 밴드로서 나타나며 분자량에 따라 분리되는 것을 이용한다. 웨스턴블롯 상에 p24, gp41, gp120/160 세 가지 단백질에 대한 밴드가 하나도 나오지 않으면 음성, 2개 이상인 경우 양성, 그 중간인 경우 미결정으로 간주한다. 미결정으로 나오는 경우는 창기간이거나 HIV 단백 하나와 교차 반응을 보이는 항체를 가지는 경우이다. 후자는 주로 P24나 p55와 반응하는 항체이다. 웨스턴블롯 검사에서 미결정이면 4-6주 뒤에 재검사를 시행한다. 또 다른 확진 검사로는 HIV-1/HIV-2 구별 검사나 간접면역형광법 등이 있다.
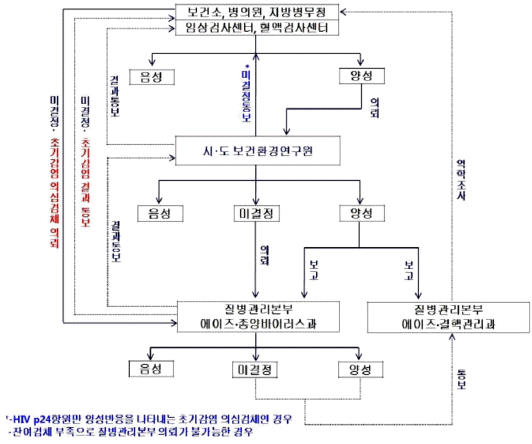
국내에서는 질병관리본부 국립보건연구원과 전국 17개 시․도 보건환경연구원에서 웨스턴블롯 검사로 확진 검사를 시행하고 있다[16]. 질병관리본부 HIV/AIDS 관리지침에 의하면 선별 검사에서 양성 반응이 나올 경우 관할 시․도 보건환경연구원으로 확진 검사를 의뢰할 수 있다. 확진 검사에서 미결정으로 통보되었거나, HIV 감염 산모로부터 태어난 18개월 미만의 신생아 및 유아의 검체, 선별 검사 결과는 음성이나 임상 소견에서는 HIV 감염이 의심되는 경우 등에는 질병관리본부로 직접 의뢰할 수 있다. 확진 검사에서 양성으로 나왔는데 환자가 재차 확인을 요구하는 경우에는 관할 시․ 도 보건환경연구원으로 확인 검사를 재의뢰할 수 있다. 후천성 면역결핍증은 법정전염병 3군에 속하며 의뢰한 환자가 확진이 되면 즉시 관할 보건소에 신고하여야 한다(Fig. 2) [16].
특수 상황
급성 HIV 감염은 전염력이 매우 높은 시기지만 항체가 생성되지 않는 시기이므로 진단에 어려움이 있다. 한 연구에 의하면 5일간은 핵산 검사는 양성, p24 항원 음성, ELISA 음성, 10.3일간 핵산 검사 및 p24 항원 양성, ELISA 음성, 13.5일간 핵산 검사, p24 항원, ELISA 모두 양성이나 웨스턴블롯 검사는 음성, 19.1일간 핵산 검사, p24 항원, ELISA 모두 양성이나 웨스턴블롯 검사 미결정의 경과를 거친다고 보고하였다[17]. HIV 감염 산모에서 태어난 아이는 산모로부터 태반을 통하여 HIV 항체를 받기 때문에 분만 후 18개월까지 항체 검사에서 양성으로 나올 수 있다. 주기적으로 혈청으로 aptima HIV-1 qualitative assay를 시행하거나 말초혈액단핵세포에서 DNA 중합효소연쇄반응 검사를 시행하는 것이 도움이 된다. 헌혈 전 공여자 선별 검사를 위해서는 HIV-1/ HIV-2 ELISA와 핵산 검사를 함께 시행한다. 모두 음성이면 공여가 가능하지만 하나라도 양성이면 두 번째 검사를 시행하여 모두 음성이면 음성으로 간주한다. 두 번째 검사에서 양성이면 양성으로 간주하고 확진을 위해 웨스턴블롯 검사를 시행한다[18].
결 론
HIV 환자를 조기 진단하는 환자의 치료 목적 외에도 전파 방지를 위해서도 매우 중요하다. 진단은 선별 검사와 확진 검사 두 단계로 이루어진다. 선별 검사는 다양한 방법이 있으나 HIV ELISA가 주로 사용된다. 최근에는 신속항원 검사 또한 이용되고 있으며 타액을 이용한 신속항원 검사는 집에서 자가 검사도 가능하다. 확진 검사는 웨스턴블롯 검사가 이용되고 있으며 질병관리본부나 시․ 도 보건환경연구원에 의뢰해서 시행할 수 있다.