MRSA에 의한 의료 관련 심내막염 1예
Healthcare-associated Endocarditis by PVL-negative ST 72 SCCmec Type IV MRSA
Article information
Abstract
본 증례는 감염성 심내막염으로 진단된 환자에서 CA-MRSA가 동정되었으며 분자형은 PVL 음성 SCCmec type IV A; the MLST ST 72; 1-4-1-8-4-4-3 MRSA clone이었다. 심내막염의 원인 병원체였던 MRSA는 지역사회가 아닌 병원에서 발생한 것으로 추정되며 vancomycin에 감수성이 있었음에도 치료 실패하여 linezolid로 변경하여 성공적으로 치료되어 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
The prevalence of community-associated methicillin-resistant Staphylococcus aureus (CA-MRSA) has been increasing worldwide. In Korea, the most common genotype of CA-MRSA is the Panton-Valentine leukocidin-negative, sequence type 72 Staphylococcal cassette chromosome (SCC) mec type IV clone. However, within Korean hospitals, this strain is still not commonly reported. In this study, we describe a case of infective endocarditis caused by Panton-Valentine leukocidin-negative MRSA (ST72-SCCmec type IV A clone). Infection occurred after open reduction and internal fixation due to a right humerus fracture with cerebral hemorrhage. Initially, the patient was treated with linezolid, but with the onset of severe thrombocytopenia, the patient was switched to vancomycin therapy.
서 론
메티실린내성 황색포도알균(methicillin‐resistant Staphylococcus aureus, MRSA)은 1960년대 처음 보고된 이후 의료 관련 감염의 중요한 원인균으로 잘 알려져 있다[1]. 그런데 최근 10여 년 전부터 지역사회관련 MRSA (community-associated MRSA, CA-MRSA)가 출현하기 시작하였고 발생빈도가 세계적으로 증가하고 있어 공중보건학적인 면에서 중요한 관심사로 대두되었으며[2,3], 최근에는 의료기관에서도 CA-MRSA의 분리건수가 점차 증가하는 추세이다[4]. 우리나라에서 가장 흔한 CA-MRSA의 유전형은 panton-valetine leukocidin (PVL) 음성 sequence type (ST) 72 staphylococcal cassette chromosome mec (SCCmec) type IV로 알려져 있으며 이로 의한 감염성 심내막염은 국내에서도 보고된 바 있으나 모두 지역사회에서 감염이 발생하였으며 vancomycin으로 치료된 증례들이다[5,6]. 저자들은 지역사회가 아닌 의료기관에서 PVL 음성 ST72 SCCmec type IV MRSA에 의하여 발생한 감염성 심내막염을 linezolid 투여로 치료한 증례를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
오른쪽 상완골골절로 수술 후 장기 요양병원으로 전원하여 지내던 90세 여자 환자가 전원 이틀 만에 발생한 38°C 이상의 발열과 의식 변화로 응급실을 통하여 입원하였다.
입원 당시 활력 징후는 혈압 130/80 mmHg, 심박수 92회/분, 호흡수 20회/분, 체온 38.7°C였다. 전원 전부터 호흡기증상이나 소화기증상은 없었으며 요로감염을 의심할 만한 증상이나 징후도 없었다. 신체 검사에서 의식이 명료하지 않았으나 혼미한 수준이었으며 청진에서 전수축성 심잡음이 심첨부에서 청진되었다. 환자는 한 달 전 오른쪽 상완골골절로 고정 수술을 받았으며 응급실로 전원 당시 수술 부위에서 발적과 화농성 삼출물이 관찰되었다.
검사실 검사에서 일반혈액 검사 결과 백혈구 20,710/mm3 (중성구 92.9%), 혈소판 160,000/mm3, 혈색소 13.7 g/dL였으며 C-반응성단백은 291 mg/dL로 상승되어 있었고 생화학 검사는 정상이었다. 소변 검사에서 현미경적 혈뇨가 관찰되었으나 농뇨는 없었다. 흉부영상 검사에서 폐렴이나 다른 감염 소견은 보이지 않았고 의식상태의 변화로 시행한 뇌 전산화단층촬영 검사에서 출혈 소견은 관찰되지 않았다. 입원 후 즉시 수술 부위에서 도말배양 검사와 혈액배양 검사를 3회 시행하였는데 모두 그람양성알균이 분리되었다. 경험적 항생제요법으로 수술 부위 감염에 의한 균혈증 그리고 심내막염을 의심하여 vancomycin (1.0 gm 12시간 간격 정맥주사)과 piperacillin/tazobactam (4.5 gm 8시간 간격 정맥주사)을 배양 검사 결과 확인 전까지 투여하였다. 한편, 경흉부 심초음파 검사에서 승모판에 11.2 × 12.2 mm 크기의 증식증(vegetation)이 관찰되었다(Fig. 1A). 이 환자의 경우 modified Duke’s definite criterion에 근거하여 혈액배양 검사 양성, 승모판의 증식증, 발열, 혈뇨, 수술 과거력 등이 해당되어 감염성 심내막염으로 진단하였다.
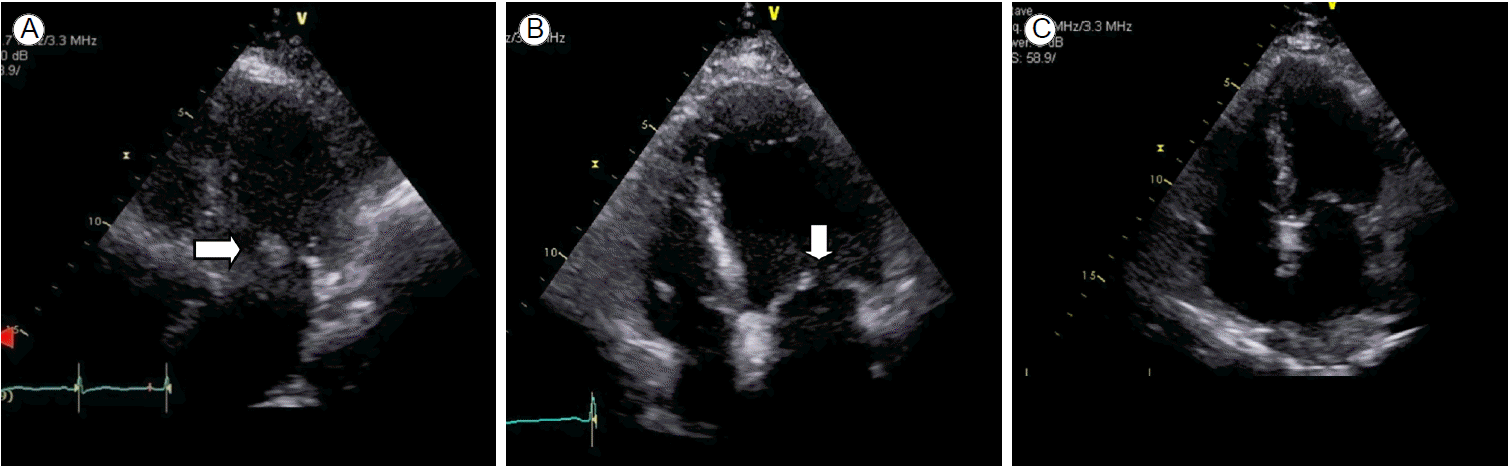
(A) Transthoracic echocardiographs (TTEs) depict a round-shaped mass (arrow) attached to the left atrium of the posterior leaflet/annular ring. Follow-up TTE display (B) decreased vegetation size (arrow) and (C) invisible vegetation.
환자의 혈액배양에서 동정된 그람양성알균은 MRSA로 보고되었으나 항생제감수성 검사 결과가 흔히 의료기관에서 분리되는 MRSA의 결과와 달랐다. 항생제감수성 결과 분석은 Microsacn Pos Breakpoint Combo Panel Type 28 (Siemens, Sacramento, CA, USA)로 실시되었는데 본 증례에서 동정된 MRSA는 oxacillin을 제외하고 gentamicin, ciprofloxacin, clindamycin, rifampicin, erythromycin, trimethoprim-sulfamethoxazole, teicoplanin, linezolid에 감수성을 나타냈으며 vancomycin의 최저억제농도(minimal inhibitory concentration, MIC)는 1 μg/mL 미만이었다. Vancomycin과 piperacillin/tazobactam 투여 4일째에 양측 다리에서 다발성 점상출혈이 나타났으며 손과 발바닥에 작은 출혈성 결절이 관찰되기 시작하였다. 발열이 지속되었으며 vancomycin의 혈중 최저 약물 농도(trough level)가 15 ug/mL로 적정 치료 농도가 유지되었음에도 vancomycin 투여 5일 이후에도 MRSA가 반복적으로 혈액배양 검사 3세트에서 분리되었는데 항생제감수성 검사 결과가 동일하였다. 또한, 환자의 의식이 더 혼탁해져 뇌 전산화단층촬영 검사를 추적한 결과 다발성 뇌출혈 및 지주막하출혈이 새롭게 관찰되었다. 한편, 안저 검사에서 안내염 소견은 없었다. 환자의 혈액배양 검사에서 동일한 균주가 항생제 투여 5일 이후에도 반복적으로 분리되었고 뇌출혈이 합병되어 임상적으로 vancomycin 치료 실패로 결론을 내리고 심내막과 뇌수막 통과율이 높은 것으로 알려진 linezolid (600 mg 12 시간 간격 정맥주사)로 항생제를 변경하였다. Linezolid 투여 5일째부터 혈액배양 검사에서 균 분리가 이루어지지 않았으며 환자의 임상증상과 활력 징후들이 호전되었다. 혈액배양 검사가 음전된 후 10일째 실시한 경흉부 심초음파 검사에서 증식증의 크기는 4.8 × 8.2 mm로 감소하였으며 뇌 전산화단층촬영 검사를 추적한 결과 다발성 뇌출혈 병변들의 크기도 감소하였다(Fig. 1B). 그러나 linezolid 투여 15일째에 혈소판감소증(32,000/mm3)이 발생하여 감염내과 전문의 3인이 논의한 결과 이전에 linezolid 투여를 중단하고 다시 vancomycin으로 변경하고 적정 trough level을 유지하도록 하였다. Vancomycin을 재투여하고 72시간 동안 환자의 임상경과는 안정적이고 검사실 검사 결과에서도 염증반응이 지속적으로 호전되는 소견을 보여 총 28일간 유지하였다. Vancomycin 중단 후 실시한 경흉부 심초음파 검사에서 증식증이 보이지 않았으며 경식도 심초음파 검사는 환자의 연령과 전신상태를 고려하여 시행하지 않았다(Fig. 1C). 한편 우측 상완골 수술부위에서 관찰되었던 염증반응은 linezolid와 vancomycin을 투여하는 과정에서 기구 제거나 다른 수술적 치료 없이 완전히 사라졌고 검사실 검사에서 acute phase reactant (erythrocyte sedimentation rate, C-reactive protein, procalcitonin) 등이 모두 정상 범위로 호전되었으며 vancomycin 중단 2주 후 정형외과 협진 과정에서 감염이 지속되거나 골감염이 합병되었을 가능성은 없는 것으로 판정하였다. 환자의 MRSA 균주의 분자유전학적 분류를 위해 중합효소연쇄반응(polymerase chain reation), multi-locus sequence typing (MLST)을 실시하였으며 그 결과 SCCmec type IV A, MLST allelic profile 1-4-1-8-4-4-3, ST72 clone으로 panton-valentine leukocidin 음성이었다(Fig. 2).

Multiplex PCR assay for SCCmec typing. PCR amplification with specific primers shows the presence of mecA and type IV SCCmec in the CA-MRSA isolate. M, DNA molecular size marker; L1, pta; L2, tpi; L3, ygil; L4, negative control; L5, arcc; L6, aroe; L7, glpf; L8, gmk. PCR, polymerase chain reation; SCC, staphylococcal cassette chromosome; CA-MRSA, community-associated methicillin-resistant Staphylococcus aureus.
고 찰
MRSA는 1960년대 항생제 저항성 균주들이 나타난 이후로 치료에 있어서 큰 도전이 되었고 전세계적으로 의료 관련 감염과 지역사회 관련 감염의 주요 원인균으로 대두되었다[1]. 일반적으로 CA-MRSA는 MRSA에 의한 의료 관련 감염의 위험인자가 없으며 입원 후 48시간 이내 획득된 균으로 정의하고 있지만[2] 외국의 경우 최근 의료환경에서 CA-MRSA와 같은 유전형의 MRSA에 의한 의료 관련 감염의 발생빈도가 점점 증가하고 있다. 우리나라에서 가장 흔한 CA-MRSA의 유전형은 PVL 음성 ST72 SCCmec type IV로 알려져 있으며 이 균주에 의한 감염성 심내막염의 경우 이미 국내에서 보고된 증례가 있지만 병원환경에서 발생한 PVL 음성 ST72 SCCmec type IV MRSA 감염에 의한 심내막염은 우리나라에서 보고된 바가 없으며 외국 문헌보고도 드물다[5,6]. 본 증례에서 흥미로운 점은 환자가 상완골골절 수술로 본원에 처음 입원하기 전에 의료기관에 있지 않았으며 수술 후 약 한 달간 본원에서 입원하였다는 점이다. 입원 초기에 코점막에서 실시한 멸균면봉배양 검사에 MRSA가 동정되지 않았다는 점에서 환자가 입원 당시 MRSA 보균자가 아니었으며 감염을 일으킨 PVL 음성 ST72 SCCmec type IV MRSA가 병원환경에서 유래되었다고 추정할 수 있다.
현재까지 MRSA 감염일 경우 1차 선택 항생제는 일반적으로 vancomycin이며 지금까지 문헌보고된 CA-MRSA에 의한 감염성 심내막염 증례들은 vancomycin으로 완치된 것으로 알려져 있다. 본 증례는 vancomycin 투여 5일째에도 지속적인 발열, 새롭게 발현한 다발성 뇌출혈성 병변, 손과 발바닥에 새롭게 관찰되는 출혈성 결절 그리고 혈액배양 검사에서 MRSA가 지속적으로 분리되어 vancomycin 치료 실패라고 판단한 예이다. Infectious Diseases Society of America 가이드라인에 따르면 지속적인 MRSA 혈증이 나타나거나 vancomycin 치료 실패일 경우 고용량 daptomycin을 고려하도록 권고하고 있으며[7] 이외 2차 선택 항생제로는 linezolid를 제안하고 있다[8]. Daptomycin은 국내에 없기 때문에 본 증례에서는 항생제를 vancomycin에서 linezolid로 변경하였으며 이후 linezolid 유지로 임상적 호전이 이루어졌다. 동정된 MRSA 균주의 vancomycin MIC 수준이 낮았으며 vancomycin trough level이 적절하였음에도 불구하고 초기 vancomycin 치료가 실패한 원인으로는 우측 상완골골절 부위에 고정기구의 삽입과 뇌 병변에 대하여 vancomycin의 낮은 투과력으로 추정할 수 있다.
국내에서 CA-MRSA의 가장 흔한 유전자는 PVL 음성인 ST72-MRSA-IV A clone이며 이와 달리 유럽에서의 CA-MRSA는 PVL 유전자를 갖는 ST80-USA 300 clone이다[9,10]. 본 증례도 PVL 음성 SCCmec type IV A; the MLST ST 72; 1-4-1-8- 4-4-3를 지닌 MRSA였다(Fig. 2).