위용종의 진단 및 치료
Diagnosis and Management of Gastric Polyps
Article information
Trans Abstract
A gastric polyp is defined as a proliferative or neoplastic lesion from the mucosal membrane. Rates of gastric polyp detection are increasing due to widespread use of gastrointestinal endoscopy in Korea. There are many types of gastric polyps; the most common are fundic gland, hyperplastic, and adenomatous polyps. This article reviews the clinical and histologic features of these polyps and provides recommendations for management.
서 론
국내에서는 최근 국가암검진 프로그램으로 인하여 위내시경 검사가 보편화되어 무증상의 위용종이 발견되는 경우가 많아지고 있다. 넓은 의미의 용종이란 위장관의 내강 쪽으로 돌출된 병변을 의미하나 엄격하게는 위의 점막층에서 발생된 과증식성 또는 종양성 병변으로 정의할 수 있다[1]. 위용종은 상피성 용종과 비점막성 벽내용종으로 크게 분류되며(Table 1) [2] 상피성 용종에는 위저선용종(fundic gland polyp), 과증식성 용종(hyperplastic polyp), 위선종(Gastric adenoma) 등이 대표적이다. 이외에도 다양한 종류의 용종이 있지만 임상양상이나 악성화 비율 등이 각각 다르기 때문에 일률적인 치료방법을 선택하기 어렵다. 본고에서는 위용종 중에서 내시경 검사 중 흔히 관찰할 수 있는 상피성 용종을 중심으로 진단 및 치료에 대해 기술하고자 한다.
역 학
위용종의 발생률은 연구자마다 1-9% 정도로 다양하게 보고하고 있다. 가장 흔하게 발견되는 용종은 위저선용종, 증식성 용종, 위선종이다. 전통적으로 가장 흔하게 발견되는 용종은 과증식성 용종으로 알려져 있으나 발생률에 지역적인 차이가 있어서 서구에서 시행된 연구에서는 위저선용종이 가장 흔한 것으로 나타났지만 국내 연구에서는 과증식성 용종이 가장 흔하고 다음으로 위저선용종과 선종성 용종의 순으로 많은 것으로 나타났다[3]. 최근 중국에서 시행된 연구에서 10년 전과 비교하여 위용종의 분포양상을 비교하였는데 과증식성 용종은 감소하는 추세인 반면에 위저선용종의 비율은 점차 증가하고 있는 것으로 나타났다[4]. 이는 장기간의 양성자펌프억제제(proton pump inhibitor)의 사용과 Helicobacter pylori 감염률의 감소에 기인한 것으로 추정하고 있다.
위저선용종(fundic gland polyp)
위저선용종은 산발적으로 발생되는 용종(sporadic fundic gland polyp)과 가족성 선종성 용종증(Familial adenomatous polyposis symdrome)과 동반된 용종 그리고 장기간의 양성자펌프억제제 사용과 연관된 용종이 있다. 위저선용종의 발생 원인은 명확하지 않지만 β-catenin 유전자의 변형과 연관되어 있는 것으로 알려져 있다[5].
산발성 위저선용종(sporadic fundic gland polyp)
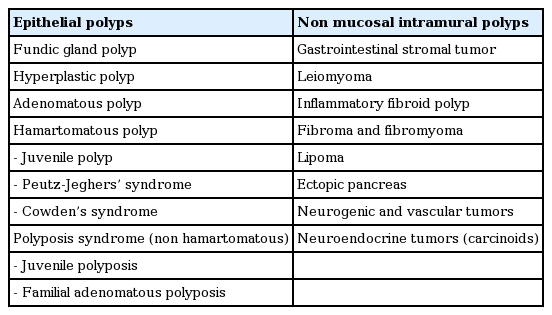
위저선용종은 부드럽고 투명하며, 무경성의 융기된 형태로 보이며 단독 혹은 다발성으로 나타나지만 다발성인 경우가 많으며 대부분 5 mm 이내의 크기이다(Fig. 1A). 주변 점막과 비슷한 색조를 띄며 내시경 소견만으로도 진단이 가능한 경우가 많다.
Fundic gland polyp. (A) Endoscopic finding showing a small smooth, translucent, round polyp in the gastric body. (B) Histological finding showing cystically dilated fundic glands lined by normal cells in the oxyntic mucosa, which consists of parietal cells, chief cells, and mucous neck cells. The lamina propria is scant, with mixed inflammatory cells. Cells are stained with Hematoxylin & Eosin. 100× magnification.
조직학적 소견은 특징적으로 위저샘들의 증식과 소낭형성을 볼 수 있으며 바탕질(lamina propria)에서 염증세포의 침윤은 거의 관찰되지 않는다(Fig. 1B).
산발성 용종에서 이형성(dysplasia)은 1% 미만에서 나타나며 H. pylori 감염과의 연관성은 낮고 시간이 지나면서 크기가 줄어들거나 사라지기도 한다. 이형성을 보이는 경우는 매우 드물지만 보고가 되고 있으며[6] 한 증례보고에서 작은 크기의 위저선용종에서 인환세포암이 발생되었던 예를 보고하여 용종의 표면이 불규칙하거나 미란이 있을 경우 이형성 변화의 가능성을 생각하여야 되겠다[7].
양성자펌프억제제와 연관된 위저선용종
1992년에 양성자펌프억제제 사용 후 발생한 위저선용종에 대한 증례들이 보고된 이후로 양성자펌프억제제 사용과 위저선용종과의 연관성에 대한 연구들이 발표되었다. 양성자펌프억제제의 사용 후에 발생하는 위저선용종의 발생기전은 명확하지는 않으나 다음과 같은 기전이 제시되고 있다. 첫 번째로 약물로 인한 위산분비의 억제나 고가스트린 수치(high gastric level)에 의한 영양 효과(trophic effect)에 의해 벽세포의 돌출(parietal cell protrusion)이 발생한다는 것과 두 번째로 이런 돌출이 선협부(glandular isthmus)의 폐색을 유발하여 유출로(outflow)를 차단하게 되고 이로 인해 위저선낭종(fundic gland cyst)이 발생되고 이런 낭종이 커지면서 위저선용종으로 진행될 수 있다는 기전이 제시되고 있다[8]. 한 연구에 따르면 1년 이상 양성자펌프억제제를 장기 복용하는 환자에서 위저선용종의 발생률은 4배까지 증가하는 것으로 나타났고 특히 5년 이상 복용하는 경우 발생률이 높게 나타났다[9]. 다른 연구에서 용종은 대부분 크기가 1 cm 미만이었고 근위 또는 중체부에서 발생된 경우가 많았다. 용종 발생의 평균 시간은 32.5개월이었고 양성자펌프억제제를 중단 후 3개월 후에 사라졌다[10]. 양성자펌프억제제의 사용과 위저선용종과의 관계를 증명한 연구들이 많지만 일부 연구에서는 양성자펌프억제제와 위저선용종과의 명확한 연관성을 증명하지 못하여 향후 더 연구가 필요한 상태이다.
가족성 선종성 용종증(familial adenomatous polyposis)에서 위저선용종
가족성 선종성 용종증 환자에서 위저선용종이 다수 생길 수 있으며 이는 adenomatous polyposis coli 유전자의 변형에 의한다. 또한 이형성 발생률이 25-41% 정도 발생될 수 있다[11]. 한 연구에서 가족성 선종성 용종증 환자에서 위저선용종에 대해 조사한 결과 88%의 환자에서 위저선용종이 발견되었고 이 중 41%는 이형성을 포함하고 있었다는 보고를 하였다[12]. 이형성이 있는 경우는 크기가 1 cm 이상 크거나, 십이지장용종증의 정도가 심하거나 전정부의 위염이 있는 경우와 연관이 있었다[12]. 따라서 이형성이 발견되거나 40세 미만의 환자에서 다수(20개 이상)의 위저선용종이 발견되는 경우 가족성 선종성 용종증이 동반되어 있을 가능성을 생각하여 대장내시경 검사를 해보는 것이 권장된다.
치료
위저선용종을 처음 발견한 경우 한 개 이상의 대표적인 용종에서 조직검사를 시행하여 확진해야 한다. 크기가 1 cm 이상인 경우 제거하는 것이 좋은데 위저선용종은 1 cm 이상 자라는 경우가 드물고 조직채취가 불충분하여 이형성이 있는 부위를 놓칠 수 있기 때문이다. 또한 철저한 관찰을 통해 다른 용종들과 다르게 보이거나 크기가 1 cm 이상인 경우나, 미란이나 궤양이 형성되어 있는 경우 그리고 전정부와 같이 전형적인 위치에 있지 않은 경우 용종절제를 고려한다.
20개 이상의 용종이 발견되거나 1 cm 이상의 용종이 발견된 경우 양성자펌프억제제를 사용 중이라면 중지하여 용종이 줄어드는지 관찰하고 다른 양성자펌프억제제로 변경하거나 최소한의 용량으로 사용하는 것을 고려해야 한다[13]. 위저선용종은 다른 용종들에 비해 악성화 비율이 낮아 상대적으로 중요성이 떨어질 수 있지만 가족성 선종성 용종증을 의심해 볼 수 있는 단서가 될 수 있으므로 가족력을 확인해 보는 것이 필요하고 위저선용종의 개수나 성상뿐만이 아니라 위산분비억제 치료의 병력 등도 확인해 보는 것이 좋겠다.
과증식성 용종(hyperplastic polyp)
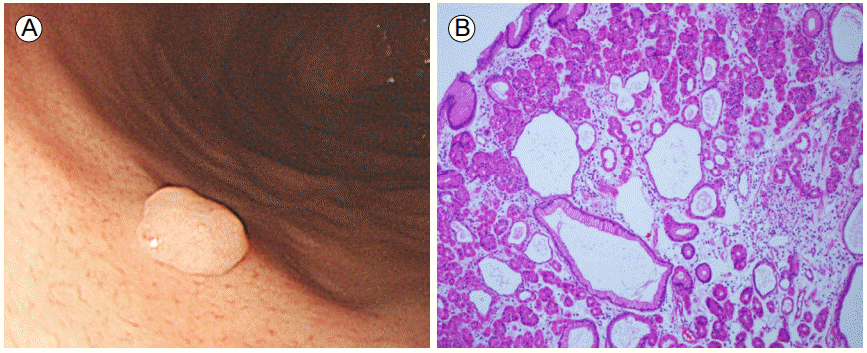
과증식성 용종은 육안적으로 부드러운 돔 형태를 띄고 발적을 띄며 반구상과 아유경성인 형태가 흔하다(Fig. 2A). 크기는 수 cm까지 커지기도 하지만 0.5-1.5 cm가 보통이고 단독으로 나타날 경우 전정부에 다발성으로 나타날 경우 위에 전체적으로 분포된다. 위축성 위염, H. pylori 연관성 위염, 위궤양이나 미란의 주변부 그리고 담즙역류에 지속적으로 노출되는 Billroth I 또는 II 수술을 받은 환자에서 문합부위에 잘 발생된다. 보통 증상이 없는 환자에서 우연히 발견되지만 크기가 큰 경우 표면 상피가 손상되면서 만성적인 실혈로 인해 철분결핍성 빈혈이 발생될 수 있고 큰 용종에 의해 위출구 폐색이 발생되기도 한다.
Hyperplastic polyp with dysplastic foci. (A) Endoscopic finding showing a smooth and dome-shaped polyp. (B) Histological finding showing the hyperplastic foveolar epithelium and cystically dilated glandular tissue with inflammatory cells and smooth muscle in the lamina propria. The focal proliferative dysplasic epithelium is shown in the box. Cells are stained with Hematoxylin & Eosin. 100× magnification.
조직학적으로 주로 위 소와(foveolae) 상피의 증식 및 확장, 위샘의 과형성과 확장 등의 소견을 보이며 과증식된 상피세포들로 인하여 주름이 잡히고 내강 표면이 corkscrew 모양을 보인다[14] (Fig. 2B). 바탕질에는 부종, 염증 세포의 침윤 및 산재된 평활근이 관찰되는데 염증성 침윤(inflammatory infiltrate)이 현저한 경우 염증성 용종(inflammatory polyp)으로 불리기도 하며 크기가 클수록 미란을 동반하는 경우가 많다. 발생기전은 명확하지 않으나 과증식성 용종은 현저한 점막의 재생에 의한 결과로 발생되는 것으로 제시되고 있는데 점막의 손상이나 미란 후에 치유와 재생이 소와의 증식(foveolar hyperplasia)의 형태로 발생될 수 있고 이런 과증식된 조직들은 자연적으로 소실되기도 하지만 지속적으로 남아있거나 과증식성 용종으로 진전되기도 한다[15].
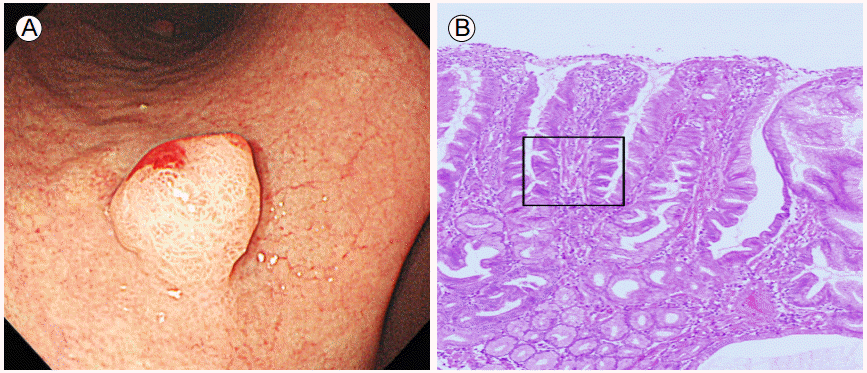
과증식성 용종은 H. pylori 감염 또는 자가면역성 위염 등과 관련이 많은데 전암성 상태인 위축성 위염과 같이 배경이 되는 위점막에 이상소견이 있다는 점이 중요하다. 과증식성 용종에서 이형성이 발생되는 확률은 1.9-19%까지 다양하게 보고되고 있으며 암이 발생되는 경우는 0.6-2.1%로 보고되고 있고 크기가 2 cm 이상 큰 경우에 더 흔하게 나타난다(Fig. 2). 용종 주변 점막에서 종양이 발생될 위험이 증가되는 것으로 알려져 있고(Fig. 3) 용종 자체에서 발생되는 것보다 주변 점막에서 암이 발생될 위험이 더 높다[2,16]. 따라서 주변 점막을 자세히 관찰하여 이상이 있을 경우 조직검사를 하는 것이 필요하겠다.
Gastric adenoma and hyperplastic polyps. (A) Multiple hyperplastic polyps and a synchronous gastric adenoma in the antrum are shown (arrow). (B) A close-up view of the gastric adenoma.
치료
과증식성 용종은 일부에서 악성화 가능성이 있기 때문에 1 cm 이상의 용종은 절제가 필요하며 절제된 조직에 대한 철저한 병리검사가 필요하다. 서구의 가이드라인에서는 주변 정상 점막을 조직검사하여 위암의 전구 병변인 위축성 위염의 범위와 정도를 검사해보는 것을 권장하고 있다[2].
절제 이외에 다른 치료 방법으로 H. pylori 제균 치료를 들 수가 있는데 과증식성 용종이 H. pylori와 연관되어 있으므로 점막손상을 일으키는 기저상태를 없애주는 것이 효과를 볼 수가 있겠다. 국외의 연구에서 H. pylori 제균 치료로 70%까지 과증식성 용종이 감소되었다는 보고가 있었고[17] 국내 보고에서는 과증식성 용종의 크기가 10 mm 이내인 경우와 무경성 형태를 보이는 경우 H pylori 제균 후에 용종의 소실률이 높았다는 보고를 하였으며 제균 치료에 성공한 경우 90% 정도의 부분 또는 완전소실을 보고하였다[18]. 최근의 국내 연구에서도 H. pylori 제균 치료가 과증식성 용종의 소실을 85%까지 유도한다는 보고가 있었다[3]. 서구의 가이드라인에서는 과증식성 용종이 있는 경우 H. pylori 제균 치료를 권장하고 있지만[2] 현재 국내의 제균 치료 가이드라인에 과증식성 용종에 대한 H. pylori 제균 치료는 아직 포함되어 있지 않은 상태이다.
선종성 용종(adenomatous polyp; gastric adenoma)
위선종의 유병률은 서구에서는 0.5-3.75%로 보고되었고 위암이 많이 발병하는 지역에서는 9-20% 정도로 높게 보고되고 있다[19].
위선종은 위암의 전구 병변이 되는 신생물성 병변으로 50-60대에 가장 흔히 발생된다. 위축성 위염이나 장상피화생이 있는 경우에 더 흔하게 발생되며 위치는 위의 전정부에서 주로 발견되고 단독으로 생기는 경우(> 82%)가 많다. 육안 소견은 주로 퇴색조를 띄는 경우가 흔하고 표면은 균일하며 분엽상을 보인다(Fig. 3). 조직학적으로는 관상, 융모상, 관-융모상 형태로 분류된다.
대장의 선종과 마찬가지로 암으로 진행하는 단계로 생각해야 하며 크기가 커질수록 암을 포함하고 있을 확률이 증가되며 동시성 암의 가능성도 있으므로 내시경 관찰시 염두에 두어야겠다. 조직검사 결과가 위선종 병변 전체를 대변할 수 없기 때문에 내시경절제 후 병리검사 결과와 일치하지 않는 경우가 많이 있으므로 주의를 요한다. 위선종 점막에 함몰성 병변, 발적, 미란, 궤양, 불균일함, 결절성 등이 관찰될 때는 위암이나 고등급 선종과 연관된 소견이므로 적극적인 치료가 필요하겠다.
치료
위선종은 위암의 전구 병변이면서 동시에 위암을 포함할 수 있기 때문에 안전하게 시행할 수 있다면 완전절제를 해주는 것이 권장된다. 동시성 병변이 존재할 수 있으므로 위점막 전체를 철저히 검사하여 이상이 있는 부위에서 조직검사가 필요하다. 위선종의 내시경절제 후 이시성 병변이 발견될 수 있는데 최근의 연구에서 H. pylori 제균 치료가 이시성 병변의 발생을 예방할 수 있다는 결과를 보고하였다[20,21]. 국내의 가이드라인에서는 위선종이 있는 환자에서 H. pylori 치료에 대한 지침은 아직 없는 상태이나 유럽과 미국의 가이드라인에서는 H. pylori 제균 치료를 권장하고 있다[22,23].
결 론
위용종은 육안적 소견 및 조직검사 결과로 진단이 가능하지만 조직검사만으로 용종 안에 포함된 이형성이나 암을 확인할 수 없다는 문제가 있어서 크기가 1 cm 이상인 경우는 용종절제술이 추천된다. 하지만 안전하게 절제가 시행될 수 있도록 내시경을 시행하는 의사는 합병증에 충분히 대처할 수 있어야 하겠다. 용종의 육안 형태가 비전형적인 경우 이형성이나 암이 포함되어 있을 가능성이 있으므로 신중한 접근이 필요하다.