산후 확장심근병과 미만성 폐포출혈로 나타난 항인지질증후군 1예
Possible Antiphospholipid Syndrome Presenting as Peripartum Cardiomyopathy and Diffuse Alveolar Hemorrhage
Article information
Abstract
저자들은 임신 34주에 급격히 진행하는 확장심근병과 출산 후에도 지속되는 심부전 및 미만성 폐포출혈 소견을 보인 환자에서, 사망으로 12주 간격 이상의 항인지질항체 양성 소견을 확인하지 못하였지만, 원인질환으로 항인지질증후군으로 보이는 증례를 경험하였기에 문헌고찰과 함께 증례보고하는 바이다.
Trans Abstract
Antiphospholipid syndrome (APS) is an autoimmune disease characterized by the presence of circulating antiphospholipid antibodies in combination with at least one other clinical manifestation, such as vascular thrombosis or recurrent pregnancy loss. APS is further characterized by the presence of vasculitis affecting multiple organ systems, resulting in a wide variety of clinical outcomes. Common cardiac manifestations of APS include valve abnormalities, occlusive arterial disease, intra-cardiac emboli, ventricular dysfunction, and pulmonary hypertension, along with rare instances of dilated cardiomyopathy. Simultaneously diffuse alveolar hemorrhage and peripartum cardiomyopathy have also been reported, though these manifestations remain extremely rare. Here, we report a case of a 34-year-old woman with possible APS who presented with peripartum cardiomyopathy and diffuse alveolar hemorrhage.
서 론
항인지질증후군(antiphospholipid syndrome, APS)은 항인지질항체인 루푸스 항응고인자(lupus anticoagulant, LAC), 항카디오리핀항체(anticardiolipin antibody, aCL Ab), 베타2당단백-I항체(ß2-glycoprotein-I antibody, ß2GPI Ab)가 양성이면서 혈관의 혈전이나 반복적인 유산을 특징으로 한다[1]. APS는 혈관염과 유사한 임상양상을 가지므로 전신을 침범 가능한 자가면역질환이며 심혈관계 침범 시에는 대부분 판막이상이나 심혈관 폐쇄, 심장내 혈전, 그리고 드물게 확장심근병으로 나타날 수 있다[1]. 그러나 폐포출혈이 동반된 산후 확장심근병으로 나타나는 경우는 흔치 않다.
호흡곤란으로 내원한 임신 34주 산모에서 산후 확장심근병 및 미만성 폐포출혈을 확인하고 이의 원질환으로 APS가 가능한 증례를 경험하였기에 문헌고찰과 함께 증례보고 한다.
증 례
환 자: 34세 여자
주 소: 기침, 가래 및 호흡곤란
현병력: 내원 당시 34주 임신 상태로 1주일 전부터 시작된 기침과 2일 전부터 누우면 심해지고 휴식 시에도 지속되는 호흡곤란으로 산전관리 중인 산부인과를 방문하였으며 흉부 단순 방사선 사진에서 심장비대, 폐부종이 있어 치료 및 분만을 위해 본원으로 전원되었다. 임신 30주경의 산전관리 때까지 특이증상은 없었다.
과거력: 고혈압, 당뇨, 간염, 결핵의 과거력 없음, 자연유산력 없음
개인력: 음주, 흡연 없음
가족력: 특이병력 없음
신체검사 소견: 내원시 활력 징후는 혈압 162/118 mmHg, 맥박 135회/분, 호흡수 36회/분, 체온 36.0였다. 의식은 명료하였고 외관상 급성 병색이 관찰되었다. 흉부 청진에서 양측 폐 하엽에 수포음이 들렸고 심장청진에서 심음은 정상이었다. 복부 진찰에서 장음 정상이었고, 압통이나 반발통은 없었다. 얼굴의 홍조나 발진은 없었고 림프절 비대가 촉지되지 않았으며 피부자반이나 관절통, 관절의 부종, 압통은 없었다.
검사실 소견: 입원 당시 시행한 일반혈액 검사는 백혈구 14,400/mm3 (호중구 91.4%, 림프구 6.5%, 단핵구 1.7%, 호염구 0.2%, 호산구 0.2%), 혈색소 11.2 g/dL (참고치 12-16), 혈소판 510,000/µL (참고치 130,000-450,000), 적혈구침강속도 120 mm/hr (참고치 0-30), C-반응단백질 7.02 mg/L (참고치 0-0.5)였다. 혈액생화학 검사에서 AST/ALT 42/100 IU/L, 알부민 3.0 g/dL, 혈액요소질소 10.2 mg/dL, 크레아티닌 0.91 mg/dL, 나트륨 129 mEq/L, 칼륨 4.7 mEq/L, 혈당 100 mg/dL, creatinekinase-myoglobin 2.190 ng/mL, 트로포닌-T 0.089 ng/mL였다. N말단-나트륨이뇨펩타이드(N-terminal prohormone brain natriuretic peptide)는 24,867.00 pg/mL로 상승하였다. Activated partial thromboplastin time 49 sec (참고치 27.8-41.7 sec), international normalized ration 1.02였다.
방사선학적 소견: 흉부 단순 방사선 사진에서 심장 음영의 길이가 흉곽 음영의 내부 길이의 60%를 차지한 심장비대 소견과 양측성 흉수 소견이 보이며(Fig. 1A), 흉부 전산화단층촬영에서 양측 하엽에 간질성 폐부종 소견, 우폐의 흉수 소견과, 우폐의 폐실질 음영증가 및 심낭삼출 소견이 관찰되었다(Fig. 2A).

(A) On admission, a chest x-ray revealed cardiomegaly, pleural effusion, and diffuse consolidation in both lung fields, which was dominant on the right side. (B) Following high dose steroid therapy, the extent and density of patchy air space consolidation was decreased.

(A) A chest CT revealed diffuse patchy infiltration in both lung fields, including both pleural effusion and mild pericardial effusion. (B) Echocardiography revealed left ventricular wall thinning with systolic dysfunction, along with mild pericardial effusion. CT, computed tomography.
심초음파 검사 소견: 급성 심부전 평가를 위한 심초음파에서 심박출량 32.5%로 감소하였으며, 전반적인 심벽운동 감소 및 수축기 부전 소견이 있었다. 소량의 심낭삼출 이외의 경미한 이첨판, 삼첨판 역류를 동반하였고 전반적인 좌심실 두께감소 및 확장소견이 있었다(Fig. 2B).
치료 및 경과: 흉부 전산화단층촬영에서 우폐의 우세한 폐실질 음영증가 및 폐부종, 흉수가 있어흉막천자를 시행하였다. 흉수 검사상 누출액이었고 총 단백질 0.9 g/dL, 포도당 123 mg/dL, 아밀라아제 23 U/L, 알부민 0.6 g/dL, 젖산탈수소 효소 67 U/L, 호중구 58/µL, 림프구 96/µL, 항산성박테리아검사(acid fast bacteria) 음성, 종양 표지자 음성이었다. 흉수 검사 결과 부폐렴성 흉수의 가능성은 낮았으나 입원 1일에 38℃의 발열이 있었고 백혈구와 C-반응단백질 증가 소견으로 미루어 폐렴과 이로 인한 스트레스유발성 심근병으로 판단하여 광범위 예방적 항생제로 ceftriaxone 2 g/일 투여하였다. 항생제를 투여하며 입원 4일에 임신 35주 상태로 유도분만을 시행하였으나 이후에도 심초음파에서 심기능 호전이 없고 단순 흉부 방사선 촬영에서 폐부종 및 폐실질 음영증가의 호전이 없었다. 혈청학적 검사에서 렙토스피라 항체 음성, 엡스테인-바 바이러스 항체 음성이고, 혈액세균배양 검사는 3회 모두 음성이었으나 항생제를 piperacillin 2 g 4회/일, tazobactam 0.25 g 4회/일, vancomycin 500 mg/일로 변경 투여하였다. 이후에 심초음파 추적관찰하였으나 심박출률 26%, 좌심실의 전반적인 심벽운동 감소, 확장심근병 소견에 변화가 없었다. 중간에 재시행한 혈액배양 검사에서 특이균은 계속 배양되지 않았다. 추가로 시행한 파보 바이러스(Parvo virus) B19 중합효소연쇄반응(polymerase chain reaction, PCR) 음성, 엡스테인-바 바이러스(Epstein-barr virus) IgG와 IgM 음성, 마이코플라즈마 IgG, IgM 음성, 렙토스피라항체(Leptospira Ab) 음성, 쯔쯔가무시항체(Tsutsugamushi Ab) 음성, 한탄바이러스항체(Hantan virus Ab) 음성, 가래 검사에서 호흡기바이러스 중합효소연쇄반응(PCR) 14종 검사 음성, tuberculosis/nontuberculous mycobacteria real-time PCR 음성이었다.
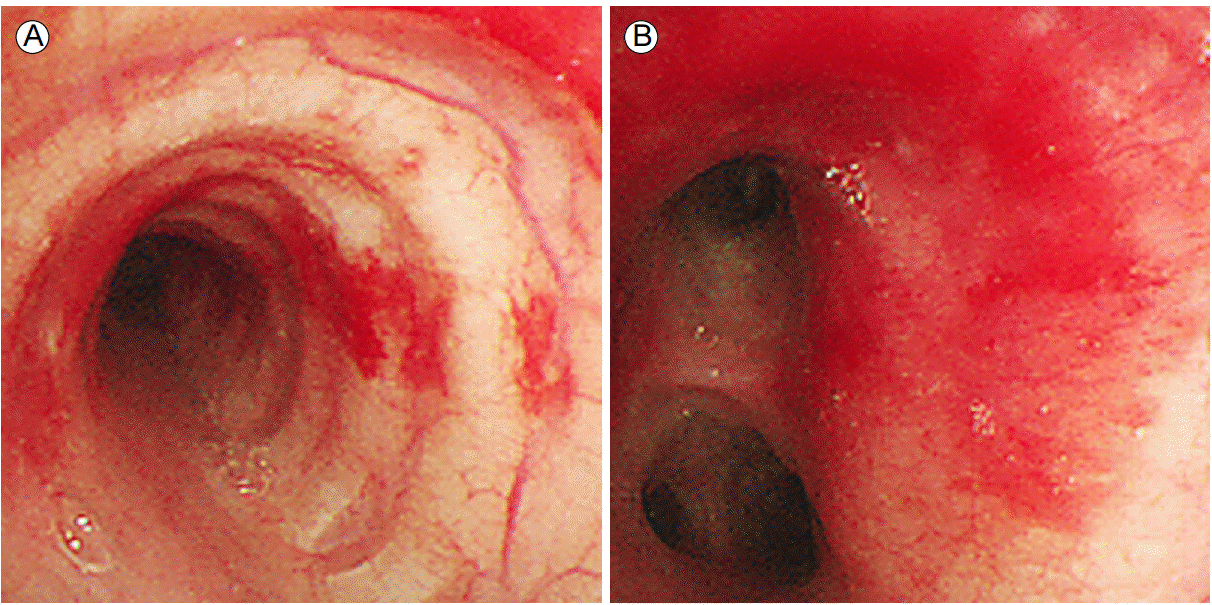
입원 16일에 소변량감소 및 크레아티닌 상승으로 지속신장대치요법(continuous renal replacement therapy)을 시행하는 중, 흉부 단순 방사선 사진과 흉부 전산화단층촬영에서 폐부종이 악화되고 폐실질 음영도 더욱 증가되어 입원 22일에 시행한 기관지내시경에서 우하엽 출혈소견이 보였다(Fig. 3). 이에 폐실질 음영증가와 확장심근병이 감염과 이로 인한 스트레스유발성 심근병보다는 자가면역질환과 같은 비감염성 질환에 의해 유발된 심근병 및 폐포출혈의 가능성을 고려하고 시행한 혈액 검사에서 백혈구 20,800/mm3 (호중구 94.6%, 림프구 2.2%, 단핵구 3.0%, 호염구 0.1%, 호산구 0.1%), 혈색소 7.6 g/dL (참고치 12-16), 혈소판 77,000/µL (참고치 130,000-450,000)였고 면역학적 검사에서 항핵항체(antinuclear antibody, ANA) 1:2,560, speckled pattern으로 양성, 그리고 직접 쿰즈 검사 양성이었다. C3 149 mg/dL (참고치 65-135), C4 53 mg/dL (참고치 13-35)로 감소는 없었으며, 항-SS-A/Ro 항체 3.2 EU (참고치 0-20), 항-SS-B/La 항체 1.8 EU (참고치 0-20), 항 Sm 항체 음성, c-항호중구세포질항체 음성, p-항호중구세포질항체 음성, 그리고 항 이중나선 DNA 항체(ds-DNA) 음성이었다. 혈청 검사에서 diluted Russel viper venom time mixing ratio 검사법으로 시행한 LAC는 양성, 항ß2GPI와 항aCL 항체(IgG & IgM)는 음성이었다. 이에 감염이 배제된 상태에서 원인불명의 산후 확장심근병 및 미만성폐포출혈의 원인으로 LAC 양성으로 APS가 가능하다고 판단하였다. 전신홍반루푸스의 경우는 ANA 양성, 직접 쿰스 양성이나 진단기준에 부합되지 않았고 특히 질환특이적인 항Sm 항체, 항ds-DNA 항체 모두 음성이여서 배제되었다. 확진을 위하여 미세혈관병증을 확인할 신장 혹은 심장 조직검사가 필요하였으나 혈소판감소증 및 전신컨디션 악화로 시행 불가능하였다. 입원 23일부터 고용량 스테로이드요법을 시작하였다. Methylprednisolone 500 mg/일 4일간 정주 후 폐포출혈에 의한 폐실질 음영증가는 호전되었다(Fig. 1B). 그러나 확장심근병의 호전 없이 심박출률 10-20%로 유지되다가 심정지가 있었고 인공심폐기를 삽입하였다. 이후 스테로이드를 유지하면서 면역글로불린 20 g/일을 추가로 투여하였으나 심박출률의 호전이 없었다. 입원 28일 기관지내시경 재검 결과 폐포출혈은 없었으나 가래 배양 검사에서 그람양성구균 및 그람음성쌍구균, 그람음성간균이 배양되어 인공호흡기관련 폐렴이 확인되어 항생제투여 및 보존적 치료를 유지하다가 입원 32일에 사망하였다.
고 찰
APS은 동맥과 정맥을 포함한 모세혈관내 혈전증, 임신합병증, 그리고 자연유산의 원인이 되는 자가면역질환이다[2]. 전신홍반루푸스나 류마티스관절염 등과 같은 선행 자가면역학질환에 동반될 때를 이차성, 관련 질환 없이 단독으로 나타날 때를 일차성으로 분류한다[2]. 동반 가능한 임상증상은 혈소판감소증, 그물울혈반등의 피부병변, 신기능 이상, 신경계 이상, 그리고 심혈관계 이상이 있다[2].
APS의 심혈관계 이상은 흔한 임상양상은 아니지만 대부분 판막비후와 판막증식증 같은 판막 이상, 동맥폐쇄성 질환, 심장내 혈전, 심실기능장애, 폐고혈압, 그리고 심근병으로 나타날 수 있고 이는 심부전으로 이어질 수 있다[1]. 본 증례는 심잡음이 없고 심초음파 결과 판막이상이나 허혈성 심질환의 증거 없는 확장심근병이었다. 환자가 34주의 산모임을 감안할 때 산후 확장심근병의 범주에 해당한다. 산후 확장심근병은 대개 출산 전 1개월에서 출산 후 6개월까지 생기며, 증상은 호흡곤란, 기침, 하지부종 등 심부전과 유사하다[3]. 임상적으로 좌심실 심박출률의 감소와 좌심실확장으로 나타나는 수축기부전이 조기에 나타난다[3]. 반면에 고혈압, 심장판막 이상, 심혈관질환 등에서는 심실의 확장기능이 감소한다. APS 환자에서의 확장심근병 역시 좌심실 확장기 부전을 특징으로 한다[4]. 장기간 생존율과 회복률에 대한 연구는 적지만 오래 전 연구에선 대략적으로 산후 확장심근병 환자의 50%가 정상 심기능을 회복하고 25%가 심기능은 감소하지만 약물조절로 유지되며 25%가 심각한 심부전으로 진행한다[5]. 최근 연구에서 산후 확장심근병의 치료성적은 향상되어 생존율이 90%에서 95%까지 높아졌다[5]. 통상적인 산후 확장심근병은 심근경색이나 폐색전증과 같이 심부전을 일으킬 수 있는 질환이 없이 출산 전후에 심부전이 갑자기 진행하였을 때 진단하지만 본 환자는 확장심근병과 더불어 미만성 폐포 출혈, ANA 강양성, 쿰즈 검사 양성, 그리고 LAC 양성소견으로 단순히 산후 확장심근병보다는 APS로 인한 확장심근병이었음을 시사한다. 증례와 유사하게 산후 확장심근병으로 생각하였던 산모에서 APS 진단 하에 스테로이드와 헤파린으로 성공적으로 치료한 임상보고가 있었으며 임신이나 산욕기의 상태가 APS에서 심기능 악화를 촉진할 수 있음을 지적하였다[6]. 그러므로 antiphospholipid antibodies 양성 등 APS가 의심되는 산모에서 출산 전후 심전도나 심초음파를 통하여 심장에 대한 평가가 APS로 인한 심장합병증을 조기에 발견할 수 있는 방법이 될 수 있으며, 산후 확장심근병 환자에서 항인지질항체를 검사하는 것이 의미가 있음을 주장하였다[6]. 심초음파는 좌심실 확장과 심박출률이 저하된 환자에게서 판막부전이나 선천적 심질환과 같은 기타 질환을 배제하고 산후 확장심근병을 진단하며 약물 등의 치료효과를 추적관찰하는데 효과적이다[5]. 본 환자는 과거력상 조산, 습관성 유산, 혈전 등 APS에서 보이는 전형적인 양상이 이전에 없었고 출산 등의 심부전을 일으킬 수 있는 요인들로 인하여 APS에 대한 의심이나 평가가 지연되었다. 입원 16일째 보인 신기능부전과 입원 22일째 폐포내 출혈을 확인하였을 때는 파국 항인지질증후군(catastrophicantiphospholipid syndrome, CAPS) [7]에 준하는 임상양상으로 진행하였고 확장심근병은 비가역적인 상태였다.
APS가 빠르게 진행된 형태인 CAPS는 다수의 작은 혈관들에 혈전병증이 생김으로써 다발성 장기부전을 초래하므로 감염, 수술, 외상, 종양, 항응고제 중단 혹은 불충분한 투여, 산과적 합병증, 그리고 기저질환이 전신홍반루프스인 경우 질병의 활성도 증가와 같은 선행요인에 의해 유발된다[8]. 임상적으로 신장, 폐, 중추신경계통, 심장, 피부, 간 그리고 위장관을 흔하게 침범하는데 CAPS 환자들의 71%까지 신장침범을 보인다는 보고도 있었다[7]. 신장침범이란 혈중 크레아틴 수치가 50% 이상 증가하거나 단백뇨, 180/100 mmHg 이상의 중증 고혈압, 또는 이들이 혼재된 상태로 정의한다[7]. 그러나 CAPS의 진단기준은 (a) 3개 이상의 장기 침범, (b) 1주일 이내의 기간 동안 동시에 발현, (c) 1개 이상의 장기 또는 조직의 소혈관에서 조직병리학적 확진, (d) 항인지질항체 양성의 네 가지 기준을 모두 만족시켜야 하므로 조직학적 진단 없이는 CAPS의 확진은 어렵다[9]. 소혈관혈전증의 병리학적 소견이 특징이나 대부분의 급성기에는 심한 혈소판감소증과 불안정한 임상양상으로 인하여 본 증례에서와 같이 조직검사가 불가능한 경우가 많다[7]. 파종혈관내응고를 동반한 패혈증의 경우 혈소판감소증과 소혈관혈전증이 나타날 수 있어 CAPS과의 감별을 더욱 어렵게 한다[7]. 본 증례에서 APS의 진단기준인 항인지질항체가 12주 간격 이상을 두고 양성이어야 하는 기준을 충족하지 못한 것은 급격한 폐부종, 신기능저하, 혈소판감소증, 미만성 폐포출혈, 그리고 비가역적 심부전으로 내원 32일에 사망하였기 때문이다. 또한 환자는 혈소판감소증과 컨디션 저하로 조직병리학적인 검사는 하지 못하였다. 하지만 증례에서 항인지질항체 양성과 심장침범, 그리고 일주일 이내의 간격으로 폐와 신장침범이 진행한 점은 CAPS의 진행을 의심하게 한다.
APS의 치료는 크게 예방적 치료, 질환특이적 치료와 비특이적 치료로 나뉜다. 예방적 치료는 APS로 진단된 환자에서 이후의 혈전질환을 예방하기 위한 항응고제를 투여하는 것이다. 경정맥 헤파린과 스테로이드, 경정맥 면역글로불린, 혈장교환술 및 리툭시맵과 같은 면역억제제투여가 특이적 치료이며 다발성 장기부전으로 진행 시에는 인공호흡기나 투석과 같은 비특이적 치료, 즉 보존적 치료를 병행한다[8]. APS가 심혈관계 이상으로 발현되었을 때의 치료는 임상양상에 따라 다르다. 혈전색전증의 증거가 있는 판막비후나 판막증식증과 같은 판막 이상에서는 와파린이나 헤파린 등의 항응고제가 효과적이고 항혈소판제를 예방적으로 쓰기도 한다[4]. 동맥폐쇄성 질환에서는 고혈압, 고지혈증과 같은 선행요인에 대한 교정도 필요하다. 폐색전증과 이로 인한 폐동맥고혈압에서는 와파린과 헤파린을 쓰고 폐동맥고혈압을 안정화시키기 위한 칼슘채널억제제와 심혈관확장제인 프로스타사이클린을 투여하기도 한다[4]. 심실기능장애에 대해서는 정립된 치료는 없으나 이뇨제와 안지오텐신전환효소억제제와 같은 심부전에 대한 기존의 치료와 함께 혈전미세혈관병 등에 대한 장기간의 항응고제도 도움이 되기도 한다[10]. 그러나 APS와 동반된 장기 부전이 있을 때는 원질환의 치료가 동반되어야 하고 필요시 적극적인 면역억제제투여를 한다[7,8]. 본 환자는 임신 34주인 내원 당시에 심부전, 폐실질 음영증가 소견이 폐렴으로 인한 스트레스성 심근증이 확장심근병으로 나타난 것으로 생각하였다. 충분한 기간의 항생제 처방 및 유도분만 후에도 심기능이 호전되지 않고 신기능 부전 및 미만성 폐포 출혈이 보여 LAC 양성 확인 후에 APS를 의심하여 고용량 스테로이드를 병용하며 상기 제시한 것과 같은 적극적인 치료를 모두 병합하여 폐포출혈과 폐부종은 호전을 보였으나 확장심근병에 의한 심부전은 비가역적인 상태였다.
증례에서와 같이 심부전의 선행요인이 없는 젊은 환자에서 임신이나 출한 후 급격히 악화된 확장심근병을 보일 때는 드물지만 APS를 감별 진단의 하나로 고려하여야 하며 적극적인 치료를 해야 할 것이다.