최소변화콩팥병증이 동반된 골수형성이상증후군 환자에서 스테로이드 치료
Myelodysplastic Syndrome and Minimal Change Nephrotic Syndrome treated with Steroid Challenge
Article information
Abstract
본 증례는 신증후군과 범혈구감소증이 있는 환자에서 골수형성이상증후군과 최소변화콩팥병증이 동시에 진단된 경우이다. 최소변화콩팥병증은 골수형성이상증후군에 동반된 방종양성 사구체신염으로 생각되며 면역억제제인 프레드니솔론을 투여하면서 단백뇨의 호전 및 혈액, 골수 소견의 호전을 보인 것으로 보아 발병기전에서 면역체계의 이상이 중요하였음을 알 수 있다. 골수형성이상증후군 특히 모세포증가 불응빈혈-2에서 최소변화콩팥병증의 발생은 국내외에서 처음 보고하는 바이다.
Trans Abstract
Glomerulonephritis associated with malignancy is deemed to be paraneoplastic glomerulonephritis. Myelodysplastic syndrome (MDS) is a group of heterogeneous clonal hematopoietic stem cell disorders characterized by impaired hematopoietic cell differentiation and cytopenia. The pathophysiology of MDS is thought to be immune-mediated in part. A few reports have documented various forms of glomerulonephritis in patients with MDS and suggested that immune dysregulation is important in the development of paraneoplastic glomerulonephritis. Here, we report a patient with MDS and refractory anemia with excess blast-2 accompanied by minimal change nephrotic syndrome. The patient was treated with prednisolone, and the nephrotic-range proteinuria and pancytopenia improved markedly.
서 론
골수형성이상증후군(myelodysplastic syndrome, MDS)은 골수의 비효율적 조혈기능으로 인하여 말초혈액의 혈구감소와 조혈세포의 형성이상을 특징으로 하며 급성 백혈병으로 이행하거나 골수기능부전을 일으키는 등 다양한 임상상을 가진 혈액질환이다. 골수형성이상증후군의 발병 기전은 아직 명확히 규명되지 않았지만 약 10%에서 자가면역질환이 동반되어 있어 면역 체계 이상의 가능성이 제기되고 있다[1]. 이와 연관된 사구체신염 증례가 간간이 보고되었고 그 중 상당수가 현재는 골수형성이상증후군 범주에 포함되지 않는 만성골수단핵구백혈병(chronic myelomonocytic leukemia, CMML)이다[1-5]. 저자들은 골수형성이상증후군의 아형 중 모세포증가 불응빈혈-2 (refractory anemia with excess blast-2)와 최소변화콩팥병증(minimal change nephrotic syndrome)이 동시에 진단된 환자에게 면역억제제인 프레드니솔론(prednisolone)을 투여하여 단백뇨와 더불어 말초혈액 및 골수가 호전된 예를 경험하여 문헌고찰과 함께 보고하고자 한다.
증 례
환 자: 69세, 여자
주 소: 전신 부종
현병력: 내원 1년 전부터 거품뇨가 발생하였으며 1개월 전부터 전신 무력감이 발생하였고 2주 전부터 체중증가 및 전신부종을 보여 내원하였다.
과거력: 5년 전 고혈압을 진단받고 투약 중이었고 당뇨, 결핵, 간질환 등의 병력은 없었다.
가족력: 특이사항은 없었다.
신체검사 소견: 내원 당시 활력 징후는 혈압 160/90 mmHg, 맥박수 86회/분, 체온 36.5℃, 호흡수 20회/분이었다. 의식은 명료하였으며 만성 병색소견을 보였고 결막은 창백하였다. 흉부청진에서 심음 및 폐음은 정상이었다. 복부청진에서 장음은 정상이었고 간비장비대는 없었다. 전신에 부종 및 하지에 함요부종이 있었다.
검사실 소견: 입원 당시 시행한 말초혈액 검사에서 백혈구 1,780/µL, 호중구 48.3%, 혈색소 9.2 g/dL, 적혈구용적율 26.1%, 혈소판 187,000/µL였다. 혈청 생화학 검사에서 총 단백 4.2 g/dL, 알부민 1.7 g/dL, AST 22 IU/L, ALT 16 IU/L, LDH 483 IU/L, BUN 19.9 mg/dL, creatinine 1.7 mg/dL, iron 56 µg/dL, total iron binding capacity 121 µg/dL, ferritin 208.9 ng/mL, 총 콜레스테롤 357 mg/dL, Na 132 mEq/L, K 2.9 mEq/L, Cl 98 mEq/L, C-reactive protein 0.37 mg/dL였다. 비타민 B12와 엽산 수치는 정상이었다. 소변검사에서 단백뇨가 4(+)였고 적혈구 10-20/HPF 검출되었으며 요당은 검출되지 않았다. 24시간 요 단백은 15,680 mg이었고, 소변 단백전기영동검사에서 모든 혈청 단백이 관찰되어 비선택적인 사구체성 단백뇨가 의심되었다.
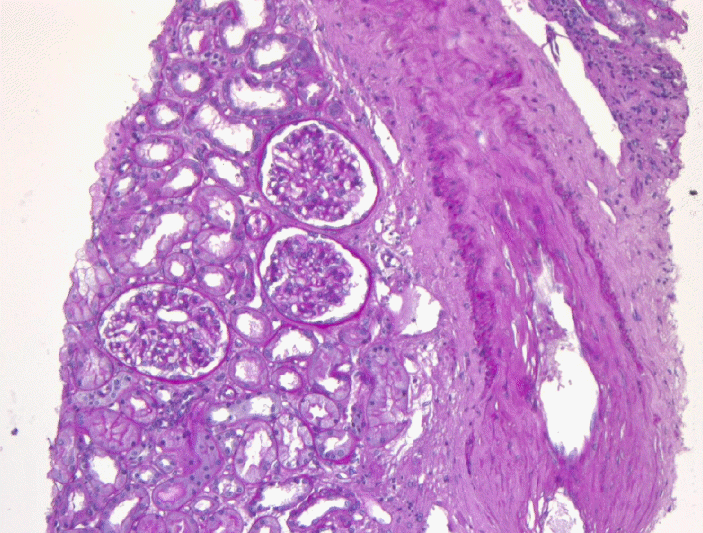
신장조직검사를 시행하였고 광학현미경 검사에서 13개의 사구체 중 3개의 사구체에서 전체 경화 소견을 보였으며, 전자현미경 검사에서 광범위한 발돌기의 융합(diffuse fusion of foot processes)을 보여(Fig. 1) 최소변화콩팥병증으로 진단하였다.
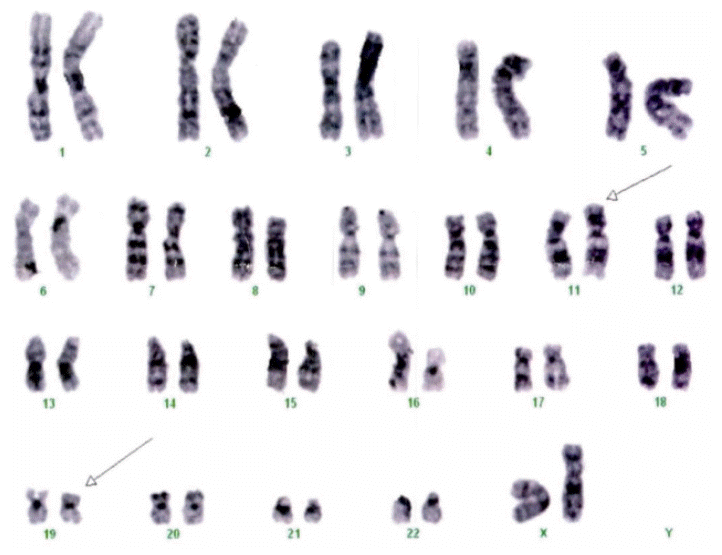
골수검사를 시행한 결과 골수흡인도말 검사에서 거대핵세포의 수가 감소된 저세포성 골수가 관찰되었으며 세포충실도는 20-30%였고 myeloid:erythroid ratio는 14:1이었다. 유사분열, 핵파괴, 다핵 적혈모구와 같은 적혈구 형성이상은 드물게 관찰되었고 핵 모양의 비정상적인 변화와 세포질내 과립분포이상과 같은 과립구 형성이상은 흔히 관찰되었다(Fig. 2). 골수내 골수모세포는 18.7%로 모세포증가 불응빈혈-2로 진단하였다. 염색체 검사에서는 관찰된 20개의 분열세포 중 19개의 분열세포에서 t(11:19)(q23;p13.3)의 구조적 이상을 보였다(Fig. 3).

The bone marrow aspiration at diagnosis showed dyshematopoiesis and increased myeloblasts (A ×400, B ×1000).
최종적으로 이 환자는 최소변화콩팥병증을 동반한 골수형성이상증후군으로 진단할 수 있었고 international prognostic scoring system 점수는 2.5로 고위험군에 속하였다.
치료 및 경과: 골수형성이상증후군의 치료는 신장기능부전으로 진단 후 바로 시작하지 못하였다. 신증후군의 치료로 이뇨제를 복용하던 중 호흡곤란, 하지 부종 증가 및 단백뇨 지속, 혈중 creatinine 수치 증가를 보여 진단 후 약 2개월경 혈액투석을 시작하였다. 투석을 시작하면서 프레드니솔론을 1 mg/kg 용량으로 복용하기 시작하였다. 프레드니솔론 복용 10일 후 백혈구는 1,050/µL에서 2,270/µL로 증가하였고 전신부종 및 단백뇨도 호전을 보였다. 3개월 후 백혈구 6,270/µL, 혈색소 10.8 g/dL, 혈소판 196,000/µL로 상당히 호전되었다.
점차 경구 프레드니솔론을 감량하였고 복용 시작한지 5개월경 완전히 중단하였다. 중단할 당시 말초혈액은 백혈구 6,370/µL, 혈색소 11.1 g/dL, 혈소판 244,000/µL로 경한 빈혈외 특이소견이 없었다.
1년 후 골수검사를 추적하였으며 골수흡인도말 검사에서 저세포성 골수가 관찰되었고 골수모세포는 1.9%, 세포분화는 정상적이었다(Fig. 4A and 4B). 염색체 검사에서 46,XX의 정상소견을 보였다. 말초혈액 혈구수 및 신장기능 또한 정상범위였다.
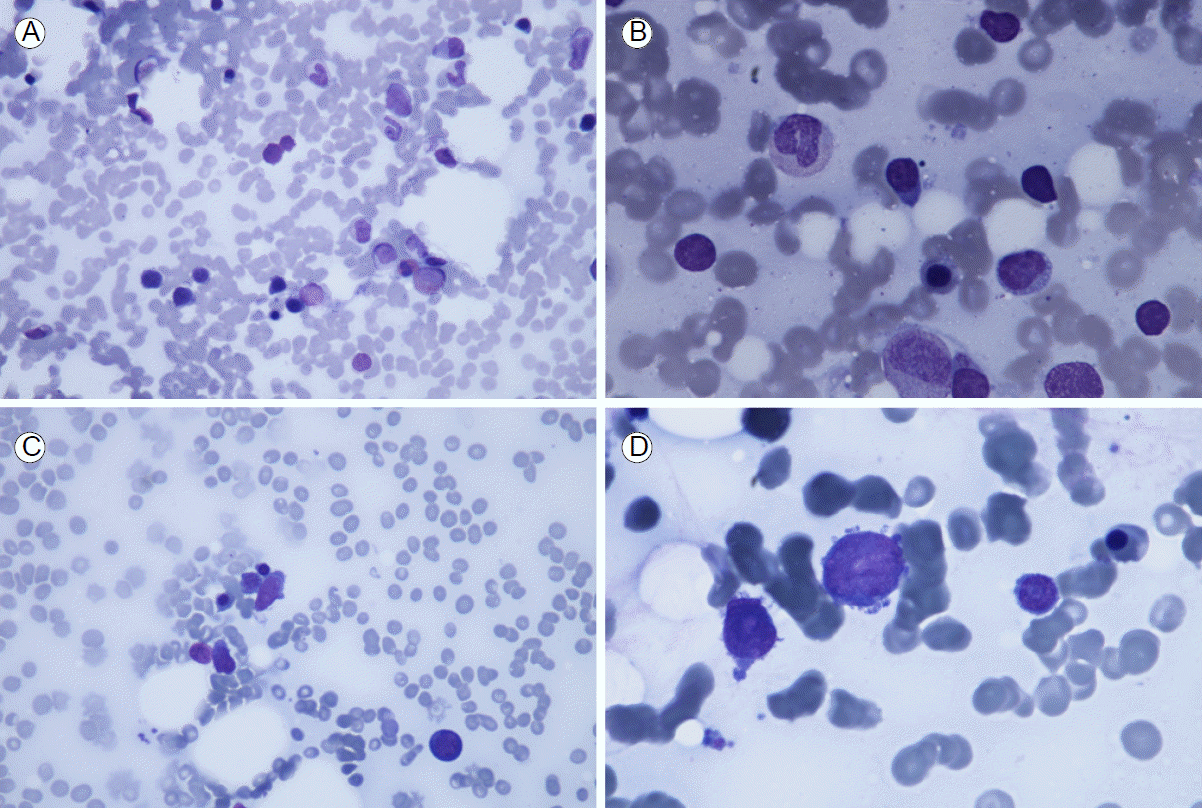
Bone marrow aspiration findings 1 year after stopping of prednisolone (A ×400, B ×1000) and at recurrence (C ×400, D ×1000): (A, B) hypocellular marrow and normal differentiation; (C, D) dysplastic bone marrow.
프레드니솔론을 중단한지 3년 후, 전신 무력감 및 열감으로 내원하였고 말초혈액 검사에서 범혈구감소증을 보였다(백혈구 430/µL, 혈색소 6.8 g/dL, 혈소판 80,000/µL). 골수흡인도말검사에서 저세포성 골수로 형성이상소견이 다시 나타났고 골수모세포가 18%였다(Fig. 4C and 4D). 염색체는 정상이었다. 이에 골수형성이상증후군이 재발한 것으로 판단하였으나 신증후군과 관련된 소변검사 및 신기능은 정상범위에 있었다.
골수형성이상증후군의 재발에 대해 아자시티딘(azacytidine) 치료를 시작하였다. 그러나 2차 치료 후 전격성 위막성 대장염(fulminant pseudomembranous colitis)으로 인한 패혈증으로 사망하였다.
고 찰
악성종양과 연관된 사구체병증이 종종 보고되었는데, 고형암에서는 막성 사구체병증(membranous glomerulopathy)이 가장 흔히 보고되었다. 림프구성 또는 골수구성 혈액질환에서도 사구체병증이 발생할 수 있고 호지킨 림프종에서 최소변화콩팥병증의 발생이 그 예이다. 이렇게 악성종양과 관련되어 발생하는 사구체신염을 방종양성 사구체신염(paraneoplastic glomerulonephritis)이라고 한다. 방종양성 사구체신염은 암의 신장으로의 전이나 침범과 같은 직접적인 원인이 아니라 암세포에서 분비되는 물질에 의하여 생기는 것으로 알려져 있다. 치료에서 특발성 사구체신염과 차이가 있기 때문에 방종양성 사구체신염을 염두에 두고 진단을 하는 것이 중요하다. 그러나 아직 정확한 발병 기전이 밝혀져 있지 않고 진단이 쉽지 않은데, 일반적으로 악성종양 환자에서 사구체신염이 동반되어 있고 악성종양이 치료되면 신염이 호전되고 악성종양이 재발되면 신염이 재발되는 경우 이 질환을 의심할 수 있다[6].
림프구성 혈액암 환자에서 다양한 방종양성 사구체신염의 발생이 보고되었는데, 호지킨 림프종과 관련하여 최소변화콩팥병증이 가장 흔히 보고되었고 만성 림프구성 백혈병과 비호지킨 림프종과 관련해서는 막증식성 사구체신염(membranoproliferative glomerulonephritis)과 막성 신장병증(membranous nephropathy)이 흔히 보고되었다. 골수구성 혈액암에서도 다양한 사구체신염이 보고되었는데, 그 중 골수형성이상증후군에서는 막성 신장병증, IgA 신장병증(IgA nephropathy), 메산지음 증식성 사구체신염(mesangial proliferative glomerulonephritis), 국소분절 사구체경화증(focal segmental glomerulosclerosis), 급속진행 사구체신염(rapidly progressive glomerulonephritis) 등 10여 개의 증례가 보고되었다[6]. 국내에서는 Ko 등[3]이 골수형성이상증후군(MDS-refractory cytopenia with multilineage dysplasia)과 막성 신장병증이 동시에 진단된 증례를 보고하였다. 본 증례는 처음으로 골수형성이상증후군, 특히 모세포증가 불응빈혈-2와 최소변화콩팥병증이 동시에 진단된 경우이다.
골수형성이상증후군에서 나타나는 골수부전은 면역이상과 관련되어 있다고 한다. 즉, 정상적인 줄기세포의 이형성(dysplasia)되는 변화가 자가면역 T-림프구 활성화를 유도하여 골수를 공격하게 된다는 것이다. 이러한 자가면역 활성화로 인해 세포자멸사를 유도하는 시토카인(pro-apoptotic cytokine) 특히 종양괴사인자 알파(tumor necrosis factor [TNF]-alpha)가 만성적으로 과다생산된다[7]. 골수형성이상증후군 환자의 약 10%에서 혈관염, 관절염, 말초신경염, 염증성 장질환과 같은 자가면역질환이 동반되어 있다. 또한 여러 가지 면역체계이상이 발견되었는데 natural killer 세포 활성도 감소, 항체의존 세포사멸 장애, CD4 세포수 감소, 면역글로불린의 양적 변화, 단클론성 감마병증, 다양한 자가항체의 존재 등이다[7]. 골수형성이상증후군의 병리와 비슷하게 최소변화콩팥병증의 발병기전도 면역이상으로 설명한다. T 림프구가 활성화되고 림포카인이 비정상적으로 분비되면서 결과적으로 알부민에 대한 사구체 투과성이 증가하고 발돌기 융합에 이르게 된다[8].
골수형성이상증후군에서 TNF-alpha와 같은 시토카인이 방종양성 사구체신염의 발생에 중요한 역할을 할 것으로 여겨진다[2,6]. Bustos 등[9]은 신증후군 환자에서 주로 단핵구에서 분비되는 시토카인인 TNF-alpha를 측정하였다. 신증후군이 조절되지 않는 상태에서는 관해 상태이거나 대조군에 비해 혈청 TNF-alpha의 수치와 단핵구에 의한 TNF-alpha의 생산이 더 높은 것으로 나타났다[9]. 과거에 골수형성이상증후군 범주에 분류되었던 CMML 환자에서 혈청 TNF-alpha 수치가 의미 있게 높았다는 보고가 있고 Saitoh 등[2]은 신증후군을 동반한 CMML 환자 3명을 보고하였는데 그중 한 명은 백혈병에 대한 항암치료를 시행 후 높았던 혈청 TNF-alpha 수치가 정상화되었고 신증후군 또한 호전되었다.
원발종양에 따라 방종양성 사구체신염이 발생하는 기전은 다를 수 있다. 예를 들어 호지킨 림프종이나 흉선종 환자에서 최소변화콩팥병증의 발생이 보고되었는데 그 기전으로 T-helper-2 계열로 편향된 면역반응을 제안하였다[6,10]. 치료 또한 원발종양에 따라 다를 수 있겠고 골수형성이상증후군에서는 보고된 증례가 많지 않아 명확한 치료방법을 제시하기 어렵다. Nishida 등[5]이 보고한 국소분절 사구체경화증이 진단된 골수형성이상증후군 환자의 경우 혈연간 골수이식을 받았고 이후 만성이식편대숙주병이 있으면서 중등도 이하의 단백뇨는 지속되었다. Ko 등[3]이 보고한 막성 신장병증 환자는 경구 프레드니솔론을 복용하면서 데시타빈(decitabine)을 함께 투여하였다. 데시타빈 1주기를 마치고 시클로스포린을 추가하였고 데시타빈 2주기 후 혈색소와 혈소판수가 증가하였고 하지부종도 호전되었다. 그러나 신증후군 범위의 단백뇨는 지속되었다[3]. 골수형성이상증후군에서 사구체신염이 발생하는 정확한 병리기전은 앞으로 더욱 밝혀져야 하겠지만 자가면역을 포함한 면역조절장애(immune dysregulation)가 중요한 원인으로 생각되고 여러 보고에서 스테로이드와 같은 면역억제치료로 신장병증이 호전되었고 일부에서는 혈구감소증이 호전되고 세포유전학적 관해를 얻기도 하였다[1,4]. 본 증례의 경우 신기능 저하로 스테로이드와 혈액투석으로 신증후군을 치료하면서 점차 혈구수의 호전을 보여 추적한 골수검사에서 형성이상소견이 관찰되지 않았고 염색체 또한 정상으로 나와 골수를 포함하여 혈액학적, 세포유전학적 관해까지 얻었고 약 3년간 관해가 유지되었다. 치료 전후에 TNF-alpha와 인터루킨을 포함한 시토카인이나 여러 면역 관련 지표들을 검사하여 비교해 보는 것도 본 증례에서의 발병 기전을 추측하는데 도움이 되겠다.
저세포성 골수형성이상증후군의 치료로 재생불량빈혈처럼 면역억제치료가 시도되어 혈액학적 호전을 얻기도 한다. 본 증례의 경우 저세포성 골수 소견을 보였으나 골수모세포 수가 높았고 69세의 고령이었으며 antithymocyte globulin, 시클로스포린과 같은 약제를 사용하진 않았다. 그러나 면역에 의한 조혈모세포의 억제가 골수형성이상증후군의 병태생리에 기여할 것으로 제안되고 있으므로 스테로이드 복용만으로 신증후군의 호전뿐 아니라 혈액학적 세포유전학적 관해까지 얻은 것으로 보아, 두 질환의 발생에 여러 기전이 작용하겠지만 본 증례에서는 면역이상이 가장 주요한 기전으로 작용하였을 것으로 생각된다.
방종양성 사구체신염은 악성종양을 가진 환자에서 사구체질환이 있을 경우 의심해보아야 하며 진단이 늦어져 부적절한 치료를 하지 않도록 주의해야 한다. 또한 사구체신염이 일반적인 치료에 반응을 하지 않을 경우 혹시 숨어있는 악성종양이 있지 않은지 확인해야 한다. 차후 각 종양에서의 방종양성 사구체신염의 발병 기전을 밝히고 조기에 진단할 수 있는 표지자를 발견하는 것이 중요하겠다.