림프절외 변연부 B-세포 림프종과 동반된 루프스양사구체신염 1예
Lupus-like Glomerulonephritis Associated with Extranodal Marginal Zone B-cell Lymphoma of MALT
Article information
Abstract
이 증례에서 저자들은 전신부종으로 내원한 49세 남환에서 루프스양사구체신염을 동반한 림프절외 변연부 B-세포 림프종을 진단하였고 항암화학요법으로 치료한 증례를 경험하였다. 현재까지 루프스양사구체신염의 발병 기전, 원인, 치료, 예후에 대해 잘 알려지진 않았으나, 이 질환이 진단된 경우 적극적으로 원인질환을 평가하고 조기에 적절히 치료하는 것이 신장의 예후에 있어서 중요할 것으로 생각된다.
Trans Abstract
Lupus-like glomerulonephritis is an immune complex disease with features of lupus nephritis in the absence of systemic lupus erythematosus (SLE). We report a 49-year-old man diagnosed with lupus-like glomerulonephritis associated with extranodal marginal zone B-cell lymphoma of mucosa-associated lymphoid tissue (MALT). He was admitted to the hospital for edema. At admission, the serum creatinine was 2.2 mg/dL and the urine protein level was 3.9 mg/day. A renal biopsy showed features of lupus nephritis with no clinical or serological evidence of SLE. Extranodal marginal zone B-cell lymphoma of MALT was discovered concurrently. After successful chemotherapy, the lupus-like glomerulonephritis and lymphoma entered complete remission.
서 론
전신홍반루프스(이하 루프스)는 자가항체와 면역복합체가 존재하여 전신을 침범하는 자가면역질환으로서, 미국 류마티스학회에서 제안한 11가지의 기준 중에서 4가지 기준 이상을 만족할 때 진단된다[1]. 최근에 루프스신염의 특징적인 면역복합체의 침착소견은 있으나 루프스의 기준에는 부합하지 않는 일차성 루프스양사구체신염(lupus-like glomerulonepheritis)이 보고된 바 있으며[1,2], 자가면역간염(active juvenile cirrhosis, lupoid hepatitis), 주혈흡충 감염, human immunodeficiency virus (HIV) 감염 환자에서도 보고된 바 있다[3-5].
림프절외 변연부 B-세포 림프종(extranodal marginal zone B-cell lymphoma of mucosa-associated lymphoid tissue)은 B-세포 림프종의 7-8%를 차지하며, 흉선이나 간에 발생하는 경우는 극히 드문 것으로 알려져 있다[6,7]. 흉선 림프절외 변연부 B-세포 림프종은 증상 없이 우연히 발견되는 경우가 많으며, 쇼그렌증후군, 류마티스관절염, 혹은 루프스와 같은 자가면역질환과 동반되기도 한다[6].
이에 저자들은 루프스를 시사하는 다른 소견은 없이 신장만 침범한 루프스양사구체신염과 동시에 흉선 및 간 점막연관림프조직 림프종을 진단하고 치료한 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 49세 남자
주 소: 호흡곤란
현병력: 일주일 전부터 부종이 발생하면서 호흡곤란이 동반되어 내원하였다.
과거력 및 가족력: 특이 사항은 없었다.
진찰 소견: 입원 당시 혈압은 184/106 mmHg, 맥박수 95회/분, 호흡수 20회/분, 체온 36.7℃였으며, 의식은 명료했다. 공막의 황달 및 결막의 창백 소견은 없었다. 두경부에 촉지되는 림프절은 없었다. 흉부 청진상 심잡음은 없었으나 양측 폐하에 수포음이 들렸다. 복부에서 만져지는 종괴는 없었다. 양하지에 함요부종이 관찰되었다.
검사 소견: 말초혈액 검사에서 백혈구 7,800/mm3, 혈색소 12.4 g/dL, 혈소판 161,000/mm3이었고, 혈청 생화학 검사상 혈액요소질소 73 mg/dL, 크레아티닌 2.2 mg/dL, 총 단백 4.8 g/dL, 알부민 2.7 g/dL, 총 빌리루빈 0.4 mg/dL, AST 29 IU/L, ALT 13 IU/L, ALP 109 IU/L, LDH 885 U/L, 총 콜레스테롤 179 mg/dL, 혈청 전해질 검사에서 Na 136 mEq/L, K 6.8 mEq/L, Cl 111 mEq/L이었고, C-반응단백 0.48 mg/dL, 적혈구침강속도 43 mm/hr이었다. 항핵항체(antinuclear antibody, ANA), 항 dsDNA 항체, anti-neutrophil cytoplasmic antibody, 한랭글로불린은 모두 음성이었고, Immunoglobulin G (IgG) 324(정상 범위 700-1,600) mg/dL, IgA 272(정상 범위 70-400) mg/dL, IgM 152(정상 범위 40-230) mg/dL이었다. 혈청 전기영동 검사에서 M-spike가 관찰되었고, 혈청 면역고정 검사에서 IgM/kappa band가 보였다. 혈청 kappa/lambda 유리경쇄 비율이 2.11로 증가되어 있었다. 소변 전기영동 검사에서 비선택적 사구체성 단백뇨의 소견을 보였고, 소변 면역고정 검사에서 비정상적인 밴드는 관찰되지 않았다. 보체 C3 30(정상 범위 90-180) mg/dL, 보체 C4 6(정상 범위 10-40) mg/dL로 감소되어 있었고, antistreptolysin O titer 108 IU/mL, rheumatoid factor 158 IU/mL이었다. B형간염 표면 항원 및 항체, C형간염 항체는 모두 음성이었고, HIV 항체도 음성이었다. 종양 표지자 검사에서 AFP 2.59 ng/mL, PIVKA-II 25 mAU/mL이었다. 소변 검사에서 요 비중 1.027, 요 단백 3+, 요 현미경 검사에서 적혈구 many/HPF였다. 24시간 소변 검사상 단백은 3.9 g/24 hr, 알부민은 3.6 g/24 hr이었다.
방사선 소견: 무조영 복부 컴퓨터 단층촬영에서 간에 다수의 저밀도 종괴들이 보여, gadoterate meglumine 조영제를 사용하여 간 자기공명영상을 시행하였다. T1 강조영상에서는 저신호강도, T2 강조영상에서는 고신호강도를 보였다. 간좌엽에 가장 큰 종괴의 장경은 11 cm이었고, 간 입구 및 문맥대정맥 주위에 다수의 커진 림프절이 있었다. F-18 fluorodeoxyglucose (FDG) positron emission tomography (PET)/computerized tomography (CT)에서 흉선, 가슴세로칸 림프절, 간에 F-18 FDG 섭취가 증가된 병변들이 관찰되었다(maximal standardized uptake value = 4).
병리 소견: 간, 코인두 조직검사에서 작은 림프구 침윤이 광범위하게 보이면서, 종격내시경을 통한 흉선 조직검사에서 흉선소체(Hassall’s corpuscle)를 침범하는 크기가 작고 둥근 림프구의 침윤이 관찰되었고, 면역조직화학검사에서 CD20 양성, CD3 음성, CD23 음성, TdT 음성이었으며, Ki labelling index는 10%이었다.
신 생검 조직의 광학현미경검사에서 27개의 사구체가 관찰되었고, 그중 3개(11%)는 구형 경화의 소견을 보였다. 나머지 사구체는 현저하게 크기가 증가되어 있었고, 메산지움의 세포 증식 소견이 관찰되었다. 광범위하게 내피하침착이 있으면서 모세혈관의 내강은 거의 막힌 양상이었고, 내강 속 면역침착물, 루우프 모양의 병변이 보였다. 모세혈관벽이 두 겹으로 보이는 병변도 있었다(Fig. 1A). 한 개(4%)의 사구체에서 세포성 반월상이 보였다.
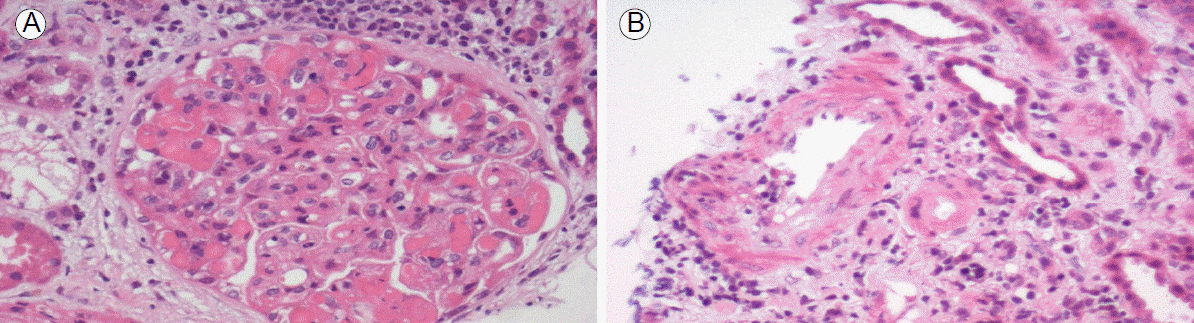
Light microscopy of the initial kidney biopsy shows (A) hypercellular glomerulus with hyaline thrombi, wire-loop patterns, and double contours, (B) intimal arteritis and interstitial inflammatory cell infiltration (hematoxylin-eosin stain, original magnification ×400).
세뇨관 상피에 국소적으로 중등도 위축과 간질 내의 단핵구 세포의 침윤이 관찰되었다(Fig. 1B). 전자현미경검사는 검체가 신수질만 얻어져 검사에 부적합하였다. 면역형광현미경 검사에서 모세혈관벽에 IgG (2+), IgM (2+), C3 (1+), and C1q (2+), kappa (3+), lambda chain (1+)의 미만성 과립상 면역형광 반응이 관찰되었다(Fig. 2).

Immunofluorescence in initial kidney biopsy: (A) IgG, (B) IgM, (C) C3, (D) C1q, (E) kappa, and (F) lambda deposits (original magnification ×200).
골수검사에서 림프종 침윤의 소견은 보이지 않았다.
임상경과: 림프절외 변연부 B-세포 림프종에 대해 CHOP 항암화학요법 (cyclophosphamide 750 mg/m2, adriamycin 50 mg/m2, vincristine 1.4 mg/m2, prednisolone 100 mg)을 8차례 시행하였다. 3주 뒤에 시행한 복부 컴퓨터 단층촬영에서 항암화학요법 시행 전에 간좌엽에 장경 11 cm이었던 종괴의 길이는 3 cm로 작아졌으며, F-18 FDG PET/CT에서 흉선, 간, 림프절에서 대사항진 소견은 보이지 않아서, 림프절외 변연부 B-세포 림프종은 완전 관해된 것으로 평가하였다. 항암 치료 종료 후 2개월째 시행한 혈청 크레아티닌은 0.8 mg/dL이었고, 소변검사상 요 비중 1.013, 요 단백 음성, 요 현미경 검사에서 적혈구 1-2/HPF이었다. 일회 소변 단백/크레아티닌 비율은 0.27 mg/mg이었고, 혈청 보체 C3와 C4 수치도 정상이었다. 항암 치료 후 5개월째 일회 소변 단백/크레아티닌 비율이 0.59 mg/mg으로 증가하였고 일주일 뒤 1.0 mg/mg으로 증가하여 신장조직검사를 다시 시행하였다. 46개의 사구체가 관찰되었고, 그 중 15개(33%)는 구형 경화의 소견을 보였으며, 2개(4%)의 사구체는 분절성 경화가 관찰되었다. 남은 사구체에는 세포 수가 증가되어 보였다. 세뇨관 상피에서 국소적으로 심한 위축이 있었고, 간질에서 섬유화가 관찰되었다(Fig. 3). 전자현미경 검사는 검체가 부적합하였다. 면역형광현미경 검사에서 모세혈관벽에 IgM 면역형광 반응이 약하게 관찰되었다. 루프스양사구체신염의 재발 소견은 없어 외래 경과관찰하기로 하였고, 1개월 뒤 일회 소변 단백/크레아티닌 비율은 0.38 mg/mg으로 감소하였다. 항암 치료 후 10개월째 시행한 F-18 FDG PET/CT에서 대사항진 소견은 없었으며, 13개월째 혈청 크레아티닌은 1.0 mg/dL이었고, 일회 소변 단백/크레아티닌 비율은 0.36 mg/mg이었다.
고 찰
흉선은 T-세포의 성숙과 분화를 담당하는 장기로서, 흉선 림프절외 변연부 B-세포 림프종은 상당히 드물게 발생하고, 동양인과 중년 여성에서 호발한다[6]. 대부분 증상이 없이 우연히 발견되고, 81%에서 쇼그렌증후군, 류마티스관절염, 루프스와 같은 자가면역질환이나 고글로불린혈증이 동반된다[6]. 간 림프절외 변연부 B-세포 림프종 역시 극히 드물게 보고되고 있으며, 고령에서 주로 생기며, 만성 간염이나 원발담도경화증과 같은 간질환이 관련되어 있는 것으로 추정된다[7]. 흉선이나 간 림프절외 변연부 B-세포 림프종의 표준 치료법은 정립되어 있지는 않으나, 원발 부위에 국한된 경우 수술적 제거 혹은 방사선 치료를 하며, 병기가 진행된 경우 항암화학요법을 시행하며, 예후는 비교적 양호한 것으로 알려져 있다[6,7].
비호지킨림프종 환자 중에서 사구체신염의 발생 빈도는 0.6% 미만이며, 신장기능 저하, 신증후군 혹은 단백뇨, 혈뇨로 나타날 수 있다[8]. 일차성 사구체신염과 림프종과 관련된 이차성 사구체신염의 감별은 힘들지만, 림프종과 사구체신염이 비슷한 시기에 발생하며, 림프종이 치료되면서 사구체신염도 관해가 되면 림프종과 관련된 사구체신염의 가능성일 높겠다[8]. 림프종에서 사구체신염의 발병 기전은 확실히 밝혀지진 않았으나 냉글로불린혈증이나 단세포군감마글로불린혈증와 같은 면역학적 이상과 관련이 있을 것으로 보고 있다[8]. 본 증례의 환자에서는 냉글로불린혈증은 음성이었고, 단세포군감마글로불린혈증이 있었으나 신장조직검사에서 IgG, IgM, C3, C1q, kappa, lambda chain의 침윤과 메산지움의 세포 증식 및 광범위한 내피하침착 등 루프스신염을 시사하는 소견을 보였다. International Society of Nephrology/Renal Pathology Society의 루프스신염의 2003 분류법에서는 전 세계적으로 많은 기관에서 전자현미경 검사를 이용할 수 없는 경우가 있어서 루프스신염의 진단은 광학현미경 검사 및 면역형광현미경 검사 결과를 이용하여 진단할 수 있도록 하였다[9]. 이 증례에서 전자현미경검사 소견을 확인할 수는 없었으나, 광학현미경검사 및 면역형광현미경검사에서 특징적인 루프스신염의 소견들이 확인되었고, 환자는 49세 남자이며 ANA, 항 dsDNA 항체 음성, 루프스 관련된 임상증상은 없었기에 루프스양사구체신염으로 진단하였다. 관해 후 13개월째 추적관찰 중이나 루프스를 의심할 만한 소견은 없었다.
루프스의 발생 기전은 상당히 복잡하며, 자멸 세포에서 유리된 자가 항원이 정상적으로 처리되지 못하거나 바이러스 감염에 의해 자가 항체가 유도된 후 IFN-α가 강력히 유도되어 자가 반응 T 세포 활성화 및 자가 반응 B 세포에 의하여 자가 항체 생성이 촉진되고 면역 복합체의 생성이 항진되어 결국 장기 손상을 초래하는 것으로 이해되고 있다[10]. 이 점을 고려하면, T-세포나 B-세포의 비정상적 증식이 발생하는 림프종 환자에서 루프스질환이 발생할 수 있겠다. 루프스의 특징인 전신 침범이 아닌 신장에만 발생하는 것은 혈청에 존재하는 면역복합체가 신장에 수동적으로 침착하여 루프스신염이 발생한다는 기존 가설이 아닌 새로운 연구 결과들에 의해 설명될 수 있겠다. 신장 내의 특정 항원에 반응하여 면역복합체가 형성되고, 신장 내의 대식세포와 수지상세포에 있는 toll-like receptor를 통해 염증반응이 활성화되며, 케모카인 CCL2 및 다양한 케모카인에 의해 염증세포가 신장으로 모여 신장 손상을 초래한다[10]. 주혈흡충 감염과 HIV 감염 환자에서는 사구체에 기생충 혹은 HIV 항원의 침착이 확인되기도 하였다[3,4]. 그러나 림프종 환자에서 발생하는 루프스양사구체신염에서 암 항원 발현이 신장에 발생하였는지, 혹은 케모카인에 의해 신장 손상이 발생하였는지에 대한 것은 알려진 바 없으며, 향후 루프스양사체신염의 발병 기전에 대해서는 더 많은 연구가 필요하겠다.
루프스양사구체신염의 예후는 보고마다 다양하다. Pirkle 등[2] 및 Huerta 등[1]은 일차성 루프스양사구체신염을 보고하였다. Pirkle 등[2]이 보고한 막사구체신염 환자는 신장조직검사할 당시 혈청 크레아티닌 0.5 mg/dL, 24시간 단백뇨 1.2 g이었고, 5년 4개월간 신장기능은 정상 범위로 유지되었다. Huerta 등[1]은 광범위증식사구체신염 4예를 보고하였는데, 진단 당시 혈청 크레아티닌 0.8-3.5 mg/dL, 24시간 단백뇨 1.7-6 g이었고 면역억제제 치료에도 불구하고 6개월에서 2년 6개월 이내에 모두 말기 신부전으로 진행하였다. 이차성 루프스양사구체신염은 자가면역간염, 주혈흡충감염, HIV 감염 환자에서 보고된 바 있으며, 비호지킨림프종 환자에서도 1예가 보고된 바 있다[3-5,11]. Silva 등[5]은 자가면역간염 환자 12명, 간경화 환자 6명의 신장조직검사 결과를 보고하였는데, 자가면역간염 환자 중 7명에서 루프스신염에 의한 막사구체신염을 시사하는 소견을 보였고, 이들의 크레아티닌 청소율은 70 mL/min/1.73 m2 이상, 24시간 단백뇨 0.4 g 이내였으며, 1년간 신장 기능의 악화는 없었다. Sobh 등[3]은 주혈흡층 감염과 관련된 사구체신염을 보고하였는데, 이 중 루프스양사구체신염을 시사하는 증례들이 포함되었으며, 신장의 예후는 상당히 불량하였다. Haas 등[4]은 HIV 감염 환자에서 발생한 루프스양사구체신염 14예를 보고하였는데, 13명의 증식성사구체신염 환자 중 10명이 말기 신부전으로 진행하였으며 1명의 막사구체신염은 비교적 양호한 경과를 보였다. Haas 등[4]은 증식성사구체신염 환자에서 진단시 혈청 크레아티닌과 하루 3.5 g 이상의 단백뇨가 장기적인 신장기능저하와 관련되어 있을 것으로 추정하였다. 이 증례들을 보면, 신장의 예후는 진단 당시의 신장기능 및 단백뇨 정도 그리고 사구체질환 종류에 의해 영향을 받을 것으로 추측된다. 반면, Matignon 등[12]은 HIV 감염 환자에서 루프스양사구체신염 양상의 증식성사구체신염을 보고하였는데, 혈청 크레아티닌이 1.4 mg/dL이었고 24시간 단백뇨가 8.25 g이었다. 항레트로바이러스 치료 후 2년 6개월째 혈청 크레아티닌 0.7 mg/dL이었고 단백뇨는 소실되었다. Yeo 등[11] 및 본 증례에서는 비호지킨림프종 환자에서 발생한 루프스양사구체신염이 혈청 크레아티닌의 상승 및 단백뇨 증가가 있고, 신장조직검사상 광범위증식사구체신염의 소견을 보였으나, 비호지킨림프종 치료되면서 루프스양사구체신염은 관해되었다. 이 증례들을 고려하면, 루프스양사구체신염에서 원인질환의 치료 반응 또한 예후에 중요할 것으로 보인다.
이 증례에서 항암 치료 후 추적관찰 중 단백뇨의 증가소견이 보여 다시 시행한 신장조직검사에서 사구체의 33%에서 구형 경화, 4%에서 분절성 경화가 관찰되었다. 당시 어떤 원인에 의해 단백뇨가 일시적으로 상승했는지 알 수 없었으나, 항암 치료 후 신염이 혈액 및 소변검사상 완전 관해를 보였을지라도 신장손상은 뚜렷이 남았음을 알 수 있었다. 따라서, 림프종 환자에서 사구체신염의 동반이 의심되는 경우 초기에 적극적인 검사 및 치료가 필요할 것으로 사료된다.
