재발성 췌장염 및 신장 혈전성 미세혈관병증으로 나타난 항인지질증후군
Antiphospholipid Syndrome Presenting as Recurrent Pancreatitis and Renal Thrombotic Microangiopathy
Article information
Abstract
저자들은 재발성 췌장염과 신장 혈전성 미세혈관병증을 동시에 진단받은 환자에서 LA 양성인 APS를 진단하였고 저용량 스테로이드 및 항응고제로 치료한 증례를 경험하여 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Antiphospholipid syndrome (APS) is characterized by vascular thrombosis or recurrent fetal loss in the presence of antiphospholipid antibodies. APS has various manifestations because it can involve any vessel in most organs and tissues. There are a few reports of acute pancreatitis or renal thrombotic microangiopathy accompanying APS, but none on concurrent acute pancreatitis and renal thrombotic microangiopathy in Korea. The clinical consequences can be devastating, so a high index of suspicion is necessary for early diagnosis and treatment. We report an unusual case of APS-associated recurrent pancreatitis and renal thrombotic microangiopathy. A 33-year-old woman was admitted for severe epigastric pain attributed to acute pancreatitis. She subsequently developed an acute kidney injury and the histology revealed thrombotic microangiopathy. Four weeks later, she was readmitted with recurrent pancreatitis. After treatment with anticoagulation and low-dose steroid, her abdominal pain subsided and the amylase and lipase levels normalized.
서론
항인지질증후군(Antiphospholipid syndrome, APS)은 혈전 또는 반복적인 태아 소실이 잘 알려진 임상 소견으로 동반 질환의 여부에 따라 일차성 또는 이차성으로 분류된다. 가장 흔한 동반 질환은 전신홍반루푸스(Systemic lupus erythematosus, SLE)이며 이외에 류마티스관절염, 전신경화증, 쇼그렌증후군, 전신혈관염과 같은 자가면역 질환, C형 간염 바이러스, 사람면역결핍바이러스 등의 감염, 경구 피임약 복용, 혈액투석 그리고 부종양증후군으로도 병발 가능하다[1]. APS에서 다양한 소화기 증상이 보고되었는데 Budd-Chiari 증후군, 간정맥폐쇄성질환, 간경화, 문맥압항진증과 같은 간 침범이 가장 흔하다. 장경색, 비장경색 그리고 드물게 급성 췌장염 또한 발생할 수 있다[2]. APS 환자에서 재발성 췌장염과 혈전성 미세혈관병증이 동시에 발생한 증례는 해외에서 1예만이 보고되었고 국내에서는 보고된 적 없다.
저자들은 급성 복통으로 내원하여 췌장염 진단 후 보존적 치료 중 급성 신손상이 발생하여 시행한 조직검사에서 혈전성 미세혈관병증 소견을 보이고 항인지질항체인 루푸스항응고 인자(lupus anticoagulant, LA) 양성으로 APS로 진단하였고 저용량 스테로이드 및 아스피린 투여 후 회복되었다가 췌장염 재발하여 항응고제로 변경 후 임상 증상의 개선을 보였기에 증례 보고한다.
증례
환자: 33세, 여자
주소: 갑자기 발생한 상복부 복통
현병력: 내원 당일 오후 2시부터 갑자기 상복부 복통이 나타났고 오후 3시 통증 악화되어 본원 응급실에 내원하였다.
과거력: 2009년 구개열로 편도절제술 시행한 것 외에 고혈압, 당뇨, 결핵 그리고 간염의 과거력은 없었다. 유산 및 사산력, 경구 피임약 복용력 및 호르몬 보충요법을 시행 받은 과거력은 없고 최근 입원, 외상력, 장시간 비행 그리고 운전 등의 위험인자는 없었다.
사회력: 음주력은 1달에 1회 소주 1병, 흡연력은 6.5 갑년이었다.
가족력: 특이 사항은 없었다.
신체검사: 내원 당시 급성 병색 소견, 혈압 110/70 mmHg, 맥박 76회/분, 체온 36.4°C, 호흡수 20회/분이었고 의식은 명료하였다. 피부에 이상 발적이나 홍조는 없었다. 공막 황달은 동반되지 않았다. 폐음은 정상이었고, 복부 진찰에서 부드럽고 명치 부위 압통은 있으나 반발통은 없었다. 양쪽 늑척추각압통은 없었다.
검사실 소견: 말초 혈액 검사에서 백혈구 12,600/μL (호중구 84.3%, 호산구 0.0%, 림프구 13.7%, 단핵구 1.1%, 호염기구 0.9%), 혈색소 11.9 g/dL (정상 범위 12-16 g/dL), 혈소판 367,000/μL (정상 범위 130,000-450,000/μL), 적혈구 침강 속도 13 mm/hr (정상 범위 0-20 mm/hr), 그리고 C-반응 단백 2.26 mg/dL (정상 범위 0.01- 0.29 mg/dL)이었다. 생화학검사에서 AST 31 IU/L (정상 범위 0-40 IU/L), ALT 30 IU/L (정상 범위 0-41 IU/L), 총 빌리루빈 0.2 mg/dL (정상 범위 0-1.2 mg/dL), ALP 89 IU/L (정상 범위 35-130 IU/L), GGT 588 IU/L (정상 범위 5-61 IU/L), BUN 25.3 mg/dL (정상 범위 6-20 mg/dL), Creatinine 0.66 mg/dL (정상 범위 0.5-1.1 mg/dL), 총 단백 6.4 g/dL (정상 범위 6.4-8.3 g/dL), 알부민 4.1 g/dL (정상 범위 3.5-5.2 g/dL), 그리고 칼슘 9.3 mg/dL (정상 범위 8.6-10.2 mg/dL)이었다. amylase 791 IU/L (정상 범위 28-100 IU/L), lipase 2,046 IU/L (정상 범위 13-60 IU/L)로 상승 소견이 있었다. 면역 혈청 검사에서 HBsAg 음성, anti-HBs 양성, anti-HCV 음성이었다. 갑상선 기능 검사는 T3 65.94 ng/dL (정상 범위 60-190 ng/dL), TSH 8.48 IU/mL (정상 범위 0.25-4 IU/mL), free T4 0.56 ng/dL (정상 범위 0.89-1.76 ng/dL)이었다. aPTT 29.5 sec (정상 범위 27.8-41.7 sec), INR 1.02였다.
방사선 소견: 내원 당일 실시한 복부 전산화 단층 촬영(computed tomography, CT)에서 췌장 주위의 체액 저류를 동반한 전반적인 췌장 부종이 나타나 Balthazar 분류 기준에 의한 등급 D의 급성 췌장염 소견에 합당하였다(Fig. 1). 비장경색, 신경색 등의 소견은 없었다.
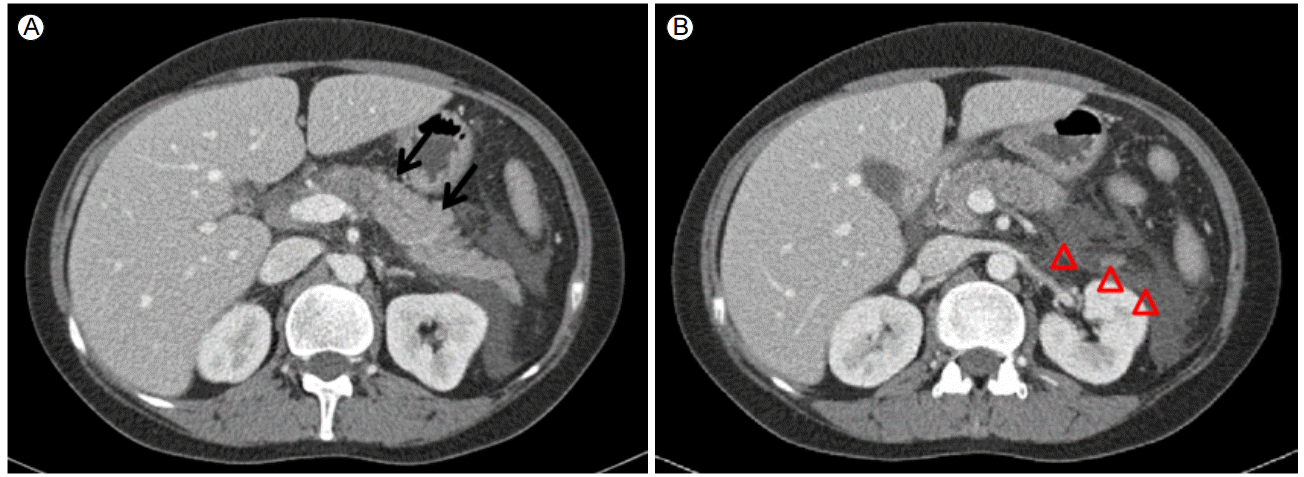
Computed tomography of the abdomen and pelvis with contrast showed (A) diffuse parenchymal swelling (arrows) with (B) peripancreatic fat infiltration and fluid collection (arrowhead). There was no evidence of renal infarction.
치료 및 경과: amylase, lipase 상승 및 CT 소견으로 급성 췌장염을 진단하여 금식 및 수액 치료를 유지하며 보존적 치료를 시행하던 중 내원 3일 후부터 BUN/Creatinine 31.3/1.48로 상승, 사구체여과율 46.2 mL/min/1.732로 저하, fractional excretion of sodium (FENa) 4.43으로 상승하였다. 급성 신손상과 더불어 혈소판 감소(52,000/μL)가 발생하였고 내원 10일 후 급격한 혈소판 증가(641,000/μL)를 보였다. 당시 시행한 aPTT가 49초로 연장되었다. 급성 신손상의 원인을 감별하기 위해 시행한 조직검사에서 사구체 모세혈관 벽의 주름, 모세혈관내 증식 및 혈관간부 이입(mesangial interposition)으로 인한 내강 폐쇄 및 새로운 기저막 형성 소견을 보여 혈전성 미세혈관병증에 합당한 소견이었다(Fig. 2). 면역형광검사에서 면역복합체 침착은 보이지 않았다(Fig. 3).
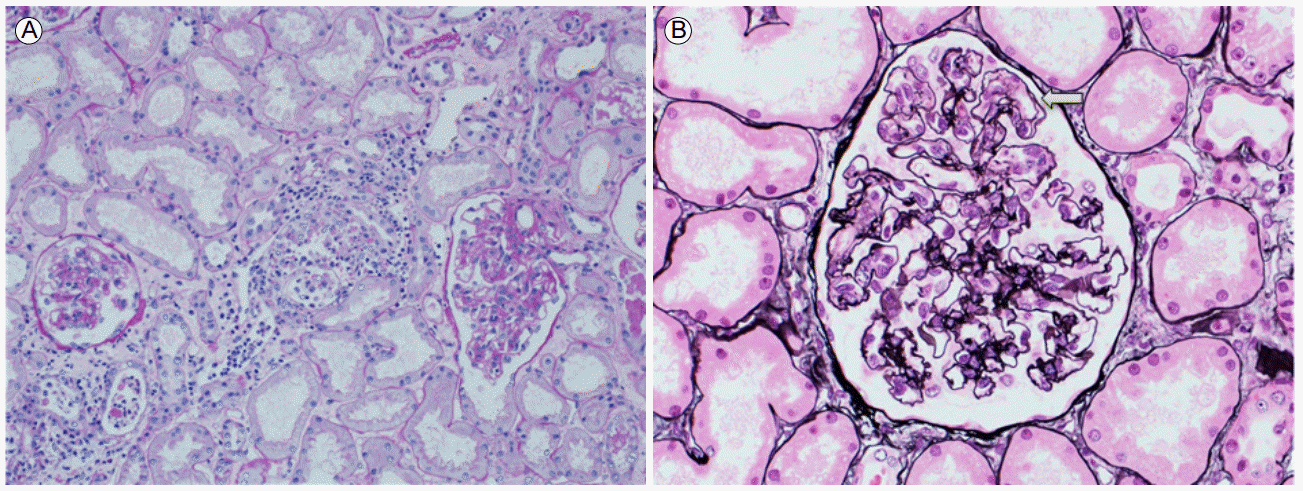
The renal biopsy showed (A) patchy interstitial edema and infiltration with acute tubular injury (Periodic acid-Schiff ×100). (B) A few capillary loops showed endocapillary proliferation, mesangial interposition with a double membrane, and an obstructive thrombotic lesion (arrow) (silver, ×400).
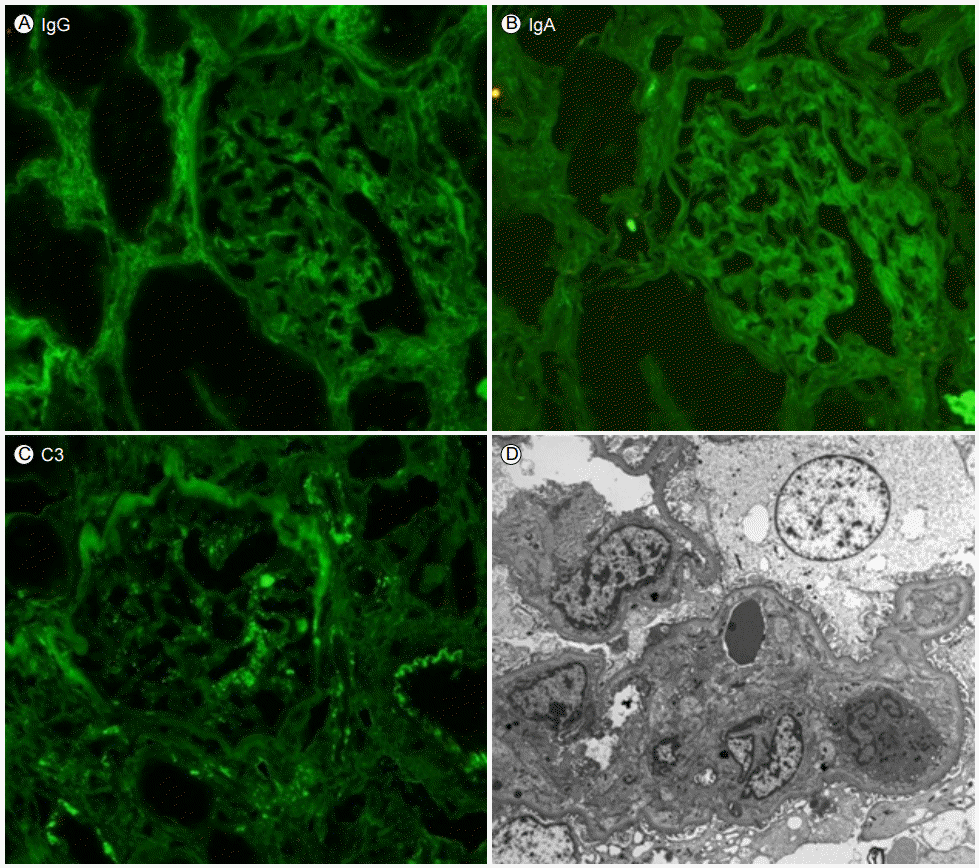
(A-C) Immunofluorescent staining showed no deposits of immune material. (D) The capillary lumen is nearly obliterated by endocapillary proliferation and mesangial interposition, with no electron-dense deposits (original magnification, ×3,000).
이후 amylase, lipase가 지속적으로 높고 복통이 지속되어 췌장염의 재발이 일반적인 치료로 호전되지 않고 신장의 혈전성 미세혈관병증의 원인으로 자가면역질환을 감별하기 위해 시행한 자가항체 검사에서 항핵항체 음성, C3/C4 136/38 mg/dL (정상 범위 65-135/13-35 mg/dL), 항 Ro/La 항체 음성, 면역글로불린(Immunoglobulin, Ig) G 697 mg/dL (정상 범위 870-1,700 mg/dL), IgG4 249 mg/L (정상 범위 30-2,010 mg/L), IgA 155 mg/dL (정상 범위 110-410 mg/dL), IgM 36 mg/dL (정상 범위 35-220 mg/dL), 항카디오리핀 항체(anticardiolipin antibody, aCL) IgG 및 IgM 음성, 항베타2-당단백항체(anti-β2 glycoprotein I antibody, anti-β2GPI) IgG 및 IgM 음성, C-ANCA 및 P-ANCA 음성이었다. 그러나 diluted Russel viper venom time mixing ratio 검사법으로 시행한 루푸스항응고 인자(lupus anticoagulant, LA)는 1.28 (정상 범위 0-1.19)로 상승하였다. 위의 결과를 바탕으로 일차성 APS에 의한 재발성 췌장염 및 신장 혈전성 미세혈관병증을 진단하였다. 이에 대하여 보존적 치료, 아스피린 및 저용량 스테로이드 투약 후 복통 호전되었으며 BUN/Creatinine, amylase, lipase 회복되어 퇴원하였다. 퇴원 27일 후 급성 췌장염으로 인한 복통으로 재입원하여 보존적 치료, 저용량 스테로이드 지속 및 와파린 투여 후 amylase, lipase 정상화 및 복통 소실되어 퇴원하였다. 환자는 6주 후 재검한 LA 양성이었고 12주에 재검하였을 때 음성으로 전환되었다. APS에서 항응고제 치료 후 LA가 음성으로 전환되기도 하고 일반적인 급성 췌장염 치료에도 불구하고 호전되지 않던 중 신장 혈전성 미세혈관병증 추가로 발생하여 항응고제 치료 후 급성 췌장염 및 급성 신손상이 호전되어 APS에 의한 급성 췌장염 및 신장 혈전성 미세혈관병증으로 항응고제 치료를 지속하였다. 치료 중 환자가 1달간 항응고제 중단 후 췌장염 재발하여 내원하였고 이때 시행한 LA는 다시 양성이어서 APS의 진단기준에 합당하였다. 현재 증상의 재발 없이 외래에서 경과 관찰 중이다.
고찰
APS는 항인지질항체가 12주 이상의 간격을 두고 두 번 이상 양성이면서 혈관 혈전 또는 반복적인 유산, 사산 등의 전형적인 임상 소견이 있을 때 진단한다. APS의 병리 기전은 아직 명확하게 밝혀지지 않았으나 항인지질항체가 혈소판 활성화 및 응집 촉진, 혈관 내피세포 및 단핵구 활성화, 섬유소 용해계 억제, 응고 다단(coagulation cascade) 활성화, 보체 활성화를 포함한 다양한 기전을 통해 혈전 형성에 중요한 역할을 하는 것으로 알려져 있다. 이는 혈소판 표면에 당단백(특히 당단백IIb-IIIa) 발현을 증가시켜 혈소판 응집을 유발한다. Toll-like receptor (TLR)는 세포 표면에 발현되는 세포막 단백질로 선천성, 후천성 면역반응 및 염증반응에 관여한다. 항인지질항체는 TLR를 활성화시켜 신호전달을 통해 내피세포 표면에 세포부착분자(cellular adhesion molecule)와 조직인자(tissue factor)가 과발현 되도록 한다. 이로 인해 염증성 사이토카인이 분비되고 혈관내피세포에 단핵구가 부착되어 혈전 형성에 중요한 역할을 한다[3]. APS에서 혈전 형성에 가장 중요한 인자는 양성인 항인지질항체의 종류(aCL IgG/IgM, LA, anti-β2 GPI IgG/IgM)와 지속 기간 등이다. 이외에도 다른 혈전 위험인자의 동반 여부, 기저 자가면역질환의 존재 여부에 따라 혈전 발생률이 달라진다. LA가 혈전과 가장 밀접한 연관을 가지고, anti-β2 GPI만 상승한 경우는 APS의 임상 양상과 연관이 적다는 연구도 있다[4].
APS는 모든 조직 및 기관의 혈관을 침범할 수 있기 때문에 매우 다양한 임상양상으로 나타날 수 있다. 1,000명의 APS 환자를 대상으로 한 코호트 연구인 Euro-Phospholipid project의 발표에 따르면 APS의 가장 흔한 증상은 심부정맥혈전증이다. 이 외에 관절통, 관절염, 혈소판 감소증, 망상피반, 편두통, 뇌졸중이 주로 나타나는 증상들이다[4]. APS에 의한 소화기증상 또한 다양한데 이 중 간을 가장 흔하게 침범하며 주요 동맥, 정맥 혈전에서부터 미세혈전, 혈전이 없는 간 질환에 이르기까지 다양한 범주의 간질환이 발생할 수 있다. 혈전과 관련 있는 간질환에는 간정맥 유출의 폐쇄를 의미하는 Budd-Chiari 증후군, 간정맥폐쇄질환, 간경색이 포함된다. 간문맥 혈전증으로 나타나는 경우 간문맥압 항진을 초래하여 식도 정맥류, 간 괴사 등의 심각한 합병증을 유발할 수 있다[5]. 혈전이 없는 간질환으로 섬유중격을 동반하지 않고 다수의 재생결절이 간 실질에 미만으로 퍼져 있는 간의 결절성 재생증식(nodular regererative hyperplasia), 자가면역 간질환 그리고 간경화 등이 발생할 수 있다. 이 경우 무증상에서부터 간부전까지 다양하다. 장간막혈관 혈전은 장경색을 일으키고 식후 복통, 복부 팽만, 체중 감소, 드물게 장출혈을 유발한다. 비장경색은 주로 복부혈관 폐쇄와 함께 나타난다[2].
드물지만 APS에서 췌장염이 생기는 기전은 혈전성 혈관병증으로 설명되어 정확한 진단을 위해 췌장의 조직검사를 시행하기도 한다. 국내에서는 본 증례와 같이 췌장염의 반복과 급성 신손상이 함께 동반된 경우는 보고된 바 없고 항인지질증후군에 동반된 급성 췌장염 및 비장경색 1예가 보고되었다. 보고에 의하면 첫 췌장염 발병 당시 보존적 치료 후 회복되었고 췌장염 재발하여 쿠마딘 투약하며 호전되었다[6]. 해외에서 괴사성 췌장염 및 급성 신손상, 비장경색으로 나타난 일차성 APS 증례를 보고하였고 췌장 및 신장 생검에서 혈관 혈전이 밝혀졌다. 위 증례의 환자는 혈액투석 및 보존적 치료 후 퇴원하였다가 췌장염 재발로 항응고제 복용과 혈액투석, 비장절제술, 원위부 췌장절제술 시행 받았으나 수술 후 복강내 농양 발생하여 배액술 및 항생제 사용하다 패혈증으로 사망하였다[7].
APS에서 신장 침범 시에는 무증상의 단백뇨에서 측복부 통증과 고혈압이 나타나는 신피질의 경색, 급성 또는 아급성 신손상까지 나타날 수 있고 투석을 요하기도 한다[8]. 혈전성 미세혈관병증은 신장 침범의 흔한 병리학적 소견으로 미세혈관이 혈소판 혈전으로 좁아지거나 막히게 된다. 초기 소견으로 혈관벽이 두꺼워지고 내피세포가 혈관 기저막으로부터 분리되고 그 사이에 솜털 같은 물질이 침착된다. 새로운 사구체 기저막이 형성되어 두 층이 되거나 허혈성 변화로 인해 기저막이 쭈글쭈글하게 된다. 사구체 간질 기질의 융해(mesangiolysis), 기저막 사이에 사구체 간질의 삽입(mesangial interposition) 또한 보일 수 있다[8,9]. 전자현미경에서 내피세포 하방에 전자가 희박한 부위가 관찰될 수 있고 면역형광현미경에서 면역복합체 침착은 보이지 않아야 한다. 혈전성 미세혈관병증은 주로 LA 양성과 관련이 있다는 연구가 있었다[7]. LA는 헤파린이나 경구 항응고제를 투약하는 환자에서 위양성 소견을 보일 수 있어 결과 해석에 주의를 요한다. 2013년 항응고제를 복용 중임에도 재발한 신경색 환자에서 LA 단독 양성 소견을 보여 APS를 진단한 사례가 보고되었고 본 증례에서 흡연 외에는 급성 췌장염 및 혈전의 유발인자가 없는 환자에서 재발성 급성 췌장염 발생하여 APS에 의한 급성 췌장염 및 신장 혈전성 혈관병증에 합당하다고 보았다. 혈소판 감소를 동반한 APS의 감별진단으로 혈전성 혈소판 감소성 자반(thrombotic thrombocytopenic purpura, TTP), 파종성 혈관내 응고(disseminated intravascular coagulation, DIC)가 있으며 APS와 위 질환들이 동반되기도 한다. 본 증례에서는 용혈 빈혈 및 자반이 없었고 혈소판 감소 이후 급격한 혈소판 증가 있어 TTP를 배제하였다. Fibrinogen degradation product (FDP)가 상승하였으나 fibrinogen 정상 범위이고 DIC에서는 대개 항인지질항체가 음성인 점, The International Society of Thrombosis and Haemostasis (ISTH)에서 제시한 DIC score 5점 미만을 근거로 DIC의 가능성은 낮을 것으로 판단하였다.
APS에서 혈전 발생의 고위험군은 LA 양성, 또는 LA, aCL 그리고 anti-β2GPI 모두 양성인 경우, SLE 환자에서 aCL이 중등도 또는 높은 역가로 지속 양성인 경우이다. 혈전 발생의 저위험군은 aCL, anti-β2GPI가 낮은 또는 중등도 역가로 단독으로 양성이거나 간헐적으로 양성을 보이는 경우이다. 항인지질항체 양성이지만 혈전 과거력이 없고 SLE가 동반되지 않은 환자에서 아스피린 치료는 권고되지 않지만 혈전 발생의 고위험군인 경우 또는 다른 혈전 위험인자가 함께 있는 경우 저용량 아스피린이 일차 예방 약제로 권고된다. APS이면서 정맥 혈전이 처음으로 발생한 경우 경구 항응고제를 복용하는 것이 권유되고 목표 INR은 2-3이다. INR을 3 이상으로 유지하는 것은 재발률을 줄이지 못한다. APS이면서 동맥혈전 또는 재발성 혈전을 동반한 경우 목표 INR을 3 이상으로 유지하면 재발률이 감소하며 출혈로 인한 사망은 혈전으로 인한 사망보다 덜 흔하다[4]. 그러나 항응고 요법의 치료 시에는 환자의 출혈에 대한 위험도를 고려하여야 한다. 치료 후 혈전 재발의 위험은 치료 중단 첫 6개월에 가장 높다. 따라서 이전에 혈전이 발생하였던 환자에서는 평생 항응고 치료가 필수적이다[10].
APS는 췌장염 및 신장 혈전성 미세혈관병증의 드문 원인이나 진단 및 치료가 늦어지면 환자의 예후에 치명적일 수 있어 재발성 췌장염에서 원인이 명확하지 않은 경우 APS를 원인 질환으로 고려해야 한다.