내시경초음파 유도하 중재시술
Endoscopic Ultrasound Guided Intervention
Article information
Trans Abstract
Endoscopic ultrasound (EUS) has recently become widely used for the diagnosis and treatment of gastrointestinal disease. With applications of linear EUS and EUS-guided fine needle aspiration, many EUS-guided interventions are now emerging as feasible treatment options for patients with pancreatobiliary disease. EUS-guided drainage from pseudocyst, bile duct, pancreatic duct, and the gallbladder are becoming routine procedure. EUS-guided celiac plexus neurolysis and block can relieve intractable pancreatic pain. Moreover, EUS-guided local tumor therapy (ethanol ablation and radiofrequency ablation) may be feasible in selected patients. Safe EUS-guided intervention requires a good deal of experience but is becoming widely used to treat pancreatobiliary disease.
서론
내시경초음파(endoscopic ultrasound, EUS)는 선단에 초음파를 부착한 내시경을 이용하여 위장관 벽을 통해 내부 장기에 근접시킨 후 고주파수의 초음파를 이용하여 영상을 얻는 검사법이다. 내시경초음파는 일반적인 복부초음파보다 고주파(7.5-12 MHz)를 이용할 수 있어 해상도가 높고, 복벽이나 장관 내 공기에 의한 검사의 제한을 극복할 수 있는 장점이 있다. 내시경초음파는 1980년대 최초로 소개된 이후 검사 장비와 술기의 발달과 더불어 많은 발전을 거듭하고 있으며, 최근에는 식도, 위, 십이지장, 간, 담도, 췌장, 대장 및 직장에 이르는 소화기계 질환 전반에서 활발하게 사용되고 있다. 특히 췌담도 분야에서는 진단 목적의 방사형 내시경초음파(radial EUS)뿐만 아니라, 선형배열 내시경초음파(linear EUS)의 발달로, 내시경초음파 유도하 세침흡인술(EUS guided fine needle aspiration) 및 이를 응용한 내시경초음파 배액술, 췌담도 종양의 내시경적 치료 등이 가능하게 되었다. 이는 기존의 침습적인 치료들을 상당부분 대체할 수 있을 것으로 보이며, 향후 그 적용범위가 더 넓어질 것으로 예상된다. 본 고에서는 최근 들어 많은 발전을 보이고 있는 췌담도 분야의 내시경초음파 유도하 중재시술에 대해서 기술하고자 한다.
본론
내시경초음파 유도하 가성 낭종 배액술(EUS-guided pseudocyst drainage)
급성 또는 만성 췌장염의 합병증으로 발생하는 가성 낭종(pseudocyst)은 증상이 없는 경우 내과적 경과관찰이 가장 우선적인 치료방침이다. 하지만 감염, 출혈, 장관 폐쇄, 누공 발생, 담도 폐쇄 등의 합병증이 발생하는 경우 배액술이 필요하게 된다. 전통적으로 수술적 배액술과 경피적 배액술이 많이 사용되어 왔으나 수술 관련 사망 혹은 감염, 출혈, 누공 등의 합병증의 빈도가 높은 것으로 알려져 있다. 최근에는 내시경초음파를 이용한 가성 낭종 배액술이 널리 사용되고 있으며, 기존의 수술적 및 경피적 배액법을 대체해 나가고 있다[1]. 췌장염 발생 후 초기 2주는 전신 염증 반응이 주로 일어나는 시기이며, 이때는 대부분 췌장 주위 액체 고임에 벽이 형성되지 않아 배액술을 시도할 경우 합병증 발생 가능성이 높으므로 보존적 치료 및 경과관찰이 추천된다. 췌장염 발생 후 2-4주가 경과되어 정형화된 외벽이 형성되면 내시경초음파를 이용한 배액술을 시행할 수 있게 된다[2].
과거에는 내시경적 가성 낭종 배액술을 위해 십이지장경이 사용되었는데, 이는 가성 낭종에 의한 외부 압박으로 관강이 융기되어 있는 부위를 확인한 후 직접 이 부위를 맹목적으로 천자하는 방법이다. 하지만 천자 과정에서 혈관 및 주변 장기 손상이 발생할 가능성이 높다. 내시경초음파 유도하 배액술(EUS-guided pseudocyst drainage)의 경우, 관강 융기부위가 없어도 천자가 가능하고, 가성 낭종으로 오인될 수 있는 췌장 낭성 종양과의 감별이 용이하며, doppler를 이용할 경우 정맥류 등의 혈관을 피해 안전하게 천자가 가능하다는 장점이 있다[3].
구체적인 시술 방법은 다음과 같다(Fig. 1). 선형 배열 초음파내시경으로 췌장 주위 액체 저류를 확인한 후, 내시경과의 최단 거리를 확인하고, 19 gauge needle을 이용하여 천자를 시행한다. 낭종 내부의 액체를 흡인하여 검체로 내보내고 조영제를 주입하여 투시조영(fluoroscopy)으로 낭종의 크기와 경계를 확인한 후 유도선(guidewire)을 낭종 내로 충분히 진입시킨다. 이후 needle을 제거하고 needle knife나 cystotome 등을 통과시켜 누공을 확장시키고 충분한 확장을 위해 확장형 풍선 카테터를 이용하여 누공을 확장시킨다. 마지막으로 확장된 누공에 배액관을 삽입하고 시술을 종료한다[4]. 배액관으로는 초기에는 1–2개의 플라스틱 스텐트가 많이 사용되었으나 최근에는 특수 제작된 자가 팽창형 금속 배액관이 많이 사용되고 있다[5]. 여러 개의 플라스틱 스텐트를 삽입하기 위해서는 풍선확장술이 필요하나 금속 배액관은 풍선확장술 없이도 삽입이 가능하여 시술시간을 단축할 수 있다. 또한 금속 배액관은 폐쇄, 이탈이 적고 스텐트를 장기간 유지할 수 있는 장점이 있으며, 췌장 괴사가 동반된 경우에는 금속 배액관을 삽입한 후 내시경적 괴사제거술(endoscopic transluminal necrosectomy)을 시행할 수 있다[6,7].
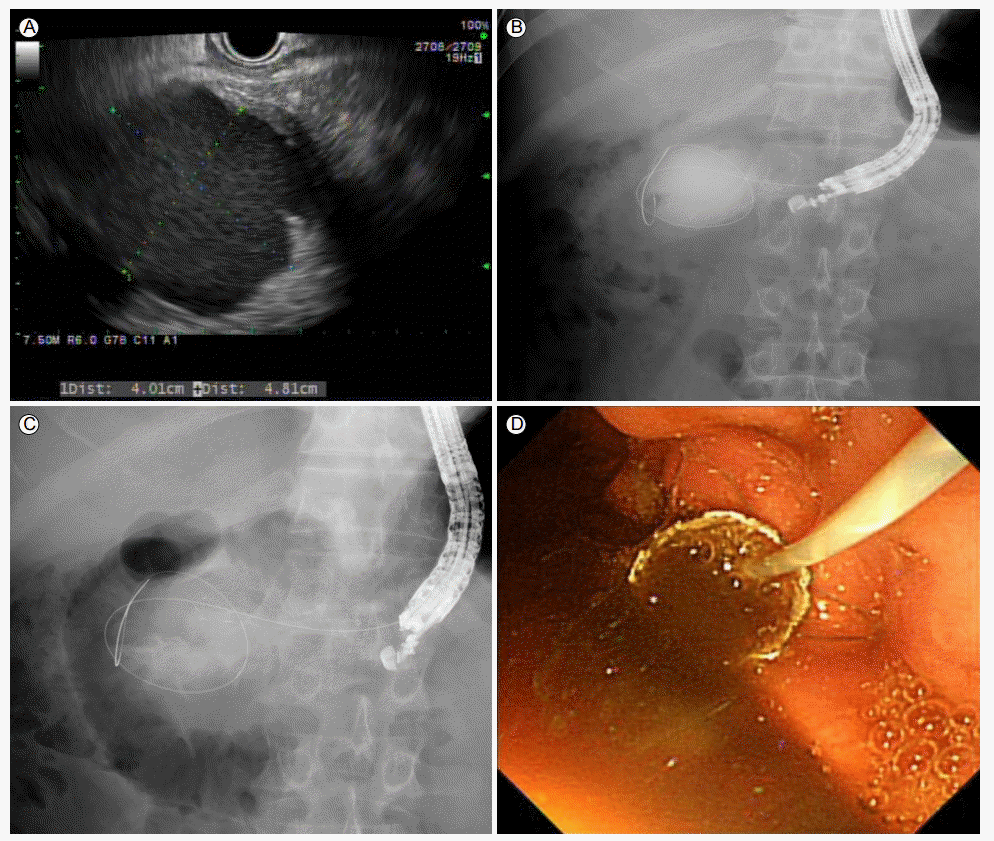
EUS-guided pseudocyst drainage. (A) A 5-cm-diameter pseudocyst was evident in the pancreatic head. (B) After the needle puncture was performed, a guidewire was inserted into the pseudocyst. (C) A metal stent was placed, commencing in the duodenum. (D) An endoscopic view of the metal stent. EUS, endoscopic ultrasound.
내시경초음파 유도하 가성 낭종 배액술은 여러 연구에서 90% 이상의 technical success, 80% 이상의 clinical success를 보이고 있다[8,9]. 또 특수 제작된 배액관의 사용으로 향후 보다 효과적이고 안전한 시술이 가능할 것으로 생각된다. 내시경초음파 유도하 가성 낭종 배액술은 비교적 안전한 시술로 알려져 있으나, 시술과 관련한 출혈, 배액관 이탈, 천공, 기복증(pneumoperitoneum) 등의 합병증이 발생할 수 있으므로 시술에 대한 충분한 이해와 훈련이 필요하다[9].
내시경초음파 유도하 담도 배액술(EUS-guided biliary drainage)
1990년대에 내시경초음파를 이용하여 위벽을 통한 담도 및 췌관 조영술이 보고된 이후 내시경초음파 유도하 담도배액술에 대한 많은 보고들이 있었다[10,11]. 악성 담도 폐쇄에서 기본적인 치료방법은 내시경적 역행성 담도췌관조영술(Endoscopic retrograde cholangiopancreatography, ERCP)이며 숙련자들에서 경유두 삽관 성공률은 95% 이상으로 높게 보고되고 있다. 하지만 십이지장 제2부의 폐쇄나 기존의 수술력 등으로 유두부 접근이 불가능하거나 선택적 삽관이 성공하지 못하면 결국 ERCP에 실패하게 된다. 이 경우 전통적인 구제요법으로 경피경간 담도배액술(Percutaneous transhepatic biliary drainage, PTBD)이 사용되었다. 하지만 PTBD와 연관된 담즙누출, 누공, 농양 등의 합병증이 최대 30%까지 보고되고 있고, 체외배액관에 의한 삶의 질 저하가 동반되는 단점이 있다[12-15]. 이 경우 내시경초음파 유도하 담도배액술(EUS-guided biliary drainage, EUS-BD)을 고려해 볼 수 있다. EUS-BD는 ERCP가 실패했을 때 one-stage로 시행이 가능하고 체외배액관이 없어 삶의 질 저하가 없으며 PTBD에서 발생할 수 있는 합병증을 피할 수 있는 장점이 있다.
EUS-BD에는 위와 좌측 간내담도를 연결하는 간위연결술(hepaticogastrostomy, EUS-HGS), 십이지장 구부와 간외담도를 연결하는총담관십이지장연결술(choledochoduodenostomy, EUS-CDS), 내시경초음파 유도하에서 담도 천자를 시행한 후 유도선을 유두부로 내린 후 ERCP를 시행하는 rendezvous (EUS-RV) 방법이 있다. 이 중에서 EUS-RV는 비교적 안전한 시술 방법이나 유도선의 유두부 통과 성공률이 40-50%로 낮아 많이 사용되지 못하고 있으며, 경벽 배액법(transmural drainage)인 EUS-HGS와 EUS-CDS가 흔히 사용되고 있다. EUS-HGS의 시행 방법은 다음과 같다. 위의 상체부에서 EUS로 좌측 간내담도의 2구역 혹은 3구역을 묘출하여 확장된 간내담도를 확인한 후 19 gauge needle로 천자하여 담즙이 흡인되는 것을 확인하고 조영제를 투여하여 담도를 조영한다. EUS-CDS는 십이지장 구부에서 long scope position으로 확장된 간외담도를 확인한 후 19 gauge needle로 천자하여 담즙이 흡인되는 것을 확인하고 조영제를 투여하여 담도를 조영한다. 이후 과정은 공통적으로 유도선을 진입시키고 needle knife로 누공을 확장시킨 후 플라스틱 배액관이나 자가 팽창형 금속 배액관을 삽입하고 시술을 종료하는 것이다(Fig. 2) [4].
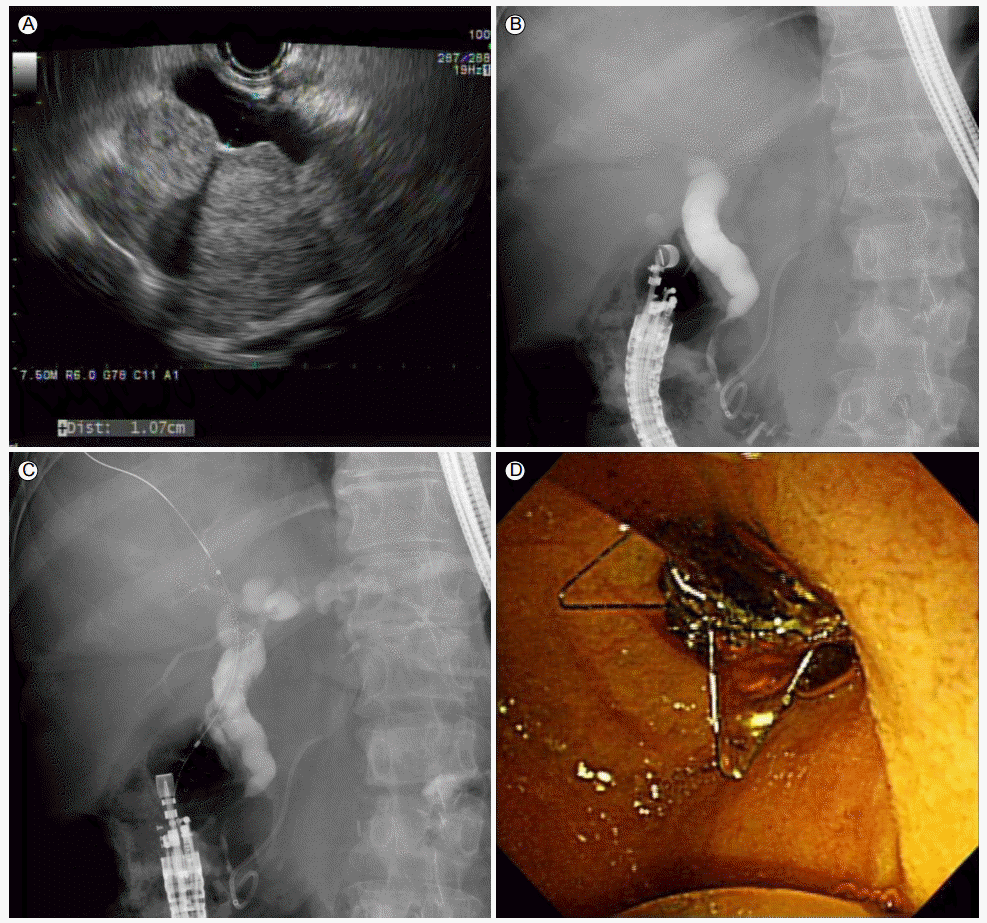
EUS-guided biliary drainage (choledochoduodenostomy) to treat obstructive jaundice caused by duodenal metastasis of ovarian cancer. (A) The CBD was dilated, as evidenced upon linear EUS. (B) After needle puncture, contrast was injected and a cholangiogram obtained. (C) A guidewire was inserted and a metal stent placed from the duodenum into the CBD. (D) An endoscopic view of the metal stent. EUS, endoscopic ultrasound; CBD, common bile duct.
최근의 연구들에서 본 시술의 technical, clinical success는 90% 이상으로 보고되고 있고[16,17], 시술자의 숙련도와 스텐트의 개량에 따라 그 성적은 더욱 향상될 가능성이 있다. 장기적으로는 ERCP가 실패한 환자에서 PTBD를 대체할 수 있는 내시경 배액술로 발전할 것으로 예상된다. 하지만 스텐트 이탈, 담즙 복막염, 기복증 등의 합병증 발생 가능성이 있어 경험이 많은 시술자가 신중하게 시행하는 것이 바람직하다[18].
내시경초음파 유도하 췌관배액술(EUS-guided pancreatic drainage)
만성 췌장염이나 췌장암에 의해 췌관 확장이 있어 ERCP를 시행했을 때 유두부 접근이나 선택적 삽관에 실패하게 되는 경우, ERCP의 구제요법으로 내시경초음파 유도하 췌관배액술(EUS-guided pancreatic drainage)을 고려할 수 있다. 전체적인 시술의 진행 방법은 앞서 기술한 담도 배액술과 유사하며, 위 또는 십이지장 구부에서 확장된 췌관을 묘출한 후 췌관을 천자하여 췌액을 흡인하고 조영제를 투여하여 췌관을 확인한다. 이후 누공의 형성 및 확장을 시행하고 배액관을 삽입한다[4]. 하지만 만성 췌장염의 경우 췌장 실질이 단단하고 유도선이 깊게 삽입되지 않아서 담도 배액술에 비해 시술의 난이도가 높은 편이다.
췌관이 확장된 경우에서 ERCP가 실패하게 되면 수술 외에는 다른 마땅한 대안이 없기 때문에 향후 이 시술의 발전 가능성은 높을 것으로 여겨진다. 하지만 담도 배액술에 비해 증례 수가 적고 시술 후 추적기간이 짧은 편이다. 최근의 메타 분석에 의하면 technical success rate는 76.6%, 합병증 발생률은 18.9%로 담도 배액술에 비해서 성적이 떨어지며, 앞으로 보다 많은 시술 경험과 연구가 필요할 것으로 생각된다[19].
내시경초음파 유도하 담낭배액술(EUS-guided gallbladder drainage)
급성 담낭염의 표준 치료는 복강경하 담낭 절제술(laparoscopic cholecystectomy)이다. 하지만 전신상태 저하로 수술진행이 어렵거나 급성 염증이 심한 경우에서 구제요법 혹은 연결요법으로 경피적 담낭배액술(percutaneous transhepatic gallbladder drainage, PTGBD)이나 내시경적 경유두 담낭배액술(endoscopic transpapillary gallbladder drainage, ETGBD)이 사용되고 있다. 하지만 PTGBD는 체외배액관을 거치하는 데 따른 삶의 질 저하가 있고, ETGBD는 선택적 삽관 실패나 유도선의 담낭관 통과가 안 되는 경우가 있는 단점이 있다. 이 경우 내시경초음파 유도하 담낭 배액술(EUS-guided gallbladder drainage)을 고려해 볼 수 있다.
위 전정부나 십이지장 구부에서 담낭을 묘출한 후 담낭의 운동성이 가장 적은 경부를 향하여 19 gauge needle을 이용하여 천자한 후 담즙이 흡인되는 것을 확인한다. 이후 조영제를 투여하여 담낭의 경계를 확인한 후 유도선을 진입시켜 충분히 삽입하고 needle knife로 누공을 확장시킨다. 마지막으로 플라스틱 스텐트나 금속 스텐트를 삽입한다(Fig. 3) [4]. 현재까지 보고된 시술례는 많지 않은 편으로 향후 많은 연구가 필요한 상태이나, 현재까지 technical success가 84.6-100%, functional success는 100%로 보고되었다[20-22]. 본 시술은 비교적 안전하게 시행될 수 있는 것으로 알려져 있으나, 술기에 익숙하지 않은 경우 담즙누출이나 담즙복막염 등의 합병증이 발생할 위험이 있다. 향후 시술 경험의 축적과 적절한 스텐트의 개발로 보다 효과적이고 안전한 시술이 가능해질 것으로 예상된다.
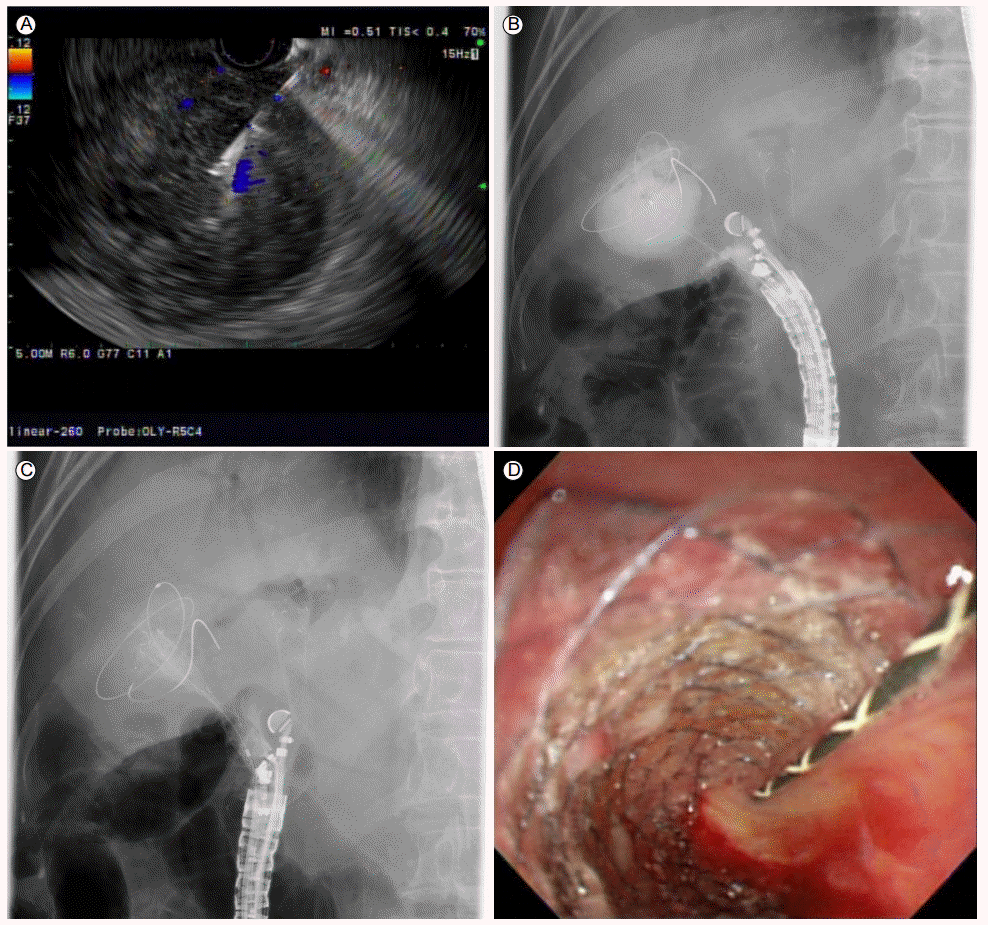
EUS-guided gallbladder drainage to treat gangrenous cholecystitis due to pancreatic cancer. (A) The gallbladder was evidently distended; 19-gauge needle puncture was performed. (B) A guidewire was inserted into the gallbladder. (C) A metal stent was placed, commencing in the duodenum. (D) An endoscopic view of the metal stent. EUS, endoscopic ultrasound.
초음파내시경 유도하 복강 신경총 파괴술(EUS-guided celiac plexus neurolysis, EUS-CPN)
췌장암이나 만성 췌장염의 통증은 복강 신경총(celiac plexus)으로 전달되어 척수(spinal cord)를 경유하여 최종적으로 대뇌 피질에 전달된다. 따라서 복강 신경총을 마비시키거나 파괴시키면 난치성 췌장 통증을 치료할 수 있다. 내시경초음파 유도하 복강 신경총 차단술(EUS-guided celiac plexus block, EUS-CPB)은 주로 만성 췌장염과 같은 양성 질환에서, 복강 신경총 파괴술(EUS-guided celiac plexus neurolysis, EUS-CPN)은 주로 말기 췌장암과 같은 악성 질환의 난치성 통증 조절에 사용된다. 구체적인 시술 방법은 다음과 같다. 먼저 내시경초음파로 위 상부 후벽에서 복강 신경총에 접근한다. 복강 동맥을 확인한 후 주변의 복강 신경절(celiac ganglion)을 확인하는데 정확한 구조물로 보이지 않을 수 있으나 복강 동맥의 위치를 참고하여 상대적으로 위치를 파악할 수 있다. 우측 복강 신경절은 복강 동맥 기시부 하방으로 약 6 mm 떨어져 있고, 좌측 복강 신경절은 복강 동맥 기시부 하방으로 약 9 mm 떨어져 있다. 우측 복강 신경절을 목표로 할 경우, 복강 동맥을 내시경초음파 상의 중심부위에 위치시키고, 대동맥을 계속 보면서 복강 동맥이 사라질 때까지 우측으로 미세하게 회전시킨다. 이후 복강 동맥의 대동맥 전방 측부를 목표로 하여 22 gauge needle로 천자한 후 bupivacaine과 ethanol을 주입한다. 일반적으로 한쪽에만 시술을 시행하나, 같은 방법을 대동맥의 좌측 부위에 적용하여 양쪽에 약물을 주입할 수 있다. EUS-CPB를 시행하는 경우에는 동일한 방법으로 시술을 진행하고 ethanol 대신에 steroid (triamcinolone)를 사용하는 것이 차이점이다[4,23].
최근의 메타 분석에서는 말기 췌장암 환자에서 EUS-CPN이 85%에서 효과적인 통증 감소 효과를 보였고, 한 쪽보다 양 쪽에서 시술을 시행한 경우보다 효과적이었다고 보고하였다[24]. 시술 후 일시적인 통증 악화, 저혈압, 설사 등의 부작용이 보고되었다. 과거 많이 사용되었던 경피적 후부 접근법(percutaneous posterior approach)은 바늘이 척추를 통과해야 하는 위험성이 있었으나, EUS-CPN은 안전하게 복강 신경총에 직접 접근하여 시술이 가능한 장점이 있다.
내시경초음파 유도하 췌장 낭성 종양 치료술(EUS-guided pancreatic cyst ablation)
내시경초음파의 발달과 선형 EUS를 이용한 세침흡인술의 사용으로 인해 췌장 낭성 종양에 대한 다양한 지식들이 축적되고 있다. 원칙적으로 수술적 절제가 추천되는 점액성 낭선종(mucinous cystadenoma)에서 수술이 불가능하거나 환자가 수술을 거부하는 경우 내시경초음파를 이용한 치료를 고려할 수 있다.
위 혹은 십이지장 구부에서 췌장의 점액성 낭선종을 관찰한 후 낭종 내부로 22 gauge needle을 삽입하고 낭종 내부의 액체를 흡인한다. 이후 바로 ethanol을 주입시키고 3-5분 정도 저류시킨 후 에탄올을 모두 흡인한다. 시술자에 따라 paclitaxcel을 추가로 주입하기도 한다[4]. 이와 같이 치료했을 때 70% 이상의 우수한 관해율을 보였다[25]. 아직까지는 장기적인 자료가 부족하고 치료 후 완전히 관해가 되었는지 최종 조직 확인이 불가능하다는 단점이 있으나, 내시경초음파를 이용한 국소 치료 방법이 일부 환자들에게는 췌장의 절제수술을 대처할 수 있을 것으로 생각된다. 이와 유사한 방법으로 췌장의 신경내분비종양에서도 크기가 작고 분화도가 좋은 일부에서 우수한 치료 효과가 보고되었다[26]. 아직은 연구 결과가 많지 않지만 향후 최소 침습적 치료로서 발전 가능성이 높을 것으로 생각된다.
내시경초음파 유도하 고주파열치료(EUS-guided radiofrequency ablation, EUS-RFA)
수술이 불가능한 종양에서 내시경초음파를 이용한 국소 치료가 일부 환자군에서 시도되고 있다. 간암의 국소적 치료 방법으로 고주파열치료(radiofrequency ablation, RFA)가 많이 사용되고 있으며 경피적 복부 초음파 유도하에서 사용되고 있다. 내시경초음파를 이용하여 고주파열치료(EUS-RFA)를 시행하면 경피적으로는 접근이 어려운 췌장의 병변에도 적용이 가능하다. 하지만 아직까지는 이에 대한 연구가 많지 않으며, 소수의 췌장 낭성 종양 및 췌장 내분비종양 환자들에서 EUS-RFA가 안전하게 시행되었다는 보고가 있다[27]. 또한 수술이 불가능한 진행성 췌장암에서 안전하고 효과적으로 EUS-RFA를 시행할 수 있음을 보여준 연구가 최근 보고되었고[28], 이는 후속 연구를 통해 많은 발전 가능성이 있는 분야로 생각된다.
결 론
비침습적 치료가 강조되는 최근 추세로 인해 내시경초음파를 이용한 중재시술의 필요성은 더욱 증가될 것으로 생각되며, 향후 다양한 중재적 내시경초음파 시술에 대한 경험의 축적과 내시경초음파 관련 기구들의 발달로 인해 더욱 발전할 것으로 예상된다. 내시경초음파 유도하 중재시술은 여러 분야의 연구에서 좋은 성적을 보여주고 있으나, 장기적인 추적관찰 자료가 아직 부족한 면이 있다. 향후 보다 많은 연구를 통해 내시경초음파 유도하 중재시술의 표준화된 방법이 정립되고 안전성이 확보된다면, 기존 시술들의 문제점을 극복할 수 있는 좋은 대안치료가 될 수 있을 것으로 생각된다.