궤양성 대장염으로 Infliximab 치료 중인 환자에서 발생한 Mycobacterium gordonae 폐질환 1예
A Case of Mycobacterium gordonae Pulmonary Disease in a Patient with Ulcerative Colitis Treated with Infliximab
Article information
Abstract
TNF-α는 항산균에 대한 인체의 면역학적 방어기전에서 중요한 역할을 한다.Mycobacterium gordonae는 독성이 낮아 임상 검체에서 검출되면 대부분 오염균으로 간주되고 있다. 저자들은 TNF-α 길항제로 치료 중인 궤양성 대장염 환자에서 M. gordonae 폐질환으로 진단되어 적절한 약물 치료 후 호전된 증례를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Tumor necrosis factor-α (TNF-α) is a key component of the host defense against mycobacterial infection.Mycobacterium gordonae (M. gordonae) is one of the least virulent mycobacteria, and is generally considered non-pathogenic if detected from a clinical specimen. Here, we report a rare case of pulmonary M. gordonae infection in a patient with ulcerative colitis who had been treated with infliximab, a TNF-α antagonist. M. gordonae infection was treated successfully with clarithromycin, rifampin, and ethambutol. We believe this to be the first report of M. gordonae pulmonary disease associated with TNF-α antagonist treatment.
서 론
종양괴사인자-알파(tumor necrosis factor-alpha, TNF-α) 길항제들은 류마티스 관절염, 건선, 염증성 장질환과 같은 다양한 염증성 질환의 치료제로 이용되고 있다[1]. TNF-α는 결핵균뿐만 아니라 비결핵항산균(nontuberculous mycobacteria)에 대한 인체의 면역학적 방어기전에서 중요한 역할을 하므로 TNF-α 길항제 치료를 받고 있는 환자에서 비결핵항산균 폐질환이 발생할 위험성이 증가한다[2,3]Mycobacterium gordonae (M. gordonae)는 독성이 낮아 객담에서 검출되면 비결핵항산균 폐질환의 가능성이 낮고 대표적인 오염균으로 간주되고 있다[4]. 저자들은 TNF-α 길항제로 치료 중인 궤양성 대장염 환자에서 M. gordonae 폐질환으로 진단되어 적절한 약물 치료 후 호전된 증례를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 39세 여자
주 소: 흉부 영상 소견 이상
현병력: 환자는 5년 전 궤양성 대장염으로 진단받고 mesalamine, azathioprine, prednisolone 등을 투여하면서 추적관찰 중 궤양성 대장염이 악화되어 8개월 전부터 TNF-α 길항제인 infliximab (remicade) 치료(5 mg/kg)를 시작하였다. Infliximab 치료 시작 당시 흉부 X-선 소견은 정상이었고(Fig. 1A), 인터페론감마 분비검사(interferon-gamma releasing assay, Quanti-FERON-TB Gold)는 음성이었다. Infliximab 투여 후 대장 염증이 호전되어 정기적으로 infliximab 투여 받으면서 경과관찰 중(8개월에 걸쳐 6차 infliximab 투여 후) 시행한 흉부 X-선 검사에서 좌하엽에 경화성 병변(consolidation)이 관찰되어(Fig. 1B) 원인 검사를 위해 입원하였다. 입원 당시 발열, 기침, 객담과 같은 호흡기 증상은 없었다.
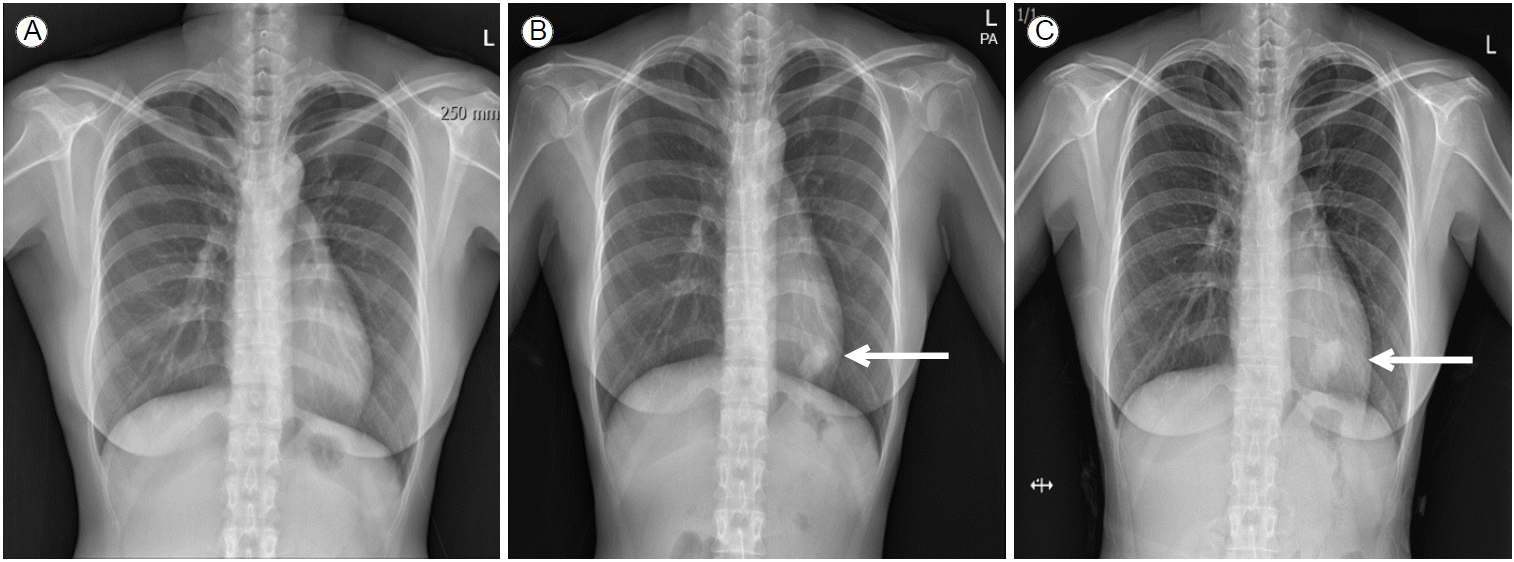
Chest X-ray at the start of infliximab treatment (A), and after 8 months (B) and 10 months (C) of treatment. Panel A shows normal radiologic findings, whereas panels B and C show consolidation in the left lower lung (arrow). Anti-mycobacterial treatment for Mycobacterium gordonae infection was initiated after 10 months of infliximab treatment.
과거력: 궤양성 대장염 치료 이외에 특이 과거력은 없었다.
사회력: 음주나 흡연은 하지 않았다.
이학적 소견: 내원 시 체중은 48 kg, 키는 155 cm, 신체활력징후는 혈압 114/80 mmHg, 맥박수 96회/분, 호흡수 20회/분, 체온은 36.5℃였다. 흉부 청진상 심음은 정상이었으며 천명이나 수포음은 청진되지 않았다. 복부는 편평하고 부드러웠으며, 간이나 비장의 종대는 없었다.
검사실 소견: 입원 당시 말초혈액검사에서 백혈구 5,290/mm3 (호중구 70.9%, 림프구 14.0%), 혈색소 9.4 g/dL, 혈소판 358,000/mm3, 혈청생화학 검사에서 혈청 총 단백 5.2 g/dL, 알부민 2.9 g/dL, AST/ALT 21/10 U/L, 총 빌리루빈 0.26 mg/dL, 혈액요소질소 14.9 mg/dL, Cr 0.43 mg/dL, LDH 251 U/L, C-reactive protein 1.56 mg/dL였다. 소변 검사상 특이 소견은 없었다. 인터페론감마 분비검사를 다시 시행했는데 음성이었다. 객담 항산균 도말 및 배양검사는 음성이었다.
방사선 소견: 흉부 X-선 검사(Fig. 1B) 및 흉부 전산화단층촬영(Fig. 2)에서 좌하엽에 폐경화(consolidation) 소견이 관찰되었다.
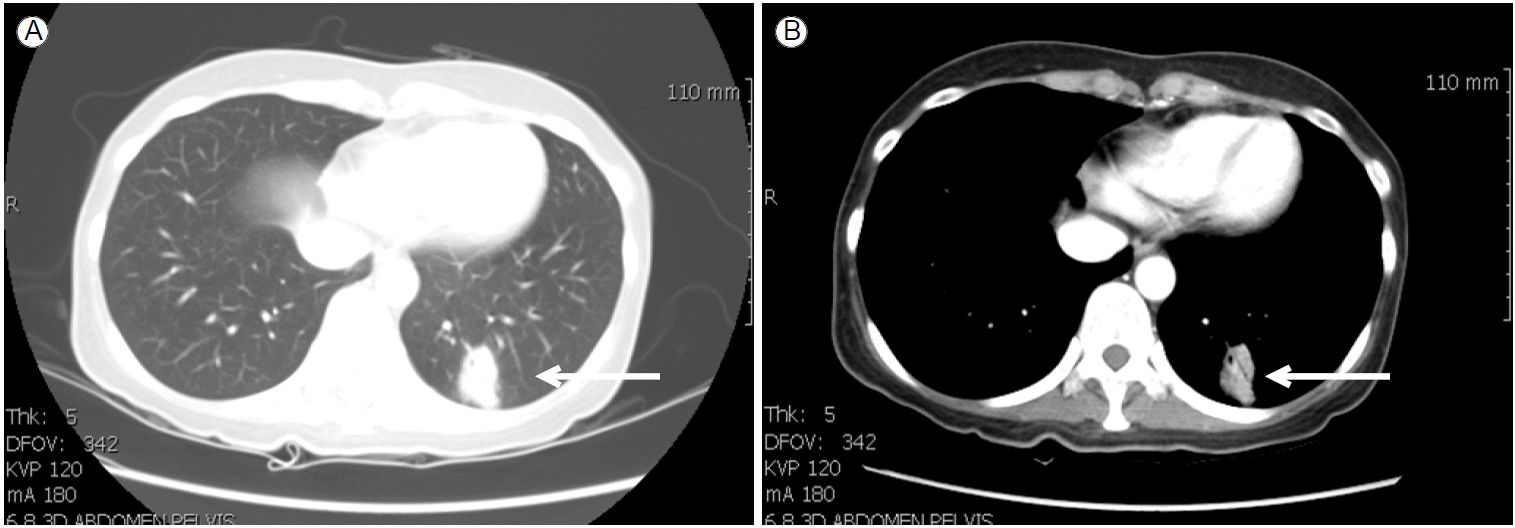
Chest computed tomography (CT) upon admission (after 8 months of infliximab treatment) showed consolidation in the left lower lobe posterior segment along the bronchovascular bundle (arrow) (A). Contrast-enhanced CT revealed a focal low-density region (arrow) (B).
기관지내시경 검사: 기관지 내 병변은 없었고 좌하엽 posterior basal segment에서 기관지폐포세척(bronchoalveolar lavage)을 시행하였다. 기관지폐포세척액 세포진 검사에서 암세포는 관찰되지 않았고, 항산균 도말검사는 음성이었고 결핵균 핵산증폭검사에서 결핵균은 검출되지 않았다.
경피세침흡인검사(percutaneous fine needle aspiration): 좌측 폐 병변에 대해 경피세침흡인을 시행하여 시행한 병리검사에서 괴사성 병변을 동반한 상피양 세포들과 림프구의 집합체가 관찰되었다(Fig. 3). 조직에 대한 항산균 도말검사는 음성이었고, 핵산증폭검사에서 결핵균은 음성이었고 비결핵항산균은 양성이었다.

Fine needle aspiration cytology of the lung lesion showed relatively loose aggregates of epithelioid histiocytes admixed with scattered lymphocytes in a background of necrotic material (arrow) (A, B) (Papanicolaou stain, ×400). Immunohistochemical staining for CD68, a histiocytic marker, showed that cells were mostly composed of histiocytic inflammatory cells (C) (×200).
치료 및 경과: 폐 세포 병리 소견상 비결핵항산균에 의한 폐 병변의 가능성이 크지만 호흡기 증상이 없고 균동정이 되지 않았기 때문에 폐 병변에 대한 치료를 시행하지 않고 항산균 배양 검사 결과를 기다렸다. 이후 기관지폐포세척액에 대한 액체배지와 고체배지에서 비결핵항산균이 배양되었다. 폐 조직에 대한 항산균 배양검사에서는 배양되지 않았다. 기관지폐포세척액에서 배양된 비결핵항산균에 대해 균동정검사를 시행하였는데 M. gordonae가 동정되었다. 결핵연구원에 의뢰하여 동정된 M. gordonae의 약제 감수성 검사를 시행하였다(Table 1). 폐병변이 처음 관찰된 지 2개월 후에 시행한 흉부 X-선에서 좌하엽 경화성 병변이 지속적으로 관찰되어(Fig. 1C) M. gordonae 폐질환으로 진단하고 약제감수성 검사에서 감수성을 보인 clarithromycin, rifampin, ethambutol로 치료를 시작하였다. 치료 시작 후 병변이 지속적으로 감소하였고(Fig. 4) 치료 시작 1개월과 3개월 후에 2차례 추구 객담 항산균 도말 및 배양검사를 시행하였는데 모두 음성이었다. 1년간 약물치료 후 M. gordonae 폐질환 치료를 종결하였다. 치료 종결 6개월에 시행한 흉부 X-선 소견에서 재발의 증거가 없었으며 infliximab 5 mg/kg로 6주 간격으로 투약하면서 증상 및 내시경적 관해를 유지하고 있다.
고 찰
궤양성 대장염은 호전과 악화를 반복하는 만성 염증성 장질환으로 그 원인은 정확히 알려져 있지 않다. TNF-α가 장관염증의 중요한 매개체이며 TNF-α 길항제들이 스테로이드나 면역억제제에 비해 우수한 증상 호전과 점막 치유 효과를 보이는 것이 밝혀짐에 따라 스테로이드나 azathioprine과 같은 면역억제제 사용으로 관해나 호전을 보이지 않는 중등도 이상의 궤양성 대장염 환자에서 TNF-α 길항제들의 사용이 증가하고 있다[5].
TNF-α는 육아종의 형성 등 결핵균에 대한 인체의 면역학적 방어기전에서 중요한 역할을 하는데 TNF-α 길항제가 이 과정을 억제하므로 결핵균에 감염된 사람에서 TNF-α 길항제 치료를 받을 경우 결핵이 발생할 위험성이 증가한다[2]. 그러므로 TNF-α 길항제 사용 전에 활동성 결핵 여부를 확인하고 결핵이 없을 경우 결핵감염 검사를 시행하고 잠복결핵감염으로 진단되면 잠복결핵감염치료를 시행하도록 권고하고 있다[5]. 본 증례의 환자도 TNF-α 길항제를 사용하기 전에 흉부 X-선 검사와 인터페론감마 분비검사를 시행하여 폐결핵이 없고 잠복결핵감염 상태가 아님을 확인하였다.
TNF-α 길항제는 결핵균뿐만 아니라 비결핵항산균에 대한 방어기전도 억제하므로 TNF-α 길항제 치료를 받는 환자에서 비결핵항산균 폐질환이 발생 또한 증가하는 것으로 알려져 있다[6].
비결핵항산균은 균종에 따라 독성(virulence)이 다른데, mycobacterium avium complex (MAC), M. kansasii, M. abscessus 등은 상대적으로 독성이 높아 객담에서 검출되면 비결핵항산균 폐질환의 가능성이 크지만, M. gordonae는 독성이 낮아 폐 병변을 일으키는 경우가 거의 없으며 객담에서 M. gordonae가 검출되면 대표적인 오염균으로 간주되어 왔다[4,7]. 그러나 기관지폐포세척액 또는 폐 조직 생검에서 M. gordonae가 검출되거나 객담의 경우 M. gordonae가 반복해서 검출되고 폐 병변을 일으킬 수 있는 다른 원인이 없을 때 M. gordonae 폐질환(true infection)을 의심해 볼 수 있으며[7], 사람면역결핍바이러스(human immunodeficiency virus) 감염, 스테로이드 치료, 장기이식환자와 같은 면역억제 환자들뿐만 아니라 정상 면역인에서도 M. gordonae가 병을 일으킬 수 있다는 보고들이 있다[8,9].
TNF-α 길항제로 치료 중인 환자들에서 발생한 비결핵항산균 폐질환의 원인균을 분석한 국내외의 연구들에서도 대부분 MAC이 원인균이었으며 M. gordonae가 원인균인 경우는 없었다[3,10]. 그러나 본 증례는 TNF-α 길항제를 사용 중인 환자에서도 M. gordonae가 폐질환을 일으킬 수 있음을 보여주고 있다.
M. gordonae 폐질환의 흉부 방사선 소견은 폐결절, 공동, 폐침윤(infiltration), 기관지확장, 폐경화(consolidation) 등 다양한 소견을 보일 수 있다고 알려져 있으며[9], 본 증례에서는 폐경화 소견을 보였다(Fig. 2).
M. gordonae 감염의 치료 약제와 치료 기간은 아직 정립되지 않는데 시험관에서 항균력이 있는 clarithromycin, rifampin, ethambutol, fluoroquinolone 등이 경험적으로 사용되고 있다[7]. 본 증례에서도 배양된 M. gordonae에 대한 약제 감수성 검사에서 감수성을 보이는 clarithromycin, rifampin, ethambutol로 치료하였고 치료에 좋은 반응을 보였다. 치료 기간 또한 문헌마다 9개월에서 22개월까지 다양한데 본 증례에서는 12개월간 약물 치료로 적절히 치료되었다[8].
본 증례는 TNF-α 길항제를 사용 중인 환자에서 발생한 M. gordonae 폐질환으로 적절한 약물치료로 완치된 첫 번째 증례 보고이다. 그러므로 임상 검체에서 M. gordonae가 검출되더라도 오염균으로 보고 감별진단에서 배제하지 말고 M. gordonae 감염병의 가능성을 고려하여야 할 것으로 사료된다.