흉부 대동맥확장증의 비중재치료 및 정기적인 검사
Periodic Surveillance and Medical Management of Thoracic Aortic Aneurysm
Article information
Trans Abstract
Thoracic aortic enlargement is a silent, but deadly, disease that is often diagnosed on imaging studies performed for unrelated indications and result in life threatening event such as aortic rupture and dissection. The etiologies underlying thoracic aortic enlargement are diverse and can range from degenerative or hypertensive aortic enlargement to more rare genetic disorders including Marfan syndrome and Loeys-Dietz syndrome. Therefore, the diagnosis and management of this disease can be complex. This review focuses on the periodic surveillance using imaging modality before surgical intervention and medical management of asymptomatic patients with thoracic aortic aneurysm.
서 론
흉부 대동맥확장증의 95%는 증상이 없기 때문에 대동맥 박리나 파열이 발생할 때까지 모르고 지내는 경우가 대부분이다[1]. 따라서 통증을 동반한 응급 상황을 제외하면 건강검진이나 다른 질환에 대한 검사를 위하여 시행한 영상 검사에서 우연히 발견된다. 이처럼 진단된 흉부 대동맥확장증은 진단 당시의 크기를 기준으로 수술이나 중재적 시술을 진행하거나, 크기가 기준보다 작을 경우 약물치료와 정기적인 영상 검사를 시행하면서 경과관찰을 하게 된다. 이번 장에서는 흉부대동맥류의 크기가 증가하는 것을 억제할 수 있는 비중재적 치료에 대해서 알아보고 정기적인 검사를 어떻게 진행할지에 대하여 논의하고자 한다.
본 론
흉부 대동맥확장증의 크기 증가 속도와 중재적 치료의 기준
흉부 대동맥확장증은 일반적으로 매년 크기가 증가하며, 평균적으로 상행대동맥은 연간 1 mm 정도, 하행대동맥은 연간 3 mm 정도 커진다[2]. 하지만 대동맥류의 크기가 클수록 커지는 속도는 더 빠르며, 박리가 동반되었을 경우에도 빠른 속도로 커진다. 한편, 대동맥확장증의 원인 중에서 유전적 질환으로 분류되는 이첨판 대동맥 판막을 동반한 대동맥확장증, 가족형 흉부대동맥류, 말판 증후군, Loeys-Dietz 증후군, Ehlers-Danlos 증후군은 일반적인 대동맥류와 비교하여 2-5배까지 매우 빠르게 커진다[3,4]. 또한 대동맥류의 크기가 커질수록 대동맥 박리나 파열이 발생할 가능성이 커지는데 상행대동맥류는 6 cm를 전후하여 합병증 발생률이 급격하게 증가하고, 하행대동맥은 7 cm를 전후하여 급격하게 증가한다[2]. 이처럼 수술이나 중재술을 진행하는 크기의 기준은 확장의 원인과 부위에 따라서 다르다. 따라서 말판 증후군을 비롯한 유전적인 원인의 확장증은 상행대동맥류 5 cm, 하행 대동맥류 6 cm를 기준으로 수술이나 중재 시술을 진행해야 하며, 대동맥류의 진행속도가 빠른 Loeys-Dietz 증후군에 의한 확장증은 대동맥류의 위치에 관계없이 4.5 cm 이상이면 중재적 치료를 시행하도록 권고한다[5]. 혈관벽이 매우 약한 Ehlers-Danlos 증후군에 대한 예방적 수술의 효과에 대해서는 확실한 근거가 없는 상태로 응급상황에서만 수술을 진행한다. 비유전적인 원인의 일반적인 확장증은 상행대동맥류 5.5 cm, 하행 대동맥류 6.5 cm 이상이면 수술이나 중재시술을 진행해야 된다[5]. 또한 크기에 관계 없이 연간 0.5 cm 이상 크기가 증가하는 경우나 증상이 나타난 경우는 수술이나 중재시술을 하도록 권유한다[5].
대동맥류 박리나 파열의 예측
대동맥류의 크기 자체가 가장 잘 알려진 파열의 예측인자이다. 최근 대동맥류의 크기 외에 대동맥 박리나 파열에 영향을 미칠 수 있는 물리역학적인 특성과 생체지표에 대한 연구가 활발하게 진행되고 있다. 한 전임상 연구에 의하면 대동맥의 확장이 6 cm에 이르렀을 때 혈관이 탄성을 잃어 수축기에 더 이상 늘어나지 않는 단단한 원통이 된다고 보고하였다[6]. 이는 흥미롭게도 임상연구에서 합병증이 급격하게 증가하는 6 cm 기준과 일치한다. 따라서 혈관 자기공명영상장치(magnetic resonance imaging, MRI)를 이용하여 탄성도(distensibility)와 벽 응력(wall stress)과 같은 역학적인 지표를 산출할 수 있다면 박리나 파열을 예측하는 인자로 유용하게 사용될 수 있을 것이다[7]. 한편, 몇몇 연구에서 염증반응과 matrix metalloprotease (MMP) 활동의 증가 또는 콜라겐 섬유의 감소 등에 의한 대동맥류 벽의 불안정성 등이 물질대사의 증가와 연관성이 높음을 보고하였으며, 이를 양전자 방사 단층촬영(positron emission tomography/computed tomography [CT])으로 측정하여 대동맥류 환자의 합병증을 예측하고자 하는 연구가 진행 중이다[8]. 영상을 이용한 방법 외에 C-reactive protein를 비롯한 염증지표, cardiac troponin과 같은 세포손상의 지표, MMPs와 같은 세포외 기질 재형성에 관여하는 지표 등이 대동맥류의 합병증을 예측할 수 있는 생체지표로 사용 가능한지에 대한 연구가 진행 중이며, 대동맥류의 발생과 진행에 연관이 있는 microRNA와 DNA 단일염기 다형성을 찾고자 하는 기초 연구가 진행 중이다[9].
정기적인 영상 검사
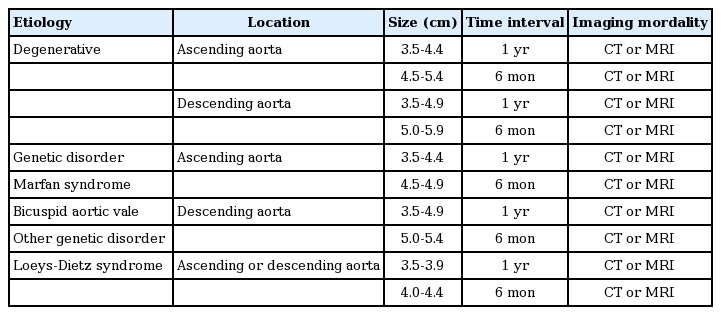
비유전적인 원인으로 발병한 상행대동맥류의 크기가 5.5 cm 미만인 경우는 크게 두 부류로 나누어 정기검사를 시행하도록 권고된다. 3.5-4.4 cm는 1년에 한 번 CT 또는 MRI를 시행하고, 4.5-5.4 cm는 6개월에 한 번 CT 또는 MRI를 시행하여 5.5 cm 이상이 되면 수술이나 중재적 치료를 한다. 말판 증후군과 같은 유전적인 원인에 의한 상행대동맥류는 3.5-4.4 cm는 1년에 한 번 CT 또는 MRI를 시행하고, 4.5-4.9 cm는 6개월에 한 번 CT 또는 MRI를 시행하여 5.0 cm 이상이 되면 수술이나 중재적 치료를 한다[5,10]. 하행대동맥류에 대해서는 상행대동맥류 기준에 0.5 cm를 더하여 검사 및 치료를 진행한다. 대동맥류의 진행속도가 빠른 Loeys-Dietz 증후군에 의한 확장증은 4.5 cm 이상에서 중재적 치료를 시행하므로 4.0 cm 미만은 1년에 한 번, 4.0 cm 이상은 6개월에 한 번 영상 검사를 시행하도록 한다(Table 1). 심장초음파 검사는 비침습적이고 안전한 검사지만 aortic root에 국한해서만 볼 수 있기 때문에 일반적인 흉부대동맥 확장증 환자에게 정기적인 검사 방법으로 권고되지는 않는다. 하지만 말판 증후군을 비롯한 유전적 원인의 흉부대동맥류는 진단 당시와 6개월 이후에 각각 심장초음파 검사를 시행하여 상행대동맥의 크기가 증가하는지 관찰하도록 권고되고 있다[5]. 또한 이첨판 판막을 동반한 확장증 환자에서도 CT 또는 MRI 검사와 같이 시행한다면 도움이 될 수 있는 검사 방법이다.
비중재 치료
흉부 대동맥류가 진단된 환자의 대부분은 동맥경화에 의한 다른 질환이 동반될 가능성이 높고 수술적 치료를 받아야 하기 때문에 다른 합병증이 생기지 않도록 예방적인 치료가 필요하다. 따라서 적극적으로 고혈압, 당뇨, 고지혈증에 대한 진단 및 치료가 이루어져야 하며, 흡연자는 금연을 교육하여야 한다.
흉부 대동맥류의 확장을 막기 위하여 사용되는 약제로 베타 차단제가 우선적으로 권고되며, 특히 말판 증후군 환자에게는 Class 1B 권고사항이다[5]. Losartan을 포함한 안지오텐신 수용기 차단제(angiotensin receptor blocker)를 사용할 수도 있다. 이러한 권고안을 만든 근거에 대해서 기술하고자 한다. 1994년 Shores 등[11]이 최초로 베타차단제인 propranolol 투여한 군이 대조군에 비하여 대동맥류의 확장을 감소시켰다고 보고하였다. 비록 말판 환자만을 대상으로 하였고 환자수가 70명으로 작았지만 의미 있는 연구 결과이었다. 이후 두 번째 연구가 1995년 보고되었으며, 말판 환자 417명을 대상으로 하였다. 당시 사용되는 많은 종류의 베타차단제가 사용되었으며 대조군에 비하여 의미 있게 사망률을 감소시켰다[12]. 이 두 연구를 기반으로 말판환자에서의 베타차단제의 효과는 입증되었으며, 이를 근거로 일반적인 흉부 대동맥확장증에도 효과가 있을 것이라고 추론할 수 있지만 학문적 근거는 미미하다. 2008년 Brooke 등[13]은 안지오텐신 수용기 차단제가 말판 환자의 흉부 대동맥확장증의 진행을 늦춘다고 보고하였다. 일반적인 약물치료를 받았던 18명의 소아 말판 환자를 대상으로 안지오텐신 수용기 차단제 치료를 받기 전과 후의 확장속도를 비교한 결과 안지오텐신 수용기 차단제 사용 전에 연간 3.54 mm씩 크기가 증가하였으나 사용한 이후는 연간 0.46 mm만 증가함을 관찰하였다. 이 연구 결과를 근거로 말판환자에게 안지오텐신 수용기 차단제의 사용이 권고되고 있다. 하지만 일반적인 흉부 대동맥확장증에도 효과가 있을지에 대해서는 연구가 필요하다. 한편, 베타차단제와 안지오텐신 수용기 차단제 중 어떤 약제가 더 효과적인지를 알기 위하여 608명의 말판 환자를 대상으로 무작위 연구를 진행한 결과가 2014년 보고되었다[14]. 3년 이상 추적관찰한 결과 대동맥확장의 정도나 합병증의 발생이 두 군 간에 차이가 없었다. 따라서 향후, 말판 증후군뿐만 아니라 다른 원인의 대동맥 확장증 환자에서 어떤 약제가 더 효과적인지 알아보는 대규모 무작위 대조군 연구가 필요할 것이다. 비특이적 MMP 차단제인 doxycycline은 말판 증후군의 동물모델에서 동맥류 확장을 감소시켰으며, 복부 대동맥류 환자에서도 대동맥류의 진행을 막는 것으로 보고되었다[15,16]. 하지만 흉부 대동맥확장증의 치료효과에 대한 연구는 매우 제한적이기 때문에 임상에서 사용이 권고되지는 않는다. 한편, 동맥경화에 의해 발생한 흉부 대동맥류 환자에게는 동맥경화에 의한 심장뇌혈관 사건을 감소시키기 위하여 스타틴을 사용하여 저밀도 콜레스테롤을 70 mg/dL 이하로 유지하는 것이 권고되고 있다[5]. 이는 몇몇 관찰연구에서 스타틴을 투여한 흉부 대동맥류 환자의 임상적 예후가 더 좋다고 보고되었기 때문이다[17]. 하지만 흉부 대동맥류 환자에게 스타틴을 투여하였을 때 대동맥류 확장을 막을 수 있는지를 관찰한 무작위 대조군 연구는 현재까지 없기 때문에 동맥경화와 연관되지 않은 유전적인 원인에 의한 대동맥류에 스타틴을 사용하는 것에 대해서는 학문적인 근거가 부족하다.
결 론
흉부 대동맥확장증은 대부분 무증상이지만 일정한 크기 이상인 경우는 파열이나 대동맥 박리의 발생 위험이 급격하게 증가하기 때문에 수술 및 중재적 치료가 필요한 시기가 되기 전까지 정기적으로 영상 검사를 시행해야 된다. 크기와 원인질환에 따라서 영상 검사를 시행해야 되는 시간 간격이 다르므로 이에 대한 숙지가 필요하다. 정기적인 검사를 진행하면서 동시에 대동맥류 환자의 장기적인 예후를 개선하기 위하여 금연과 스타틴 처방 등 동맥경화 질환의 예방방법이 우선해야 되며, 항고혈압제를 사용해야 되는 환자는 베타차단제와 안지오텐신 수용기 차단제를 우선적으로 사용할 것을 권고한다. 말판증후군 환자는 베타차단제와 losartan을 사용하여 대동맥류의 확장을 지연시킬 수 있을 것이다.