헬리코박터 파일로리 감염과 소화기 질환
Helicobacter pylori Infection and Related Gastrointestinal Diseases
Article information
Trans Abstract
Helicobacter pylori is among the most common bacterial pathogens, but it has not yet been conquered. It is related to various gastrointestinal diseases, including chronic gastritis, peptic ulcer, gastric marginal zone B cell lymphoma, and gastric cancer. The association between Helicobacter pylori infection and functional dyspepsia or gastroesophageal reflux disease is not clear. Numerous factors determine disease course and outcome, such as bacterial virulence, genotype, host immunity, and environmental factors. The eradication of Helicobacter pylori in associated gastrointestinal diseases is important for the treatment and prevention of recurrent or severe outcomes, especially in Korea where gastric cancer is prevalent.
서 론
Helicobacter pylori (H. pylori)는 전 세계 인구의 절반 이상이 감염되어 있는 흔한 감염균으로 감염자 중 일부에서(1-15%) 만성 위염과 소화성 궤양, 위 변연부 B세포 림프종(extranodal marginal zone B cell lymphoma of mucosa associated lymphoid tissue [MALT] type) 및 위암 등의 소화기 질환을 일으키는 것으로 알려져 있다[1,2].
H. pylori 유병률은 전 세계적으로 감소 추세를 보이고 있으며 국내의 보고에서도 지속적인 감소 추세를 보이고 있다. 국내 16세 이상 무증상 성인의 혈청 유병률이 1998년 조사에서 66.9%이었던 것에 비해 2005년도 보고에서 59.6%, 2013년도 보고에서 54.4%로 유의한 감소추세를 보였는데, 이는 사회경제적 요인과 위생환경의 개선, 제균 치료의 확대로 인한 것으로 판단된다[3-7]. 하지만 이는 여전히 서구에 비해 높은 수치이며 우리나라가 전 세계적으로 위암 발병률이 가장 높은 국가 중에 하나임을 고려할 때 사회경제적으로 큰 부담이 될 수 있다[8].
H. pylori는 암 발생을 일으키는 것으로 알려진 첫 번째 박테리아로 1994년 국제 암 연구소(International Agency for Research on Cancer)는 H. pylori를 제1종 발암인자(class I carcinogen)로 규정하였다[9]. 또한 2014년에는 최근의 역학 연구들을 바탕으로 H. pylori 제균치료를 위암 발생을 예방하기 위한 전략으로 규정하였다[10]. 하지만 H. pylori 유병률의 감소가 식도 및 위 식도 접합부 부위의 선암, 위 식도 역류질환(gastroesophageal reflux disease, GERD), 소아의 천식 및 알레르기 질환의 발생과 역 상관관계를 보인다는 보고가 있어 H. pylori가 인체에 미치는 영향을 일률적으로 규정하기는 어렵다[11-15].
본고에서는 H. pylori 감염과 연관성이 밝혀진 각 소화기 질환에 대해 현재까지 보고된 근거를 정리하여 제시하고자 한다.
본 론
위염
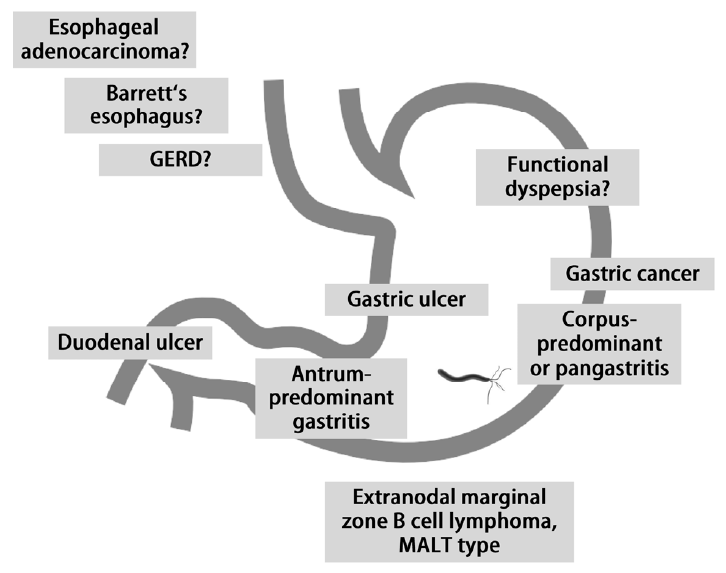
H. pylori는 구강 대 구강, 구강 대 분변 등의 경로를 통해 감염되는 것으로 추측되며 가족 내 감염 비율이 높은 것으로 보고되고 있다[16]. 감염된 H. pylori는 요소분해효소(urease)를 생성하여 위의 요소(urea)성분을 분해하고 주변의 산도를 감소시키며, 편모(flagella)를 이용하여 이동하고, BabA 등의 부착인자(adhesion factor)를 통해 위의 상피세포에 부착한다[17,18]. 부착된 H. pylori는 급성의 비특이적인 소화기 증상을 일으킬 수 있지만 대부분 특정 질환을 일으키지는 않고 10-20% 정도에서만 만성 위장질환을 일으키는데[19], 이는 H. pylori가 분비하는 CagA, VacA 등의 독성인자(virulence factor)와 인체 위 점막의 보전여부, 기타 환경인자들의 복잡한 상호작용에 의해 결정되는 것으로 추측된다[20,21]. H. pylori 감염으로 인해 인체의 면역반응이 활성화되지만, 이는 H. pylori를 제거하지 못하고 위 점막의 손상을 가속화시키는 것으로 알려져 있다[19]. 인체의 위내 환경과 H. pylori의 특징에 따라서 위 체부 위산분비가 많은 사람에게 감염된 H. pylori는 전정부에 주로 서식을 하면서(전정부 위염; antrum-predominant gastritis) 가스트린(gastrin) 분비를 촉진시키고 소마토스타틴(somatostatin) 분비를 저해하여 주로는 십이지장 궤양을 일으킨다[7,21,22]. 역으로 위 체부에 감염된 H. pylori는 위산분비를 저해하고 미만성 위염(pangastritis)이나 체부 위염(corpus-predominant gastritis)을 일으키고, 위궤양과 위암을 발생시키는 것으로 알려져 있다[7,19,21].
소화성 궤양
H. pylori 감염과 non-steroidal anti-inflammatory drugs(NSAID)는 소화성 궤양 발생 원인의 90% 이상을 차지하는 주요한 요인이다[23]. 서구의 문헌에 따르면 H. pylori 감염의 감소에 따라 소화성 궤양의 발생률과 유병률 역시 점차 감소하고 있다[24]. 하지만 소화성 궤양이나 그 합병증으로 인한 입원율에는 변화가 없거나 오히려 증가한 것으로 보고되었는데, 이는 H. pylori 관련 소화성 궤양 이외에 고령에서 아스피린(aspirin)을 포함한 NSAID 사용 증가로 인한 것으로 판단된다[25,26]. 국내의 경우 2-3% 정도의 소화성 궤양 유병률을 보고하고 있으며[27-29], 90년대에 비해서 변화가 없거나 오히려 증가하는 것으로 조사되었다[30,31]. 부위별로는 십이지장 궤양의 경우 유병률에 변화가 없거나 감소한다는 보고가 있었지만, NSAID 등의 약제 관련 위궤양은 유병률이 증가하는 것으로 조사되었다[31,32]. 평균 연령은 위궤양 환자에서 십이지장 궤양 환자보다 높았으며, aspirin을 포함한 NSAID를 더 많이 복용하는 경향을 보였다[7,32].
H. pylori 감염은 보고에 따라 차이가 있지만 십이지장궤양에서 약 73-100%, 위궤양에서는 약 65-100%에서 검출되어 십이지장 궤양에서 위궤양에 비해 다소 높은 감염률을 보고하였다[33-38]. 하지만 국내의 연구에 의하면 90년대에 비해 2000년대에 H. pylori 유병률이 위궤양에서는 66.1%에서 73.1%로 증가하였지만, 십이지장궤양에서는 79.3%에서 68.1%로 감소하였는데, 이는 고령의 환자에서 NSAID의 사용으로 인한 위궤양의 증가를 반영하는 것으로 생각된다[32].
H. pylori 감염이 십이지장 궤양을 일으키는 기전은 십이지장 점막에서 발생한 위 상피화생(gastric metaplasia) 부위에 균 집락을 이루어 점막 손상을 일으키는 것과 위 전정부에 균 집락을 이루어(전정부 위염) 혈중 가스트린을 증가시키고 위산 분비를 항진시켜 십이지장 산도가 증가함에 따라 점막 손상을 일으키는 기전이 제시되고 있다[7,39]. 십이지장에서 H. pylori균이 중탄산염의 분비를 감소시키는 것 또한 궤양 유발에 관련된 것으로 알려져 있다[7,39]. 위궤양의 경우 H. pylori균이 체부와 전정부에 모두 집락을 이루고 있으며, 십이지장 궤양과 달리 위산 분비는 정상이거나 감소되어 있는 것으로 알려져 있고, 위 점막 방어기전의 장애나 유문부 조임근 장애에 의한 십이지장 소화액의 역류 등이 원인으로 제시되고 있으나 정확한 발생기전은 불확실하다[7,39]. 전반적으로 H. pylori 감염 환자 중에서 5-10% 정도만이 소화성 궤양이 발생하는 것으로 알려져 있어 H. pylori 감염 이외에 세균 요인과 숙주 요인, 기타 인자들이 작용할 것으로 추측된다[7,39].
H. pylori와 NSAID는 각각 독립적으로 소화성 궤양을 일으키는 위험요소이다[23]. NSAID에 의한 궤양의 경우 연구에 따라서 H. pylori 제균치료를 통해 소화성 궤양의 발생을 줄일 수 있다는 보고와 줄이지 못한다는 보고가 혼재되어 있어 논란이 있는 실정이지만, 두 가지 요소를 모두 갖고 있는 경우 소화성 궤양 발생의 위험도는 더욱 상승하는 것으로 알려져 있다[40-42]. 현재 국내 가이드라인에 따르면 소화성 궤양의 병력이 있는 환자에서 장기간 저용량 아스피린을 투여하는 경우 소화성 궤양의 재발방지를 위해 H. pylori 제균치료를 권고하지만, 기타 위험요인이 없거나 병력이 없는 경우에는 권고하지 않고 있다[43]. 또한 아스피린을 제외한 NSAID 투약이 필요한 초치료 환자의 경우 약물 투여 전 H. pylori 감염 여부를 진단하고 치료를 시행하도록 권고하고 있지만[44], 장기간 NSAID를 복용하는 환자에서는 H. pylori 제균치료만으로는 소화성 궤양의 발생 위험을 감소시키지 못하는 것으로 알려져 있다[43]. 특히 NSAID에 의해 발생한 위궤양의 경우 H. pylori 감염이 점막의 프로스타글란딘(prostaglandin) 생산을 촉진하고 COX-2 표현을 증가시켜 점막치유에 도움이 된다는 보고에 근거하여, NSAID에 의해 발생한 위궤양에서 동반된 H. pylori 치료는 위궤양 치료(항궤양 치료)를 완료한 후에 시행하도록 권고하고 있다[45].
위암
2014년에 발표된 중앙암등록본부 자료에 의하면 위암은 우리나라에서 갑상선암에 이어 두 번째로 흔히 발생하는 암이며[46], 전 세계적으로도 우리나라는 위암 발병률이 가장 높은 국가 중에 하나이다[8]. H. pylori 감염은 만성 위염과 위축성 위염(atrophic gastritis), 장상피 화생(intestinal metaplasia), 이형성(dysplasia)의 순차적인 과정을 거쳐 장형 위암(intestinal type gastric cancer)을 일으키는 요인으로 알려져 있다[47]. H. pylori는 모든 위암의 71-95%에서 중요한 원인으로 보고되고 있지만, 역으로 모든 H. pylori 감염 환자에서 위암이 발생하는 것은 아니기 때문에(H. pylori 감염환자의 1% 미만에서 위암이 발생) 유전적인 요인과, 식이, 균 자체의 특성 등 다인성 병인으로 인해 암이 발생하는 것으로 추측하고 있다[7]. 실제로 국제 암 연구소는 H. pylori를 제1종 발암인자로 규정하였고[9], H. pylori 제균치료를 위암 발생을 예방하기 위한 전략으로 규정하였지만[10] H. pylori가 위암을 발생시키는 과정은 하나의 기전으로 설명할 수 없으며 추가적인 연구가 필요한 실정이다.
위암예방을 위한 전략으로 H. pylori 제균치료가 위암 발생을 낮출 수 있는지에 대해 연구들이 진행되었는데, 무증상의 건강한 성인에서 제균치료가 위암을 예방할 수 있는지에 대한 최근 메타분석에서 아시아인에 한정하여 제균치료가 위암 발생을 예방할 수 있다는 결론을 내렸지만, 그 근거 수준은 제한적인 실정이다[48]. 제균치료를 통해 위 점막 손상의 진행은 막을 수 있는 것으로 보이지만, 제균치료를 성공해도 H. pylori 이외에 축적된 위암의 위험요소는 제거되지 않기 때문에 추가적인 연구가 필요하다[49].
위축성 위염과 장상피 화생은 위암의 전구단계로 여겨지며, 이들 병변의 발생에 H. pylori 감염이 중요한 요인으로 알려져 있다[50]. H. pylori에 감염된 위축성 위염은 제균치료를 통해 호전을 보이고 장상피 화생으로의 진행을 예방하는 것으로 알려져 있지만[51], 장상피 화생은 제균치료를 성공해도 조직학적 호전을 보이지 않는다는 연구결과가 보고되었다(point of no return) [52]. 하지만 일부 연구에서는 장상피 화생도 제균치료를 통해 조직학적 호전을 보인다는 보고가 있어 추가 연구가 필요하다[53].
자료가 부족하지만 이형성이 이미 진행된 위 선종에서도 H. pylori 제균치료를 통해 일부 선종의 퇴행이나 암으로의 진행이 억제되었다는 보고가 있어 제균치료 대상의 확대가 기대된다[54].
종합적으로 H. pylori는 위암발생의 명확한 위험요소이지만, 위암발생 각 단계에서의 정확한 역할과 제균치료로 각 단계에서 위암발생을 예방할 수 있는지에 대한 근거는 아직 부족하다.
변연부 B세포 림프종
원발성 위 변연부 B세포 림프종은 위에서 발생하는 악성종양의 1-7%를 차지하지만, 전체 위장관 림프종 중에서는 50-60% 정도를 차지하는 가장 흔한 종류로 알려져 있다[7,55]. 위 변연부 B세포 림프종의 98%까지 H. pylori 감염과 연관이 있다고 보고되고 있으며, 주요한 병인으로 알려져 있다[43,56]. 만성 H. pylori 감염의 30% 정도에서 점막 염증반응을 통해 림프여포(lymphoid follicle)를 생성하는데, 이것이 변연부 B세포 림프종의 전구병변으로 추측된다[57]. 임상증상은 비특이적이며 내시경 소견 또한 종괴를 형성하거나 궤양 또는 미란 등 다양하게 보고되고 있기 때문에 조기진단이 어려운 것으로 알려져 있다[58]. Ann Arbor 병기 I, II기의 70-80%에서 H. pylori 제균치료를 통해 관해를 얻는 것으로 알려져 있으며, 나머지 20%의 환자 역시 조직학적 호전을 보이는 것으로 알려져 있다[58]. 치료 이후에 재발은 7.2%에서 발생하며, aggressive lymphoma로의 전환은 0.05%로 극히 드문 것으로 알려져 있다[59]. 점막하층 이상의 침범이 있는 경우 H. pylori 제균치료만으로 완전히 소실되지 않을 수 있는데, 제균치료의 성공 이후 조직학적으로 잔존하는 병변이 존재할 경우 장기 추적관찰 연구의 결과를 바탕으로 watch-and-wait 전략을 시도해 볼 수 있다[60]. 제균치료에 반응이 없거나 진행하는 경우 방사선 치료, 항암화학치료, 면역치료 등을 시행한다[58].
진행된 병기의 경우 항암화학치료를 시행하는데 이때에도 H. pylori 감염이 확인된 경우 H. pylori 감염으로 인한 면역자극을 억제하기 위해 제균치료를 권고한다[55].
일부 소규모 연구들을 근거로 하여 H. pylori 음성인 위 변연부 B세포 림프종 역시 제균치료를 권고하는데, 이는 림프종 세포 증식을 일으키는 H. pylori 이외의 다른 세균을 억제하는 효과와 H. pylori 감염 검사의 위음성 가능성 때문일 것으로 추측하고 있다[55].
기능성 소화불량증(functional dyspepsia)
소화불량은 모든 성인의 25%에서 호소하는 매우 흔한 소화기증상 중 하나로 만성적인 소화불량의 경우 삶의 질을 저하시키는 요인이다[61]. 증상을 호소하는 환자의 60% 정도에서 기능성 소화불량으로 진단이 되는데[61], 11.5-14.7% 정도의 유병률을 보이고 있으며[62], 내시경 검사, 영상의학적 검사 등에서 기질적 질환이 발견되지 않고 식후 불편함(post-prandial discomfort), 포만감(bloating), 명치부위 통증(epigastric pain) 혹은 쓰림(heartburn) 등의 증상이 만성적이고 반복적으로 발생하는 것으로(적어도 6개월 전부터 시작, 지난 3개월 간 증상이 있었던 경우) 로마기준 III의 기준에 따라 진단한다[63].
기능성 소화불량의 병태생리는 정확히 밝혀지지 않았지만 위장관 운동성 변화(altered gastrointestinal motility), 내장과민성(visceral hypersensitivity), 신경조절장애(nervous system dysregulation), 말초 면역 활성화(peripheral immune activation), 염증(inflammation), 감염(infection), 스트레스나 정신적인 요인이 제시되고 있다[64].
기능성 소화불량의 40-70%에서 H. pylori 감염이 있는 것으로 조사되었으며[65], H. pylori 감염으로 인한 위의 만성적인 염증이 기능성 소화불량증 발생의 하나의 기전으로 제시되었다[66]. 만성 감염으로 인해 활성화된 염증 반응 물질들과 호르몬, 위산 분비의 변화로 인해 위장관 운동능력 및 자각능력에 이상을 초래하기 때문에, 일부 전문가들은 H. pylori 감염을 기질적인 원인으로 간주하고 기능성 소화불량증과 구별해야 한다고 주장한다[67,68].
소화불량에 대한 첫 진단 및 치료방법으로 서구에서는 H. pylori 감염여부를 확인하여 치료하는 것(test and treat strategy)이 내시경 검사를 시행하는 것보다 증상 개선 효과는 비슷하면서 비용 효과적이어서 권고되고 있다[69]. 하지만 우리나라의 경우 내시경 검사를 먼저 권고하고 있으며, 제균치료가 기능성 소화불량증 장기 증상 개선에 도움이 된다고 권고하고 있지만 상반된 자료들도 제시되고 있어 권고 등급은 낮은 실정이다[43]. 종합적으로 기능성 소화불량증과 H. pylori의 연관성은 아직 명확하지 않은 상태이며 추가적인 연구가 필요하다.
위식도역류질환(gastroesophageal reflux disease)
위식도역류질환은 가슴쓰림이나 산 역류(acid regurgitation)와 같은 증상이 지속적이고 반복적으로 발생하여 일생생활에 불편을 일으키는 질환이다. 위식도역류질환의 유병률은 지역에 따라 차이가 있는데, 서구의 경우 10-20% 정도의 유병률을 보고하고 있으며, 동아시아 지역의 경우 10% 미만의 유병률을 보고하고 있다[70]. 하지만 동아시아 지역에서도 위식도역류질환의 유병률은 증가하고 있으며, H. pylori 감염의 유병률은 감소하고 있다[3-5,70]. 여러 역학연구들의 결과 H. pylori 감염(특히 CagA 양성 균주)과 위식도역류질환의 역 상관관계를 보고하였다[71,72]. 또한 위식도역류질환 이외에 바렛식도(Barrett’s esophagus)와식도선암(esophageal adenocarcinoma)에서도 H. pylori 감염과 역 상관관계를 보이기 때문에 H. pylori의 상기 질환에 대한 예방효과가 제시되기도 하였다[73]. 이는 H. pylori 감염으로 인한 체부위염이나 미만성 위염에서 위산 분비가 감소하기 때문이며, 역으로 이러한 환자에서 H. pylori 제균치료는 위산분비를 증가시켜 위식도역류질환을 악화시킨다는 보고가 있다[43]. 하지만 다수의 임상연구결과 H. pylori 제균치료가 위식도역류질환의 증상에 의미 있는 영향을 미치지 않는 것으로 조사되어 일치되는 결과를 보이지 않고 있다[74-76]. 이는 H. pylori의 특정 독성인자와 개인별 유전적인 요인 및 위산분비의 차이 때문으로 생각되며, 현재 국내가이드라인과 서구의 가이드라인에서 모두 H. pylori 감염환자에서 제균치료가 위식도역류질환의 발생 및 임상경과에 영향을 미치지 않는다고 명시하고 있다[43,77].
결 론
H. pylori는 가장 흔한 세균성 감염균 중 하나로 다양한 소화기 질환을 일으키지만 여전히 인류가 극복하지 못한 감염균이다. 만성 위염과 소화성 궤양, 위 변연부 B세포 림프종 및 위암 등의 소화기 질환과의 연관성은 명확해 보이지만, 기능성 소화불량, 위식도역류질환, 바렛식도 및 식도 선암과의 관계는 추가적인 연구가 필요하다(Fig. 1). H. pylori 독성인자의 유전적 다양성과 숙주요인, 기타 환경인자들의 다양한 반응에 따라 질병의 발생여부와 임상경과가 결정되는 것으로 추측된다. 우리나라는 위암 발병률이 가장 높은 국가 중에 하나이며 국내 H. pylori 제균치료 성적 역시 감소추세를 보이고 있어, 최선의 제균치료 약제를 개발하고 H. pylori 감염을 예방하는 것이 필요하다.