골수형성이상증후군에 속발한 비전형 소견의 폐포단백증 1예
A Case of Atypical Manifestation of Pulmonary Alveolar Proteinosis Associated with Myelodysplastic Syndrome
Article information
Abstract
폐포단백증은 비전형적 림프절 종대를 포함한 다양한 방사선 소견을 보일 수 있으며 특히 다른 폐질환과 병발하여 발생하는 경우에는 진단에 각별한 주의가 필요하다. 또한 기저 질환에 속발하여 발생하는 이차성 폐포단백증의 경우에는 기저 질환의 치료가 무엇보다도 중요함을 인식하여야 할 것이다.
Trans Abstract
Pulmonary alveolar proteinosis (PAP) is a rare disease characterized by the accumulation of lipoproteinaceous material in the distal air spaces. Secondary forms of PAP are caused by underlying diseases, in particular tumorous conditions, the most common of which are hematologic malignancies, such as chronic myeloid leukemia and myelodysplastic syndrome (MDS). We herein describe a case of atypical manifestation of PAP caused by MDS, which initially mimicked military tuberculosis with severe thrombocytopenia because of radiologic features showing necrotic mediastinal lymphadenopathies and diffuse bronchiolitis. A 46-year-old male visited the hospital complaining of coughing and general weakness and was presumptively diagnosed with military tuberculosis combined with MDS. He was treated with antituberculous medication, but the lung lesions did not improve and dyspnea only progressed. Finally, he underwent lung biopsy and was diagnosed with atypical pattern of PAP associated with MDS. (Korean J Med 2014;86:74-78)
서 론
폐포 단백증은 인지질 단백이 폐포 내에 비정상적으로 축적되어 저산소증을 유발하는 드문 폐 질환이다[1]. 크게 셋으로 분류하여 선천성(Surfactant dysfunction syndrome), 일차성, 이차성으로 나눌 수 있다. 약 90% 이상을 차지하는 일차성 폐포단백증은 GM-CSF (granulocyte macrophage-colony stimulating factor)에 대한 자가 항체로 인하여 대식세포의 기능장애를 유발하고 지질단백이 축적되어 발병한다. 이차성 폐포단백증의 원인은 다양하나 그 중 악성 혈액 질환에 의한 경우가 가장 많다[2].
국내에서 이차성 폐포 단백증으로 보고된 증례는 쇼그렌증후군에 의한 폐포단백증[3] 포함하여 6예 가량이 있고 혈액 질환에 의해 발생한 증례는 급성 적백혈병과 동반된 폐포단백증 1예[4]만이 보고되어 있으며 골수형성이상증후군으로 인한 경우는 보고된 바가 없다.
본 증례는 전신 쇠약감 및 기침, 가래 등으로 내원하여 초기에는 골수형성이상증후군에 동반된 속립성 결핵으로 생각되어 항결핵제 치료를 하였으나 지속적인 호흡 부전과 영상소견의 악화로 추가 폐조직 검사 결과 폐포단백증을 확진받은 경우이다. 초기 흉부 영상 소견이 기존의 폐포단백증과는 다른 비전형적인 양상을 보여 진단이 어려웠던 드문 증례를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 46세, 남자
주 소: 전신 쇠약감 및 기침
현병력: 내원 6개월 전부터 멍이 잘 들고 전신 쇠약감 있으며 내원 3개월 전 기침, 가래 있어 타 병원 내원하였다. 혈액 검사상 혈소판저하 및 빈혈 소견을 보였고 흉부 영상 소견에서 속립성 결핵 의심되어 기관지 내시경 검사를 시행하였다. 항산균(acid fast-bacilli, AFB) 도말 검사 및 결핵 PCR(polymerase chain reaction) 검사는 음성이었고 경기관지 폐조직 검사에서 기질화성 폐렴 이외에 다른 특이사항은 없었으나 방사선 소견 및 임상 증상에서 결핵 가능성이 높아 경험적으로 항결핵제 치료를 시작하였다. 리팜핀 복용 이후 혈소판저하증이 악화되어 약제 중단 후 경과관찰하였으나 호전 보이지 않아 정밀 검사 위해 2011년 9월 본원으로 전원되었다. 골수 검사에서 골수형성이상증후군 확인되었고 International Prognostic Scoring System에서 저위험군에 속하며 속립성 결핵이 동반된 것으로 판단되어 보존적 치료를 하였다. 당시 본원에서 시행한 기관지 내시경 AFB 도말 및 결핵균 PCR 검사도 음성이었다. 일단 리팜핀을 제외한 3제의 1차 표준 결핵 약제에 레보플록사신을 추가 복용하며 퇴원하였다.
2012년 2월 호흡곤란이 점차 심해지고 흉부 CT에서 폐 병변 악화 소견을 보여 추가 검사를 위해 입원하였다. 기관지 내시경을 시행하였고 기관지폐포세척액의 성상은 혈성을 띄었고 폐포자충 PCR 양성 소견이었다. 세균성 폐렴과 폐포자 충성 폐렴에 대한 치료 지속하며 골수형성이상증후군에 의한 이차성 간질성 폐질환 가능성을 고려하여 스테로이드 충격요법 실시 후 증상 다소 호전되어 경구로 약제 변경 후 퇴원하였으나 2012년 3월 호흡곤란 및 폐병변이 악화되어 재입원하였다.
과거력: 기저 질환 없음.
가족력: 특이사항 없음.
음주력: 없음.
흡연력: 하루 2갑씩 25년, 내원 2개월 전 금연
직업력: 엔지니어, 건설현장 노동직(용접, 목공)
문진 소견: 호흡곤란 외에 특이소견 호소하지 않았다.
신체 진찰: 혈압 100/60 mmHg, 맥박 70회/분, 호흡 수 18회/분, 체온 섭씨 36.9도였으며 청진상 특이 소견 보이지 않았다.
검사실 소견: 말초혈액 백혈구 11,300/mm3 (호중구 89%, 림프구 5%, 늦골수세포 2%, 골수세포 2%, 유핵적혈구 9%), 혈색소 8.3 g/dL, 혈소판 20,000/mm3였다. 대기 중 동맥혈 가스 검사 산소 투여 없이 pH 7.471, PaCO2 30.9 mmHg, PaO2 56.2 mmHg, HCO3- 20.9 mEq/L, 산소포화도 87.1%였다. CRP는 3.15 mg/dL (정상치<0.47 mg/dL)였다.
방사선학적 소견: 2011년 9월 본원 내원 시 단순흉부촬영 및 흉부 전산화단층촬영에서 우상엽의 간유리 음영과 함께 양측 폐야의 미만성 중심 소엽 결절 음영(diffuse centrilobular nodular opacities) 및 종격동 림프절 비대 소견을 보였다(Fig. 1). 2012년 1월 재시행한 흉부 CT 소견은 림프절 비대 소견은 다소 호전되었으나 양측 폐야의 간유리 음영 증가하고 사이질 비후가 관찰되었다. 2012년 3월 시행한 흉부 전산화단층촬영상 상기 소견이 더 악화되었다.
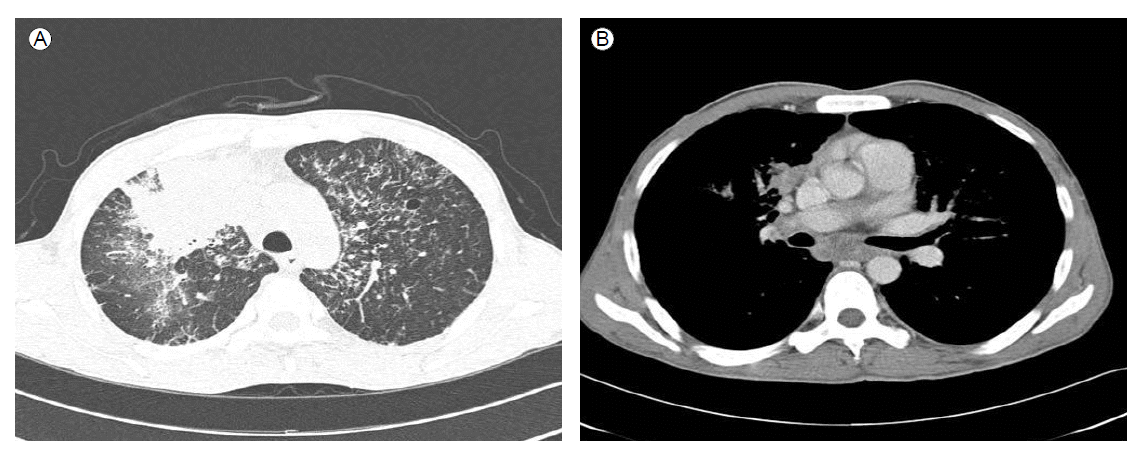
Initial chest CT (2011-09-16) showed (A) huge consolidation and surrounding ground-glass opacity in the right upper lobe, diffuse centrilobular nodular opacities, and bronchial wall thickening in both lungs. (B) Necrotic lymphadenopathies were seen in the mediastinum and in both hila, especially the subcarinal lymph nodes (arrow).
기관지 내시경 소견: 기관지 내 이상 소견은 보이지 않았으나 폐포세척액은 혼탁한 주황색을 보였다(Fig. 2). 우하엽에서 경기관지 생검을 시행하였고 폐포 안에 인지질이 가득차 있는 소견으로 폐포단백증이 확인되었다(Fig. 3).

At microscopic examination of the pathologic specimen, the alveolar space was filled characteristically with amorphous eosinophilic material, consistent with PAP. In addition to this, the interstitium showed lymphocytic infiltration and wall thickening caused by fibrosis. Proliferation of fibroblasts in the alveolar space was noted, representing organizing pneumonia.
치료 및 임상 경과: 흉부 방사선 소견 및 호흡곤란 증상이 악화되어 폐포단백증의 진행에 의한 것으로 생각하여 전폐세척술을 시행하려 하였으나 저산소증이 심하여 전신마취하 체외막산소공급(extra-corporeal membrane oxygenation, ECMO) 적용한 후 전폐 세척술을 시행하였다. 총 18,000 mL 세척술 시행하였으며 시술 후 흉부 방사선 소견(Fig. 4)의 호전 및 산소 요구량의 현저한 감소를 보였다. 2주 후 호흡부전이 악화되어 다시 체외막산소공급 적용한 후 전폐 세척술을 시행하였으나 병발한 폐렴으로 사망하였다.
고 찰
본 증례는 골수형성이상증후군에 동반된 속립성 결핵이 의심되어 결핵 치료를 하던 중 폐병변이 악화되어 추가 검사한 결과 골수형성이상증후군에 동반된 이차성 폐포단백증으로 진단한 경우이다.
이차성 폐포단백증은 독성물질, 악성 종양, 감염 등이 원인이 될 수 있다. 흉부 CT에서 양측의 간유리 음영과 함께 소엽간 중격이 두꺼워져 있고 사이질 침윤이 보이는 고르지 못한 포장 무늬(crazy paving pattern)이 특징적이며 일차성 폐포 단백증의 경우 이차성 폐포 단백증에 비해 비교적 소엽 및 대엽을 따라 경계가 더욱 명확하게 보이는 특징을 보인다고 알려져 있다[2]. 폐조직 검사상 주로 폐포와 폐포공간의 PAS 양성 물질의 축적이 특징이며 폐실질은 비교적 보존되며 종격동 림프절 침범은 드물다고 알려져 있다. 본 증례의 경우 초기에 폐실질 및 세기관지 부위의 염증 및 종격동 림프절 침범이 두드러진 비전형적인 양상을 보여 속립성 폐결핵에 더욱 부합하는 소견으로 생각되었다. 이와 같이 폐실질의 침범 및 종격동 림프절 침범이 관찰된 증례가 Usui 등[5]에 의해 보고된 경우가 있으며 이는 심한 폐포단백증에서 대식세포에 의한 청소율이 저하되어 폐실질 침착이 일어나고 이로 인한 림프액 배액의 장애가 생겨 발생한 것으로 설명하고 있다.
폐포단백증의 증상 호전 및 저산소혈증 개선을 위해서는 전폐 세척술이 일차 치료법으로 알려져 있다. 본 증례의 경우 심한 저산소증으로 인해 전폐 세척술을 시행하기 위하여 체외막산소공급을 사용하여야 하였다. 두 차례 체외막산소공급을 통한 전폐 세척술 시행하였으며 이후 일시적으로 폐포단백증의 호전을 보였다.
최근에는 전폐 세척술 이외에 일차성, 이차성 폐포단백증의 발생 기전에 따라 다른 치료법이 시도되고 있다. 일차성의 경우 GM-SCF 투여가 효과가 있다고 보고되고 있으며[6] 이차성 폐포단백증의 경우 기저질환이 호전될 경우 폐포단백증 또한 호전되는 경우가 보고되어 있다[7]. 골수형성이상증후군과 동반된 폐포단백증의 경우에는 기저 혈액 질환으로 인해 폐포 대식세포의 수와 기능의 장애가 유발될 수 있으며 따라서 항암 치료를 통해 기존의 골수형성이상증후군 클론을 제거한 후 정상 대식세포로 대체함으로써 질병이 호전 될 수 있다. 2009년 Tabata 등[8]이 폐포단백증과 동반된 골수형성이상증후군 환자에서 골수이식 시행 후 폐포단백증 또한 호전된 증례를 보고하기도 하였다. 폐포단백증의 예후는 다양하나[4] 이와 같이 이차성 폐포단백증은 기저질환이 해결되지 않는 경우 재발과 악화를 초래할 수 있음을 시사한다.