Propranolol의 용량에 따른 식도 정맥류 재출혈 예방
Maximally Tolerable Versus Low Doses of Propranolol in the Prevention of Esophageal Variceal Rebleeding
Article information
Abstract
목적
베타차단제는 간경변 환자의 식도 정맥류 재출혈 예방을 위해 널리 이용되어져 왔다. 하지만 베타 차단제를 사용하더라도 문맥압 감소가 충분하지 않으면 식도 정맥류의 재출혈을 유발할 수 있다. 본 연구의 목적은 최대 내약 용량군과 저용량군 사이에 식도 정맥류 재출혈률을 비교하는 것이다.
방법
식도 정맥류 출혈로 응급 내시경적 정맥류 결찰술을 시행 후 베타차단제를 1개월 이상 복용하였던 95명이 등록되었다. 혈역학적 안정이 이루어진 뒤 모든 환자는 propranolol을 투약하였는데 49명은 최대 내약 용량(154.7 ± 10.1 mg/day)을 나머지 46명은 저용량(39.1 ± 5.8 mg/day)을 복용하였다. 식도 정맥류 재출혈 발생을 연구의 종료 시점으로 정하였다.
결과
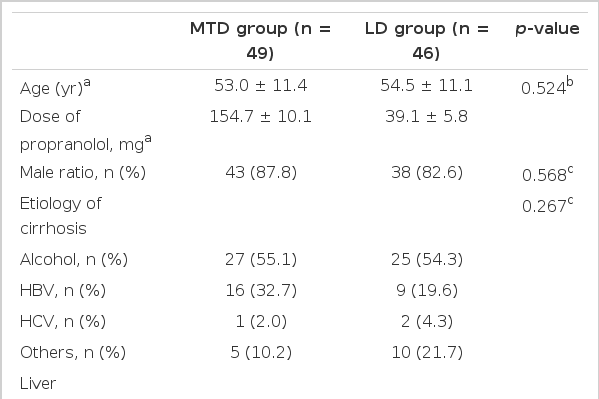
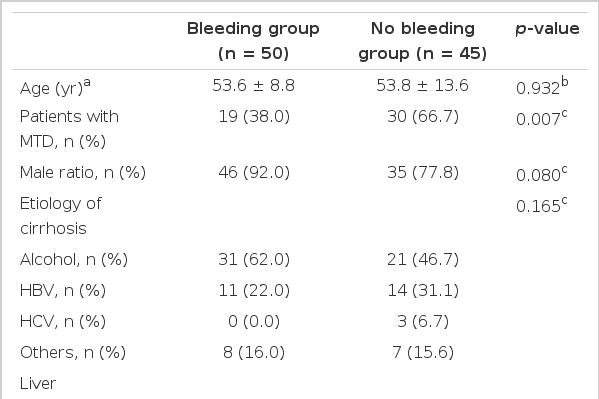
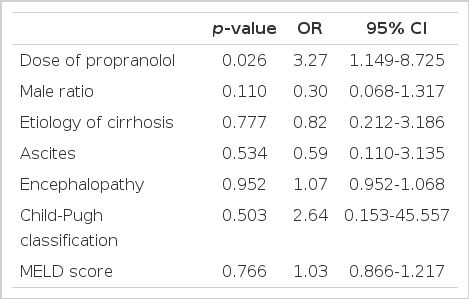
최대 내약 용량군과 저용량군 사이에 기본 특징을 비교했을 때, 나이, 성별비, 간경변의 원인, 복수와 뇌증의 유병률, 혈청 크레아티닌, 추적 기간은 차이가 없었다. 최대 내약 용량군에서 저용량군에 비해 Child-Pugh 등급, MELD 점수, 혈청 빌리루빈이 낮았고 프로트롬빈 시간은 짧았으며 베타차단제의 감량률은 높았다. 최대 내약 용량군에서 식도정맥류 재출혈률은 저용량군에 비해 유의하게 낮았다(38.8% vs. 67.4%, p= 0.007). 식도 정맥류 재출혈에 관여하는 인자로는 Child-Pugh 등급과 propranolol의 용량이 단변량 분석에서 유의한 인자였다. 그러나 다변량 분석에서는 propranolol의 최대 내약 용량만이 식도 정맥류 재출혈을 감소시키는 유의한 인자였다.
결론
식도 정맥류 재출혈 예방을 위한 propranolol의 효과를 용량에 따라 비교해 보았을 때 최대 내약 용량군이 저용량군보다 우수하였다. 본 연구는 식도 정맥류 재출혈을 예방하기 위해 propranolol을 최대 내약 용량으로 투약하는 것이 중요함을 보여주었다.
Trans Abstract
Background/Aims
Beta-blockers have been used extensively to prevent esophageal variceal (EV) rebleeding in patients with livercirrhosis. The aim of this study was to compare the rate of EV rebleeding according to the dose of beta-blocker, between maximallytolerable dose (MTD) and low dose (LD) groups.
Methods
A total of 95 patients, who were treated with emergent EV ligation for acute EV bleeding and have since then takenpropranolol for 1 month or longer, were enrolled. Forty-nine patients took propranolol at the MTD (154.7 ± 10.1 mg/day), and 46patients took propranolol at the LD (39.1 ± 5.8 mg/day). The end point was occurrence of EV rebleeding.
Results
The MTD and LD groups were well matched for age, sex, etiologies for cirrhosis, presence of ascites or encephalopathy,serum creatinine levels, and follow-up periods. The MTD group showed relatively lower Child-Pugh scores, mode for end stageliver disease (MELD) scores, and serum bilirubin, as well as shorter prothrombin time, but a higher dose reduction rate, ascompared with the LD group. The rate of EV rebleeding was lower in the MTD group than the LD group (38.8% vs. 67.4%, p =0.007). In the univariate analysis, the risk factors for EV rebleeding were Child-Pugh classification and dose of propranolol.However, the dose of propranolol was only a significant risk factor for EV rebleeding according to the multivariate analysis.
Conclusions
The effect of propranolol on the prevention of EV rebleeding was superior in the MTD group than in the LD group.(Korean J Med 2014;86:42-48)
서 론
식도 정맥류는 간경변 환자의 흔한 합병증으로[1] 간경변으로 인해 문맥압이 증가되어 발생한다. 정맥류를 가진 환자는 2년 내에 약 25%에서 출혈이 생기며[2] 이러한 정맥류 출혈은 1년 내에 60%에서 재발할 수 있다[3]. 매 정맥류 출혈마다 6주내 사망률은 15-20% 정도로 높아[4] 정맥류 출혈의 예방은 간경변 환자의 사망률 감소와 관련이 있다. 식도 정맥류 출혈의 예방을 위해 가장 많이 사용되는 약물은 propranolol과 같은 비선택적 베타차단제이며[5-8] 이는 문맥압 감소와 관련이 있다. 비선택적 베타차단제는 저용량으로 시작하여 최대 내약 용량(maximally-tolerable dose)까지 증량해야 하지만 많은 환자에서 베타차단제를 복용하지 않거나[9] 최대 내약 용량까지 증량하지 않고 저용량만으로 추적하는 경우가 많다. 본 연구에서는 베타차단제를 저용량과 최대 내약 용량으로 투약했을 때 각각의 식도 정맥류의 재출혈 발생빈도를 비교하고자 하였다.
대상 및 방법
대상
2005년 1월 1일부터 2012년 10월 1일까지 간경변 환자 중식도 정맥류 출혈로 내원하여 내시경 정맥류 결찰술을 시행한 후 베타차단제를 1개월 이상 복용하였던 환자 95명을 대상으로 하였다. 식도 정맥류 출혈이란 토혈 또는 혈변 등 소화관 출혈이 있는 환자로서 내시경 검사에서 식도 정맥류로부터 활동성 출혈이 관찰되거나 식도 정맥류 표면에 혈괴 또는 백태가 붙어있는 경우 또는 출혈의 원인으로서 식도정맥류 외 다른 원인이 발견되지 않으면 식도 정맥류 출혈로 정의하였다[10]. 상부소화관 출혈의 원인이 식도 정맥류가 아닌 경우와 내시경 정맥류 결찰술을 시행하지 않은 경우는 모두 배제하였다.
방법
급성 출혈 후 혈역학적 상태가 안정되고 흑색변을 포함한 다른 출혈의 증거가 지속적으로 관찰되지 않을 때 경구 식이 허용과 함께 베타차단제를 투약하게 되는데, 내시경 정맥류 결찰술 시행 후 평균 3-5일 사이에 propranolol 투약이 이루어졌다. 49명에서는 propranolol을 최대 내약 용량까지 증량시켰고(최대 내약 용량군), 46명에서는 초기에 투약한 저용량의 propranolol을 복용하며 추적하였다(저용량군). 양군 모두에서 식도정맥류 근절을 위해 추적 기간 중 추가적인 식도정맥류 결찰술은 시행하지 않았다. 최대 내약 용량이란 안정 시 환자의 맥박 수가 기저치의 75%까지 또는 55회/분까지 감소할 때 투약하고 있는 베타차단제의 용량을 의미하며[4,7,8], 저용량은 베타차단제의 용량이 40 mg/day 이하인 용량을 의미한다. 베타차단제를 투약한지 1개월 이후에 식도 정맥류 출혈이 재발하는 시점을 연구 종료 시점으로 정하였다. 최대 내약 용량군과 저용량군 사이에 나이, 성별, 간경변의 원인, 복수와 뇌증의 유병률, 간경변의 단계, 혈청 빌리루빈과 크레아티닌, 프로트롬빈 시간, 추적 기간, 베타차단제의 감량률 및 식도 정맥류의 재출혈 빈도를 후향적 연구 방법을 통해 조사하여 비교 분석하였다.
통계 분석
통계 분석 방법으로 연속성 변수의 비교는 독립 t-검증을 이용하였고, 범주형 변수의 비교는 Chi-square test를 이용하였다. 식도 정맥류의 재출혈에 관여하는 인자를 알기 위해 로지스틱 회귀분석을 하였다. 통계처리는 SPSS (version 14.0, Chicago, IL, USA)를 이용하였으며 p 값이 0.05 미만인 경우 통계적으로 유의하다고 판단하였다.
결 과
대상 환자의 특성
최대 내약 용량군과 저용량군 사이에 나이, 성별비, 간경변의 원인, 복수와 뇌증의 유병률, 혈청 크레아티닌, 추적 기간은 차이를 보이지 않았다(Table 1). 최대 내약 용량군의 일 평균 베타차단제 사용량은 154.7 ± 10.1 mg이었고 저용량군의 일평균 베타차단제 사용량은 39.1 ± 5.8 mg이었다. 전체 환자의 평균 나이는 53.7세였고 남성의 비율이 85.3%였다. 간경변의 가장 흔한 원인은 음주였고(54.7%), 그 다음으로 만성 B형 간염이 흔하였다(26.3%). 복수는 전체 환자의 68.4%에서 뇌증은 5.3%에서 동반되었다. 평균 혈청 크레아티닌은 0.8 mg/dL였고 평균 추적 기간은 327.7일이었다. 그러나 Child-Pugh 등급과 MELD (mode for end stage liver disease) 점수, 혈청 빌리루빈, 프로트롬빈 시간, 베타차단제 감량률은 두 군 사이에서 유의한 차이를 보였다(Table 1).
식도 정맥류 재출혈 빈도
식도 정맥류의 재출혈률은 최대 내약 용량군에서는 38.8%인 반면, 저용량군에서는 67.4%로 최대 내약 용량군에서 유의하게 낮았다(p = 0.007).
식도 정맥류 재출혈에 관여하는 인자
단변량 분석을 했을 때 환자의 나이, 성별, 간경변의 원인, 복수, 뇌증, MELD 점수, 혈청 빌리루빈, 혈청 크레아티닌, 프로트롬빈 시간과 추적 기간은 식도 정맥류 재출혈의 위험과 관련이 없었다. 다만 베타체단제의 용량과 Child-Pugh 등 급이 식도 정맥류 재출혈과 유의한 관계를 보였다(Table 2). 로지스틱 회귀분석을 이용한 다변량 분석에서는 베타차단제의 최대 내약 용량 사용 여부만이 식도 정맥류 재출혈의 발생을 감소시키는데 관여하는 유의한 인자로 나타났다(odds ratio [OR], 3.173; 95% confidence interval [CI], 1.339 to 9.843; p = 0.026) (Table 3).
최대 내약 용량 사용에 따른 부작용
최대 내약 용량을 사용한 49명 중 13명(26.5%)에서 감량을 하였으며 감량이 발생한 시기는 사용한 날로부터 평균 113.9 ± 34.7일이었다. 감량의 원인은 저혈압 2명, 서맥 5명, 어지럼증 3명, 백혈구 저하 1명, 기타 2명이었다. 감량이 있었던 환자의 베타차단제 평균 사용량은 83.1 ± 75.7 mg/day였다. 감량이 있었던 군과 최대 내약 용량을 지속적으로 투약한 군 사이에 재출혈 발생은 차이가 없었다.
고 찰
간경변은 문맥 혈류의 저항성을 증가시키고 문맥압 증가를 유발한다[3]. 문맥압 증가는 직접적으로 기존 혈관을 확장시킬 뿐 아니라 nitric oxide와 같은 혈관 확장 요소를 통해 새로운 혈관을 형성하여 정맥류를 유발한다. 이러한 과정에서 확장된 내장 혈관은 문맥 혈류로 이어져 문맥압을 더욱 증가시키게 된다[4]. 문맥압의 측정은 문맥압과 하대정맥압의 차이를 나타내는 간정맥압력차(hepatic venous pressure gradient, HVPG)를 이용한다. 정상적인 HVPG는 5 mmHg이며 HVPG가 10 mmHg를 초과할 때 정맥류가 발생하고[11] 정맥류 출혈은 HVPG가 12 mmHg를 초과할 때 생긴다[12-14]. 그러므로 HVPG를 12 mmHg 이하 또는 기저값의 20% 이상 감소시키면 식도 정맥류 출혈을 예방할 수 있다[15].
비선택적 베타차단제는 문맥압을 줄이기 위해 장기적으로 경구 투약되는 약물로서 그 기전은 베타1 수용체 차단을 통해 심박출을 줄이고 베타2 수용체 차단을 통해 내장 혈관 수축을 함으로써 문맥 혈류를 줄이게 된다[16]. Metoprolol이나 bisoprolol과 같은 선택적 베타차단제는 내장 혈관 수축을 유발하지 않아 문맥 혈류를 감소시키지 못한다[9]. 따라서 propranolol이나 nadolol같은 비선택적 베타차단제가 선택적 베타차단제에 비해 HVPG 감소에 더 효과적이다[17,18]. Carvedilol은 비선택적 베타차단제이면서 알파1 수용체도 차단하여 간의 혈관 긴장도를 감소시킴으로써 propranolol이나 nadolol보다 HVPG 감소 효과가 더 크다[19].
비선택적 베타차단제의 투약 용량은 propranolol의 경우 20 mg씩 1일 2회, nadolol의 경우 40 mg씩 1일 1회로 시작하여 점진적으로 증가시키며[4] 환자가 최대한 견딜 수 있거나 안정 시 맥박수가 기저치의 75%까지 또는 분당 50-60회까지 감소하는 것을 목표로 한다[4,20]. 이와 같이 식도 정맥류 출혈 예방을 위해 투약되는 베타차단제의 적절한 용량에 대해 많은 문헌에서 보고하고 있지만 여러 가지 이유로 적절한 용량이 투약되지 않고 있다. 첫째, 환자의 약물 순응도가 불량한 경우이다. 가족의 지지 기반이 약하고 자기 관리 능력이 부족하기 쉬운 알코올 중독자인 경우 약물 순응도가 부족하기 마련이다. 둘째, 베타차단제의 적절한 용량에 관한 의료진의 지식이나 투약 경험이 부족한 경우이다. 셋째, 베타차단제의 부작용이나 금기증이 존재하는 경우이다. 베타차단제의 흔한 부작용으로는 어지럼증, 피로감, 호흡곤란이 있는데 이들 중 일부는 시간이 경과하거나 감량을 통해 사라지기도 하지만 약 15%에서는 증상이 심하여 투약을 중단하게 된다[4,21]. 본 연구에서는 감량을 시행한 환자 17명 중 2명(11.8%)에서 투약을 중단하게 되었다. 또한 베타차단제를 사용할 수 없는 금기증으로는 서맥, 인슐린 의존성 당뇨, 폐쇄성 폐질환, 심부전, 대동맥 판막 질환, 2도 또는 3도 심블록, 말초 혈관 질환 등이 있고 이들은 환자의 약 15%까지 보고되고 있다[21]. 넷째, 투약 대상이 노인일 때 적극적으로 적절한 용량을 투약하지 못하는 경우이다. 노인 환자에서는 자율 신경계의 변화와 약물의 간 및 신 대사가 느린 점을 고려해야 하며 그 외 타 질환 공존과 약물 부작용에 대한 감수성이 높은 점도 고려해야 한다[22]. 본 연구의 저용량군에는 혈역학적 상태 및 혈액검사 소견이 안정되면서 입원 지속을 원하지 않은 환자, 전신상태가 매우 불량하거나 고령의 환자 등이 포함되었고 이들은 입원 기간 동안 저용량만 투약하고 퇴원하였다.
심부전 치료를 위해 metoprolol 또는 bisoprolol과 같은 선택적 베타차단제를 이미 복용하고 있는 환자에서 정맥류 출혈의 예방이 필요한 경우가 있다. 이런 경우 비선택적 베타차단제로 변경할지에 관해서는 심부전과 문맥압 항진을 비교하여 보다 중한 질병을 따라 베타차단제를 선택하면 된다. 심부전을 제외한 경우(고혈압이나 협심증, 부정맥, 또는 심근 경색)로 인해 선택적 베타차단제를 이미 복용하고 있는 환자에서는 비선택적 베타차단제와 선택적 베타차단제의 효과가 비슷하므로 정맥류 출혈의 예방이 필요한 경우 비선택적 베타차단제로 변경하면 된다[23]. 베타차단제에 혈역학적 반응이 낮은 경우 질산염 제제를 추가하면 HPVG를 현저하게 감소시키고 베타차단제 단독 군에 비해 재출혈률이 낮아진다[24,25]. 하지만 저혈압, 어지럼증, 두통, 염분 저류, 신기능 악화 등의 부작용으로 인해 투약을 중단하는 경우가 있음을 고려해야 한다[3]. 베타차단제의 투약은 평생 지속되어야 하는데[26] 이는 투약 중단 시 출혈 위험과 함께 사망률이 증가하기 때문이다[27].
본 연구가 후향적 연구의 한계를 가지고 있어 저용량군에 비해 최대 내약 용량군에 상대적으로 간기능 및 전신 상태가 양호한 환자가 포함되었다. 이로 인해 재출혈과 관련된 단변량 분석에서 베타차단제 용량뿐만 아니라 Child-Pugh 등급이 유의한 인자로 나타났을 개연성이 있다. 그러나 다변량 분석에서는 오직 베타차단제 용량만이 유일하게 재출혈 발생에 관여하는 인자였다. 최대 내약 용량군의 일평균 베타차단제 사용량은 154.7 ± 10.1 mg이었으며 사용자 49명 중 13명(26.5%)에서 투약 중 부작용이 발생하여 감량을 시행하였고 감량 발생 시기는 사용 후 113.9 ± 34.7일이었다. 감량을 시행했던 최대 내약 용량군 중 1명에서만 투약을 중단하였다. 나머지 환자는 고용량 베타차단제를 사용함에도 별다른 부작용 없이 지속적으로 복용할 수 있었다.
재출혈 또는 초출혈 방지를 위해 최대 내약 용량을 사용하는 것이 원칙이지만 현재에도 습관적으로 하루 40 mg의 저용량을 사용하는 경우는 허다하다. 특히 외래 진료 시에 베타차단제를 최대 내약 용량까지 증량하는 것이 매우 힘든 상황이어서 더욱 그러한 경향이 강한 것으로 생각된다. 본고에서 보듯이 저용량군에 비해 최대 내약 용량군에서 재출혈 발생이 유의하게 감소하였고 대부분의 환자에서 큰 부작용 없이 최대 내약 용량을 잘 유지할 수 있었다. 그러므로 재출혈 방지를 위해 최대 내약 용량을 적극적으로 유지해야 할 것으로 생각된다. 이를 위해 환자의 순응도를 높이고 투약 전 환자의 나이나 건강 상태를 고려해야 하며 투약 후 혈역학적 반응과 부작용에 대한 모니터링을 주의 깊게 해야 할 것이다.