악성 림프종 환자에서 항암화학요법 후 발생하는 B형 간염의 재활성화
Reactivation of Hepatitis B Virus Following Systemic Chemotherapy for Malignant Lymphoma
Article information
Abstract
목적:
악성 림프종 환자에서 항암 치료 후 발생하는 B형 간염의 재활성화는 중요한 합병증 중 하나이다. 이러한 B형 간염의 재활성화는 항암 치료의 연기 혹은 심각한 간부전을 초래함으로써 결국 악성 림프종 환자의 생존율에 악영향을 준다. B형 간염의 재활성화는 항암 치료 전 검사에서 HBsAg 양성인 환자뿐만 아니라 HBsAg 음성인 환자에서도 발생할 수 있다. 실제로 HBsAg이 음성일지라도 과거 B형 간염을 앓았거나 잠재감염 상태인 환자는 anti-HBc 양성 소견을 보인다. 본 연구는 단일 의료센터에서 6년간 항암 치료를 받은 196명의 환자를 후향적으로 분석하여 B형 간염의 재활성화율과 이를 예방하기 위한 방법에 대해 알고자 한다.
방법:
2005년 1월부터 2010년 12월까지 가천대 길병원에서 악성 림프종을 진단받고 항암 치료를 시행받은 196명이 환자들의 검사 결과 및 임상경과 자료를 후향적 분석하였다.
결과:
악성 림프종을 진단받은 총 196명의 환자에 대해 항암 치료 전 HBsAg 검사율은 88% (172/196)였으며 11명이 양성이었다. Anti-HBc 검사율은 13% (26/196)에 그쳤으며 HBsAg 음성이면서 Anti-HBc 양성인 환자는 15명이었다. 재활성화는 HBsAg 양성군에서 27.3% (3/11), HBsAg 음성군에서 6.7% (1/15) 발생하였으며 이들은 entecavir 혹은 lamivudine 복용 후에 모두 후유증 없이 간기능을 회복하였으며 항암 치료를 종료하였다.
결론:
HBsAg 양성인 환자뿐만 아니라 과거감염이나 회복된 감염을 의미하는 Anti-HBc 양성인 환자에서도 재활성화는 발생하였다. 따라서 항암 치료 시작 전에 B형 간염 바이러스에 대한 상태를 평가하고 재활성화를 예방하기 위한 적절한 검사와 선제 치료가 필요하다.
Trans Abstract
Background/Aims:
Reactivation of hepatitis B virus (HBV) has been reported in HBV surface antigen (HBsAg)-positive patientsundergoing chemotherapy, as well as HBsAg-negative patients with antibodies against HBV core antigen (HBcAg) and/or HBsAg(HBsAb). Chemotherapy-including rituximab-has recently been identified as a predictive factor for HBV reactivation in HBsAgnegativepatients with malignant lymphoma. The aim of our study was to identify the factors predictive of HBV reactivation afterchemotherapy in patients with malignant lymphoma.
Methods:
We conducted a retrospective analysis of medical records from patients diagnosed with malignant lymphoma at GachonUniversity Gil Medical Center in City, County from January 2005 to December 2010. We subsequently determined HBsAg,HBsAb and anti-HBc status in the 196 patients treated with chemotherapy.
Results:
The mean age of the patients was 57.3 ± 14.5 years; 56.3% were male. A total of 172 of 196 (88%) patients in the studypopulation were HBsAg (+) prior to chemotherapy. Three patients (3/11, 27.3%) in the HBsAg (+) group had confirmed HBVreactivation after chemotherapy. In addition, 26 of 196 (13%) patients in the study population tested HBcAg (+) positive prior tochemotherapy. One patient (1/15, 6.7%) in the HBsAg (-)/HBcAb (+) group had confirmed HBV reactivation. In the four patientswith HBV reactivation, infection was resolved after treatment with 0.5 mg entecavir or 100 mg lamivudine.
Conclusions:
Reactivation of HBV after systemic chemotherapy can occur in HBsAg (-) patients. We recommend that malignantlymphoma patients undergoing chemotherapy be screened for HBV infection status, including HBcAg, and followed closely toprevent HBV reactivation. (Korean J Med 2013;85:598-603)
서 론
B형 간염바이러스의 재활성화는 항암 치료를 받는 만성 B형 간염 환자에서(B형 간염 표면 항원[HBsAg] 양성) 발생할 수 있는 매우 위협적인 합병증 중에 하나이다. 이러한 B형 간염 바이러스의 증식성, 활동성 상태는 숙주와 B형 간염 바이러스 간의 상호작용에 의해 결정된다[1] [Jang, 2012 #151] [Jang, 2012 #151] [Jang, 2012 #151]. 바이러스가 비증 식성 상태여도 환자의 면역이 약화되는 상황에는 바이러스의 증식성이 다시 회복되어 간염이 발생하게 된다.
일반적으로 악성 림프종과 같은 혈액종양은 항암제의 치료 반응률 및 완전 관해율이 높으므로 항암 치료가 가장 최선의 치료요법으로 선택되었다. 최근 다양하고 효과적인 세포독성 항암제의 개발과 표적치료제의 사용으로 항암 치료 효과는 더욱 증가하였지만 그에 반해 숙주의 면역 약화로 인해 B형 간염의 재활성화 위험성은 증가하고 있다. 그 중, 악성 림프종에서 사용되는 표적치료제인 Rituximab은 B세포를 표적으로 한 CD20에 대한 단일클론항체로 B형 간염 보유자에서 Rituxamab 치료 중에 B형 간염바이러스의 재활성화에 대한 보고들이 있으며[2] HBsAg 양성인 환자에서는 항암 치료 이전 항바이러스 제제를 투여하는 선제치료가 권고되고 있다[3]. 그러나 HBsAg 음성인 환자에서도 항암 치료 후에 B형 간염바이러스의 재활성화가 보고되었다. B형간염 바이러스에 감염된 후 회복되었다고 하더라도 혈청이나 간 조직 내에 낮은 수준의 B형 간염 바이러스는 존재할 수 있다. 이러한 경우 HBsAg은 음성으로 나타나지만 HBV DNA가 검출되거나 B형 간염 중심항체(HBcAb) 양성을 보이는데 이를 잠재감염이라고 하고 이러한 잠재감염 상태에서 항암 치료나 면역억제 치료를 하는 경우 B형 간염바이러스의 복제가 증진되어 재활성화가 나타나는 것이다[1,4].
우리나라 인구의 HBsAg 양성률은 2010년 3.7% [1]로 이는 B형 간염 예방접종이 도입되기 전 1980년 초반의 7.3%에 비해 감소 추세이다. 혈액종양 환자에서 HBsAg 양성률은 건강공혈자집단보다 높아서 국가마다 차이가 있지만 3-27%로 보고되고 있다[5]. 항암 치료를 받고 있는 B형 간염바이러스 표면항원 양성인 종양 환자의 B형 간염 재활성화 비율은 평균 25-40%로 보고되며 이 중 일부는 황달, 복수 등 간부전 증세를 보이고 심할 경우 사망까지 이르게 된다[6].
항암 치료 후에 B형 간염 재활성화는 HBsAg 양성인 경우와 음성인 경우 각각 달리 적용되는데, 표면항원 양성인 경우 재활성화가 되었다고 해도 혈청학적 표지자들의 변화는 사실상 거의 없기 때문에 HBV DNA 농도변화에 따라 판단하게 된다. 일반적으로 B형 간염 재활성은 항암 치료 후 HBV DNA 농도가 항암 치료 전에 비해 10배 이상 상승된 경우 진단할 수 있다. HBsAg 음성의 경우는 이전에 B형 간염을 앓고 회복된 후 또는 잠재감염의 상태로 있다가 종양 치료에 의해 바이러스 재활성이 나타나는 경우가 흔하다. 따라서 HBsAg 음성인 환자의 재활성은 치료 중 혈액 내 HBsAg이 재출현하거나 HBV DNA가 재검출되는 경우로 정의한다[1,7].
대상 및 방법
본 연구는 가천대 길병원에서 2005년 1월부터 2010년 12월까지 악성 림프종을 진단받고 항암 치료를 받은 총 196명의 환자에 대해 후향적 연구분석으로 이루어졌다. 연구에 참여한 모든 환자에 대해 항암 전, B형 간염 바이러스의 상태, 혈청 Aspirate aminotransferase (AST), alanine aminotransferase(ALT), 총 빌리루빈, HBV DNA level에 대한 자료를 후향적으로 분석하였다. B형 간염의 마커 중에 표면 항원/항체(HBsAg/Ab)는 enzyme immunoassays (Abbott Laboratories, Chicago, IL)를 이용하여 측정하였으며 중심핵 항원(HBcAb)은 radioimmunoassay (Corab, Abbott Laboratories, Chicago, IL)를 이용하였다. 혈청 HBV DNA 측정은 real time PCR(Abbott Laboratories, Chicago, IL)를 사용하였다.
항암 치료를 받는 모든 환자는 외래 추적관찰하며 매 항암 치료 주기마다 AST/ALT level을 검사하였다. 또한 항암 치료 전 HBsAg 양성 환자와 HBsAg 음성이면서 anti-HBc 양성 환자군의 경우 1년 간격으로 HBV-DNA level을 검사하였으며 매 항암 치료 주기마다 측정한 AST/ALT level이 증가 소견으로 보일 시에 HBV-DNA level을 추가적으로 시행하였다.
결 과
본 연구에 참여한 환자의 평균 나이는 57.3세(표준편차 ± 14.5)였으며 56.3%가 남성이었다. 본원에서 2005년 1월부터 2010년 12월까지 악성 림프종을 진단받고 항암 치료를 받은 총 196명의 환자들을 후향적으로 분석하였으며 그 중 172명(88%)의 환자들이 항암 치료 전 HBsAg에 대해 검사를 받았다. 검사를 받은 172명 중 11명(6.4%)이 HBsAg 양성 환자였으며, 161명(93.6%)은 HBsAg 음성 환자였다. 그러나 anti-HBc에 대한 항암 치료 전 검사는 HBsAg 음성인 환자 161명 중에 오직 26명(16%)에서만 이루어졌으며 이 중 15명(57.6%)이 HBcAb 양성, 11명(43.4%)이 음성 환자였다(Fig. 1). HBsAg 양성인 11명의 환자 중에 7명이 Rituxamab, cyclophosphamide, hydroxydaunorubicin, oncovin (vincristin), prednisolone 병합요법(R-CHOP)을 받았으며(diffuse large B-cell lymphoma: 6명, mantle cell lymphoma: 1명), 3명이 cyclophosphamide, hydroxydaunorubicin, oncovin (vincristin), prednisolone (CHOP)를 받았고(T-cell lymphoma: 2명, MALT lymphoma: 1명), 나머지 한 명은 NK/T-cell lymphoma를 진단받고 concomitant chemoradiotherapy(CCRT)를 받았다. HBsAg 음성이나 anti-HBc 양성인 15명의 환자 중에 12명이 R-CHOP을 받았고(DLBL:9명), 나머지 3명은 각각 CHOP (Anaplastic large cell lymphoma:1명), VP-16, ifosfamide, dexamethasone, L-asparagine[VIDL] (NK/T-cell lymphoma: 1명), ifosfamide, methotrexate, VP-16, pridnisolone [IMVP] (NK/T-cell lymphoma: 1명)를 받았다.
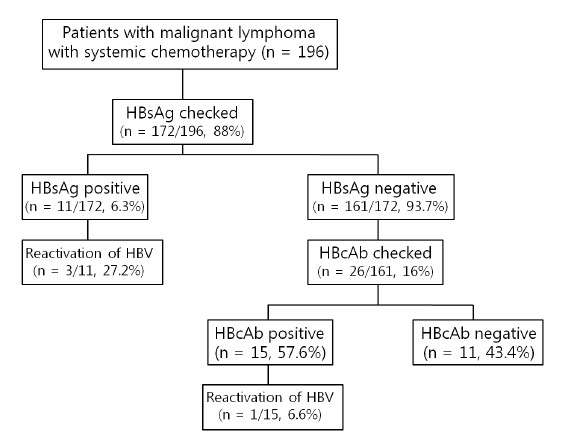
Hepatitis B virus status before chemotherapy and reactivation rate after chemotherapy in patients with malignant lymphoma.
총 196명의 환자 중에 항암 치료 후에 B형 간염 재활성화로 판명된 환자는 총 4명이었다. HBsAg 양성 환자군 11명 가운데 3명(27.2%), HBsAg 음성이지만 anti-HBc 양성인 환자군 15명 가운데 1명(6.6%)에서 재활성화가 확인되었다. HBsAg 양성인 11명의 환자 중에 5명에게 lamivudine을 이용한 선제 치료를 하였으며 이 중 4명의 환자에서 B형 간염의 재활성화가 발생하지 않았으나 나머지 한 명에서 항암 치료 후, B형 간염의 재활성화가 발생하였다.
Case 1 환자는 67세 남자로 2005년 DLBL을 진단받은 환자이다. 이 환자의 항암 치료 전 간기능 검사와 B형 간염의 바이러스 마커는 다음과 같았다. AST: 18 IU/L, ALT: 13 IU/L, HBV DNA level: < 2,000 copies/mL, HBsAg 양성, HBsAb 음성, HCV Ab 음성이었다. 그는 rituximab과 CHOP 항암 치료 전에 lamivudine으로 선제치료를 받았다. 항암 치료는 매 3주 주기로 4주기를 받았으며 마지막 주기를 받은 3개월 후에 그의 HBV DNA 농도가 6.9 × 105 copies/mL, ALT가 567 IU/L까지 상승하였다. 환자는 이후에 entecarvir (0.5 mg/day) 복용 후에 간기능 검사에서 정상 소견 보였으며 간염의 합병증 없이 항암 치료를 종료하였다.
Case 2 환자는 57세 남자로 2007년 MALToma를 진단받았다. 그의 항암 치료 전 간기능 검사와 B형 간염 바이러스 마커는 다음과 같았다. AST: 12 IU/L, ALT: 15 IU/L, HBV DNA level: < 2,000 copies/mL, HBsAg 양성, HBsAb 음성, HCV Ab 음성이었다. 그는 매 3주마다 CHOP 항암 치료를 6주기를 받았으며 마지막 주기가 끝나고 1개월 후에 그의 HBV DNA 농도는 7.7 × 106 copies/mL, ALT는 2,510 IU/L까지 증가하였다. 이후 환자는 entecarvir (0.5 mg/day) 복용하였으며 간기능 검사는 정상화되었으며 항암 치료의 연기 없어 치료를 종료하였다.
Case 3 환자는 55세 남자로 2009년 NK/T-cell lymphoma 진단받았다. 그의 항암 치료 전 간기능 검사와 B형 간염 바이러스 마커는 AST: 22 IU/L, ALT: 23 IU/L, HBV DNA level: < 51 copies/mL, HBsAg 양성, HBsAb 음성이었다. 그는 방사선 항암 치료를 받았으며 마지막 방사선 치료가 끝나고 3개월 후, 그의 HBV DNA는 1.3 × 108 copies/mL, ALT는 237IU/L까지 상승하였다. 이후 환자는 entecarvir (0.5 mg/day) 복용하였으며 간기능 검사는 정상화되었고, 간염에 의한 합병증 없이 항암 치료를 종료하였다.
Case 4 환자는 2006년 DLBL을 진단받은 여자 환자이다. 그녀의 항암 치료 전 간기능 검사와 B형 간염 바이러스 마커는 AST: 32 IU/L, alanine ALT: 23 IU/L, HBV DNA level: < 2,000 copies/mL, HBsAg 음성, HBsAb 음성, anti-HBc 양성, HCV Ab 음성이었다. 그녀는 rituximab와 CHOP 병합 요법으로 매 3주에 한 번씩 4번의 항암 치료를 받았고 마지막 항암 치료를 받고 8개월 후에 HBsAg이 음성에서 양성으로 변화되었으며 ALT는 90 IU/L까지 상승했다. 환자 이후에 Lamivudine (100 mg/day) 복용하였으며 간염의 심각한 합병증 없이 항암 치료 종료 후에 재발 여부에 대해 외래 경과관찰 중이다(Table 1).
고 찰
항암제와 표적치료제의 발전은 악성 림프종의 완치율을 높였지만 이에 따라 치료와 관련된 합병증으로 B형 간염의 재활성화 발생률은 증가하고 있다[8,9]. B형 간염의 재활성화는 항암 치료 중 숙주가 면역억제 상태가 되면 간세포 내에 있던 B형 간염 바이러스의 증식이 이루어지고 항암 치료 후 면역억제 상태에서 벗어나게 되면 B형 간염 바이러스의 증식에 의해 이루어진다. B형 간염의 재활성화에서 가장 중요한 요인은 바이러스의 증식능과 숙주의 면역능 간의 복잡한 상호작용이다[1,10,11].
항암 치료나 면역억제치료 이후에 발생하는 B형 간염바이러스의 재활성화는 무증상의 경우부터 전격성 간염에 의한 간부전과 같은 심각한 합병증까지 다양한 임상경과를 나타낸다. B형 간염의 재활성은 심각한 간부전을 일으키거나 동시에 종양의 치료가 지연되고 종료됨으로써 전체 생존율의 감소를 불러올 수 있다[6,12]. 항암 치료 후, B형 간염바이러스의 재활성화는 대부분 HBsAg 양성 환자에서 나타나며 재활성 비율은 평균 25-40%로 보고되며 이 중 5-30%는 황달, 복수, 위장관 출혈 등의 간부전 증세를 보이고 심한 경우 사망까지 이르게 된다. 그러나 드물게 HBsAg 음성인 환자에서도 나타날 수 있다. HBsAg 음성인 환자에게 있어 anti-HBc 양성인 경우는 잠재감염 또는 과거감염으로부터 회복된 경우를 의미한다. 최근 일련의 보고에 의하면 이러한 HBsAg 음성 환자에서도 상대적으로 적은 빈도이지만 B형 간염의 재활성이 발생하며(3-4%), HBsAg 음성의 재활성 간염은 오히려 HBsAg 양성인 경우보다 간부전, 사망 등이 더 흔한 것으로 보고되고 있다[13].
현재까지 연구에서는 항암 치료 후, B형 간염 재활성의 위험요인 및 악성 림프종 진단 후, 항암 치료를 받는 HBsAg 양성 환자에서 CHOP을 받은 군과 rituximab과 CHOP 병합요법을 받은 군 간의 B형 간염 재활성화율에 대한 비교연구가 있었으며 선제치료를 받지 않은 HBsAg 양성 환자에서 rituximab과 병합요법 후에 80% 환자에서 B형 간염의 재활성화를 보였다[13]. 또한 HBsAg 음성이나 anti-HBc 양성인 환자군에서는 rituximab과 병합 요법 후에 25% 환자에서 재활성화가 확인되었다[14]. 국내 보고에서는 항암 치료 후, B형 간염 재활성화를 보인 HBsAg 양성인 환자와 HBsAg 음성이며 HBcAb 양성인 환자에 대한 케이스 보고는 있었으나[5,15] 한 센터에서 악성 림프종을 진단받고 항암 치료를 받은 환자들에 대해 항암 치료 전, B형 간염 상태에 대한 검사율 및 B형 간염 재활성화율에 관한 연구는 없었다.
본 연구는 악성 림프종을 진단받고 항암 치료를 받은 196명의 환자에 대한 후향적 연구 분석을 하였으며 196명 중 172명의 환자가 항암 치료 전 HBsAg에 대한 검사를 받았다. 그러나 anti-HBc에 대한 검사율은 HBsAg 음성인 환자 161명 중 26명에 그쳤으며 실제로 항암 치료 후 HBsAg은 음성이지만 anti-HBc 양성인 1명의 환자에서 항암 치료 후 B형 간염의 재활성화가 확인되었다. 현재까지 연구에 의해 항암 치료 전 HBsAg 양성 환자의 경우 B형 간염 재활성화를 예방하기 위해 선제치료를 권고하고 있으며 본 연구에서도 11명의 HBsAg 양성 환자 중에 6명의 환자가 lamivudine 선제치료를 받았고 B형 간염의 재활성은 보이지 않았다. 그러나 아직은 HBsAg 음성인 환자 중에 anti-HBc 양성일 때 항암 치료 전 항바이러스제제의 사용에 대한 명확한 지침이 정립되지 않은 상태이다[16]. 이러한 환자에서 항바이러스제제의 사용을 고려해 볼 수 있으나 HBsAg 음성 환자의 경우 HBsAg 양성 환자에 비해 항암 치료 시작점으로부터 바이러스 재활성까지 걸리는 시간과 바이러스 재활성부터 간염의 발생 시점까지 걸리는 시간주기가 길기 때문에 항암 치료 중 바이러스 상태를 면밀히 검사하면서 바이러스 증가가 나타나고 아직 간염이 발생하지 않은 시기에 즉시 항바이러스제를 투여하는 지연치료 전략이 고려될 수 있다[9,17].
본 연구의 제한점은 후향적 연구이며 항암 치료 전 B형 간염바이러스 표지자에 대한 검사가 충분히 이루어지지 않았으며, HBsAg 양성 환자 11명 중에 6명이 항암 치료 전 선제치료를 받음으로써 B형 간염의 재활성화율이 낮아 이에 대해 일반화할 수 없다는 한계가 있다.
모든 악성 림프종 환자에서 항암 치료 후 B형 간염의 재활성화를 예방하기 위해서는 무엇보다 항암 치료 전, 환자의 B형 간염 상태에 대해 평가하는 것이 가장 중요하다. 이때 HBsAg 양성인 환자군에서는 항암 치료 전, 항바이러스 제의 선제치료가 반드시 필요하며 HBsAg 음성일지라도 anti-HBc 양성인 환자군에서 B형 간염의 재활성화가 발생할 수 있으므로 이에 대한 예방을 위해 항암 치료 전, HBsAg 음성인 환자에서 반드시 anti-HBc 유무에 대한 검사가 이루어져야 한다.
항암 치료 후 B형 간염의 재활성화는 심각한 간부전뿐만 아니라 항암 치료의 연기 및 조기 중단을 초래하여 사망률을 높일 수 있는 주요한 합병증인 만큼 이에 대한 치료 전 예방이 무엇보다 중요하며 이를 위해 항암 치료 전, 환자의 B형 간염 바이러스에 대한 평가가 정확히 이루어져야 한다.
