대장게실의 병태 생리
Pathophysiology of Colon Diverticulum
Article information
Trans Abstract
Although the pathogenesis of diverticulum remains unclear, traditionally it has been thought to result from structural abnormalities of the colonic wall, deficiencies of dietary fiber, or disordered intestinal motility. More recently, new pathophysiologic factors including inflammation, gut flora, neurotransmitters, visceral hypersensitivity, and chemical mediators are proposed, and their mechanism of interactions in developing diverticulum is quite complex and currently poorly understood. Future studies are needed to find out the multifaceted pathogenesis of diverticulum, ultimately for the treatment and prevention of disease. (Korean J Med 2013;85:551-558)
서 론
대장게실(colonic diverticulum)이란 대장 벽 일부가 장막 쪽으로 탈출하여 생긴 작은 주머니 모양의 병변이며 이 병변이 존재하는 상태를 게실증(diverticulosis) 그리고 병변에 염증이 생긴 경우를 게실염(diverticulitis)라고 정의한다. 게실 질환(diverticular disease)은 일반적으로 게실증과 게실염을 포함하는 용어이며 증상을 동반한 게실 질환(symptomatic diverticular disease)에는 게실 출혈, 게실염 및 그에 동반된 합병증인 농양, 누공(fistula), 장 폐쇄, 장 천공이 포함된다.
대장게실증은 대부분 증상이 없으나 게실염 혹은 게실 출혈의 증상이 발생할 경우 일부에서 심각한 합병증으로 진행할 가능성이 있기 때문에 임상적으로 간과할 수 없는 병변이다.
일반적으로 대장게실 질환은 급성으로 증상이 발생하여 수술을 하게 되는 경우가 흔하므로 급성 외과질환이라고 인식되어 왔다. 그러나 최근의 여러 연구들은 게실 질환이 단순한 질병이 아닌 복잡한 병태 생리를 가진 만성적인 질환이라는 쪽으로 의견을 모으고 있다[1].
본고에서는 대장게실의 병태 생리의 고전적인 견해와 함께 최신 지견을 고찰하고자 한다.
본 론
게실 질환의 유병률이 높은 서구에서는 좌측 대장게실증이 흔하고 유병률이 서구에 비해 높지 않은 아시아에서는 우측 대장게실증이 더 흔한 것으로 알려져 있다. 그러나 흥미롭게도 아시아인이 서구 사회에 이민한 경우 정착한 기간이 길어질수록 대장게실 질환, 특히 좌측 대장게실 질환의 발생 위험이 증가하였다[2]. 이러한 점에서 볼 때 서구의 대장게실 질환은 후천적인 질환이고 서구 생활방식으로의 변화가 위험도를 증가시킨다고 할 수 있다. 최근 생활환경이 서구화됨에 따라 아시아에서도 대장게실 질환의 유병률이 증가하고 있는 것도 이를 뒷받침하는 현상이라고 할 수 있다[3].
이러한 역학적인 근거에 입각하여 과거에는 동서양의 생활 차이를 염두에 둔 병인들을 게실의 병태 생리 인자로 주목하였다. 식이섬유의 부족과 구조적 이상이 중요한 원인이고 그에 따른 장 내압의 변화와 운동 이상 등으로 게실이 발생한다고 설명하였다. 그러나 최신의 이론들은 이러한 기전들 외에도 염증의 지속, 장내세균의 변화, 장 과민 반응, 및 운동 기능에 관여하는 신경전달물질의 변화들도 게실의 발생에 관여한다고 제시하고 있으며 특히 만성 게실 질환에서의 이 인자들의 역할에 주목하고 있다[1]. 다양한 기전들이 제시되고 있지만 각각이 병의 전부를 설명할 수 없고 서로 복잡하게 연관되어 게실 질환을 일으킨다.
식이 섬유소의 부족
1960년대의 연구에서 Painter 등은 게실 질환은 섬유소 섭취의 부족 때문이며 식이습관을 변화시킴으로써 게실증의 발생과 위험을 감소시킬 수 있다는 이론을 대중화했다[4-6].
섬유소는 대장 내 압력을 낮추고 장 통과시간을 단축하며 변의 부피와 무게를 늘리고 배변 횟수를 늘려준다. 섬유소의 섭취가 적으면 대장 통과시간이 증가하고 수분 흡수 증가 및 변의 부피의 감소로 변비를 일으키기 쉽다. 따라서 대장내압을 증가시키게 되고 결과적으로 게실 질환의 발병률을 높인다는 것이다[6].
1700년대에 게실 질환이 처음으로 보고되었으나 1900년대에 들어 그 발병률이 급격히 증가하였는데 이는 산업혁명으로 밀가루의 소비가 증가하고 식이섬유의 섭취는 감소한 시점과 맞아 떨어진다는 보고가 있다. 즉, 산업혁명으로부터 약 40년 후에 게실 질환의 발병이 급격히 증가하였는데, 이는 새로운 식이 습관을 가지게 된 어린이들이 중년이 된 시점과 맞아 떨어진다[7].
47,000명 남자를 대상으로 한 코호트 연구에서도 연령, 신체 활동, 총 지방 섭취량을 보정한 후 총 섬유소 섭취가 게실 질환의 발병 위험과 역상관관계가 있음을 보였다(RR = 0.58) [8]. 또한, 섬유소의 섭취가 많은 채식주의자에서 게실 질환이 적었다[9].
일부 동물 실험에 의하면 섬유소를 풍부하게 섭취한 쥐에서는 게실증이 9%에서 발생한 반면, 적게 섭취한 쥐의 경우 45%에서 게실증이 발생하였다[10,11]. 또 다른 실험에서는 섬유소를 많이 섭취한 쥐에서 대장에 콜라겐 침착이 감소했을 뿐 아니라 게실증 발생도 적었다[12]. 한편 게실 환자에서 섬유소 섭취를 늘렸을 때 변의 무게가 증가하고 전기 리듬이 호전되며 과도한 운동이(hypermotility) 감소하고 증상도 호전되었다[13].
그러나 이와 상반된 연구들에서는 게실 질환이 있는 환자에서 대장 통과시간이 차이가 나지도 않고, 섬유소 소비와 게실 질환과의 연관성이 없다고 보고하기도 하였다[8,14].
구조적 이상
게실은 장의 전벽을 포함하는 진성(true) 혹은 선천성(congenital) 게실과, 점막과 점막하 조직이 근육층을 뚫고 나가 장막으로만 싸여있게 되는 가성(false) 혹은 내압성(pulsion) 게실로 나뉘어지는데 일반적으로 질환을 일으키는 대장게실은 가성 혹은 내압성 게실이다.
대장은 소장 및 직장과는 달리 온전한 근육층인 환상근층을 가지고 있다. 바깥의 종주근은 3개의 띠(taenia coli)에 연결되어 있는데, 하나는 장간막 측(taenia mesentericus)에 다른 둘은 장벽의 내 외측(taeniae omentalis and libra)에 연결된다. 장간막에서부터의 혈관인 직행혈관 (vasa recta)은 대장의 환상근(circular muscle layer) 내로 뚫고 들어오는 점막과 점막 하층에 영양분을 공급한다(Fig. 1). 이러한 구조가 게실 발생에 중요한 부분이다.
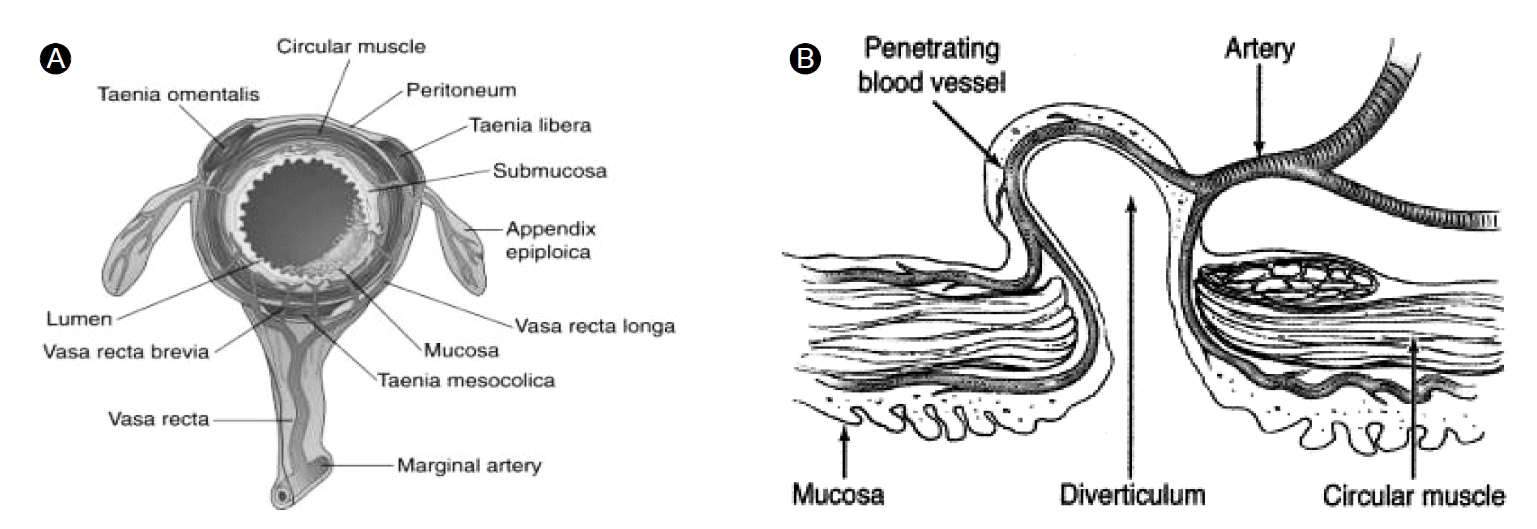
Colonic structural change in diverticulum. (A) Cross-sectional anatomy of the normal colon (From Gordon PH, Nivatvongs S: Principles and Practice of Surgery for the Colon, Rectum and Anus, 2nd ed. St Louis, Quality Medical Publishing, 1999, p 26.) (B) Anatomy of colonic diverticulum (From Savides TJ, Jensen DM. Techniq Gastrointest Endosc 2003:5(4);148-154).
게실이 흔하게 발생하는 위치는 대장 둘레를 따라 놓여있는 장간막 띠(mesenteric taenia)의 좌우측과 두 군데의 장간막대 띠(antimesenteric taenia)의 장간막측(mesenteric border) 부위인 4군데이며 이 부위 중 직행혈관(vasa recta)의 위치에서 발생한다. 이 지점은 근육이 위축되어 해부학적으로 취약하기 때문에 자연적인 탈장이나 압력에 의한 변형이 가능하다. 일반적으로 환상근 내로의 탈장은 쉬우나 띠(taenia)를 통과하기는 어렵다[3].
게실이 있는 대장 조직은 대개 환상근이 두껍고 장간막 띠가 짧으며 관강이 좁은 특징을 보인다[15]. 두꺼운 환상근은 장벽 비대 혹은 근세포 과증식에 의한 것이 아니고 근세포는 오히려 정상 상태이지만 엘라스틴(elastin)이 대장 띠(taenia coli) 내에 2배 이상 침착되어 생긴 2차적인 결과이다[16]. 콜라겐의 교차 결합은 40세 이상의 정상적인 노화 과정에서도 관찰할 수 있는 결과인데 연령을 보정하고도 게실 환자에서 콜라겐의 침착 변화가 더욱 광범위하였다[16,17].이러한 변화는 근정지성(myostatic) 수축을 야기하여 압력에 대한 장벽의 순응도와 장력을 더욱 감소시키고 장벽 조직을 더욱 뻣뻣하게 만들어 찢어지거나 변형되기 쉽게 만든다. 교원조직 질환인 Ehlers-Danlos 증후군이나 Marfan 증후군에서 더 이른 나이에 게실이 발생된다는 점은 이러한 기전을 뒷받침하는 한 예이다[3,18].
한편, 좁은 관강이 어떻게 게실을 발생시키는 조건이 될 수 있는지를 이해하기 위해서는 Laplace의 법칙을 살펴볼 필요가 있다.
P = kT + R
즉, 압력 P는 장벽의 긴장도와 비례하고 장벽의 지름 R과는 역비례한다. 구불결장의 경우 대장 분절 중에서 관강이 가장 좁은 곳이기 때문에 가장 압력을 많이 받는 부위가 된다. 또한 띠에 엘라스틴이 침착되는 현상으로 인해 환상근을 주름지게 접히도록 함으로써 내강을 좁히기도 한다. 대장의 관강이 전체적으로 통하는 정상적인 상황에서는 대장 장벽이 받는 압력이 모든 부위에서 동일하겠지만 대장의 분절 운동이 과도해질 경우 근육 수축에 따라 관강이 작은 방으로 나뉘고 각 방의 양 끝은 막힌 효과가 생겨 각 분절의 상황에 따라 내압이 올라가고 점막의 탈출이 가능하게 된다는 것이다. 대장 내압이 높은 특징은 유증상의 게실 질환 환자에서 더욱 두드러진다[2].
섬유소의 섭취가 게실의 예방에 효과가 있는 이유도 변 덩어리를 증가시켜 대장의 관강을 넓힘으로써 분절 운동을 방해하기 때문이라고 여겨진다. 흥미로운 점은 이러한 대장벽의 구조적인 변형에도 불구하고 이온 수송(ion transport)에는 차이가 없다는 점이다[19].
장의 운동 기능 이상
분절운동(segmentation)
투시 촬영을 통하여 대장의 정상적인 운동이 동시 다발적인 팽대 수축(haustral contraction)이며, 수축으로 인해 격리된 분획 혹은 작은 방들을 만들어서 국소적으로 높은 압력을 형성하게 한다고 보고되었다[5,15]. 이 과정을 분절운동(segmentation)이라고 한다. 분절 운동은 생리학적으로 볼 때 수분의 흡수와 전해질의 균형을 돕지만 국소적인 관강 내 압력을 높여 탈장이나 게실을 발생시킬 수 있다. 구불결장 내 기본 내압은 게실 유무와 상관없이 대기압보다 약간 높은 정도이고 정상 수축 압력은 10 mmHg인 반면, 유증상의 게실 환자에서는 90 mmHg까지 증가한다[3,4]. 따라서 높은 내압은 게실의 발생과 관련이 있다고 할 수 있지만[20] 아직까지 내압 증가가 어떻게 게실을 발생시키는지 직접적으로 증명되지는 않았다.
근전기 활동(myoelectric activity)
대장의 운동은 박동(pacemaker) 세포인 카할 간질세포(interstitial cell of Cajal)에 의한 서파(slow wave)와 근육 수축에 의한 속파(fast activity spikes)의 전기 활동에 의해 결정되는데, 대장게실 환자에서 대장 카할간질세포와 장 내 신경교세포(enteric glial cell)가 의미 있게 감소되었다[21].
한편, 과민성 장 증후군 환자에서는 분당 3 cycle의 운동형태를 보이는 반면 게실증 환자에서는 12-18 주기의 서파(slow wave)를 보였는데[22] 겨와 같은 섬유소를 섭취하였을 때 환자의 운동 형태는 정상으로 돌아왔다[13]. 유증상의 게실 질환 환자에서 ‘경련성 대장(spastic colon)’ 즉, 게실 부위 장의 규칙적이고 낮은 빈도의 수축 활동이 더 긴 간격으로 관찰되기도 하였다[23].
이러한 다양한 결과는 게실 질환의 진행에 따라 근전기 반응이 다르게 나타날 수 있기 때문이다. 즉, 초기 게실 질환에서는 ‘빈맥성(tachyrhythmic)’, 후기 게실 질환에서는 비정형 리듬과 낮은 빈도, 진폭, 전도 속도를 가지는 ‘서맥성(bradyrhythmic)’ 혹은 ‘침묵성(silent)’ 전기활동이 관찰되었는데, 이러한 불규칙성의 리듬은 대장 박동의 이상 때문으로 여겨지고 있다.
게실 질환에서 증가한 속파(fast activity spikes)가 질환 부위를 수술로 절제한 후에도 여전히 증가한 상태를 유지한다는 것은 전기 활동 자체가 병태 생리 인자로 의미가 있음을 시사하는 소견이다[2]. 전기 활동 이상에 의한 대장의 경련성 수축으로 인해 내압 상승이 발생할 것으로 생각되지만 아직까지 좀 더 명확한 증거는 밝혀내지 못한 상태이다.
신경전달물질(neurotransmitters)
최근, 게실의 병태생리 연구에는 대장 운동에 영향을 끼치는 화학물질 혹은 신경전달물질의 변화 관찰도 포함되었는데, 이는 신경전달물질의 이상이 대장 운동에 비정상적 변화를 일으켜 게실이 발생하는 상태를 만들 수 있다는 가설 때문이다.
세로토닌 (5-HT)
5-HT는 장관근 중간뉴론(myenteric interneurons)의 신경전달물질로서 느린 흥분성 시냅스 후 반응(slow excitatory postsynaptic response)을 일으킨다. 장내 신경 조직이 5-HT를 생성하는데, 체내 5-HT 중 95%가 장에 존재하고 주요 저장소는 점막 장크롬친화성 세포(Enterochromaffin cell, EC)이다. 7개의 수용체 아형 중에서 5-HT3 및 5-HT4 수용체가 위장관생리에 가장 많이 관여한다[25]. 장 내압이 증가하면 EC는 5-HT를 분비하고 그 결과 미주 신경 및 장 내 구심성 신경섬유(enteric afferent nerve fiber)를 자극한다[2].
5-HT는 게실 질환 환자의 절제된 대장 점막에서 증가되어 있음이 확인되었다[26]. 이는 게실 질환에서의 대장 운동 증가와 연관이 있었다. 그러므로 세로토닌 억제물질이 이 질환의 진행을 늦추고 특히 설사 증상이 있는 환자에서 증상을 완화할 수 있을 것이다. 그러나 정상 점막과 대장게실 질환의 점막 간의 5-HT 양의 차이가 없었다는 상반된 연구 결과도 있었다[27].
어느 단계의 게실 질환 환자가 포함되는가에 따라 다른 결과를 보일 수 있고 5-HT보다는 그 수용체가 중요한 역할을 할 수도 있다. 한 연구에 의하면 세로토닌의 양은 게실 질환에 상관없이 비슷한 수치를 보이는 반면, 급성 게실염을 최근에 앓은 환자의 경우 5-HT transporter의 양이 급격하게 소실되었는데, 게실염에서 회복된 경우에도 운동 능력의 회복이 지연될 수 있음을 설명하는 결과였다[27].
아세틸콜린
아세틸콜린은 시냅스 후 무스카린 M3 수용체를 통해 근육 수축을 매개하며 정상 장 평활근에서 중요한 신경전달물질이다[28]. 게실 질환 환자에서는 반응 민감성이 증가하는 것으로 알려져 있다. 즉, 세포외 근전기 실험에서 아세틸콜린을 투여하였을 때 정상군에 비해 게실 환자군에서 낮은주파수의 비조절성 근수축이 증가하였다[29]. 또한 게실 질환에서 평활근의 choline acetyltransferase가 감소하고 M3 수용체가 증가하며 아세틸콜린의 외부 투여에 더욱 민감해졌다. 이는 콜린성 신경분포 감소에 대한 보상반응으로 보인다[30]. 이러한 소견은 게실 질환에서 과다분절운동(hypersegmentation)과 식후 운동 반응이 과장되는 임상적, 생리적 이상을 설명해 주는 부분이기도 하다. 그러나 해부학적으로 주손상 부위는 엘라스틴이 침착되는 결장 띠 부분이기 때문에 게실 질환에서 종주근의 M3 수용체가 증가한다하더라도 근수축이 결장 띠에 의해 제제를 받아 실제로는 게실 질환의 대장이 외부의 콜린성 자극에 과민반응을 보이지 않을 수도 있다[2].
일산화질소(nitric oxide)
NO는 장관근신경총(myenteric plexus) 내의 비아드레날린성 비콜린성(NANC) 억제신경에 의해 분비되며 대장을 이완시킨다. 또한 NO는 guanylyl cyclase와 c-GMP를 통해 아세틸콜린을 조절한다.
게실 환자의 대장은 콜린성 신경에 더 강하게 지배를 받고, NANC 신경의 역할이 적으므로 대장을 이완시키는 NO 분비도 감소하고 NANC 신경의 이완반응에 끼치는 영향도 더 적었다[31].
그 외 신경전달물질들
점막과 장 전벽의 VIP (vasoactive intestinal polypeptide) 양도 게실 질환에서 더 증가되었는데, 환상근과 대장 띠(taeniacoli)에서는 변화가 없었다. 대장 통과시간 지연에 관련이 있을 것으로 생각되나 그 역할이 뚜렷하지는 않다. substance P와 neuropeptide Y의 수치 변화는 전 대장벽 층에서 관찰되지 않았다[32].
이상의 결과들은 게실 질환에서 신경전달물질이 얼마나 중요한 역할을 하는지에 대한 설명으로는 여전히 부족한 점이 많다.
염증
일반적으로 염증은 게실염과 같은 합병증이 동반되는 경우에 나타나는 것이지만 최근에 제시된 바에 의하면 염증 그 자체가 게실 질환 발생에 역할을 할 수도 있다고 한다. 경한 염증의 지속이 만성게실 질환과 관련이있다는 것이다. 무증상의 게실증 환자에서도 게실염의 임상적 소견 없이 림프구 침윤과 같은 염증이 발견되었으며 메살라민이나 5-ASA와 같은 항염증제에 치료 반응을 보이기도 한다[33,34].
염증의 정도는 다양해서 현미경으로나 관찰할 수 있는 정도이거나 염증성 장질환과 유사한 소견이 육안적으로 관찰되기도 한다. 게실증과 동반된 점막 염증 변화가 염증성 장질환의 임상양상과 유사한 경우 ‘segmental colitis’ 혹은 ‘diverticular colitis’로 불리기도 하였다[35,36]. 약 5,500명을 대상으로 한 다기관 연구에 의하면 20명(0.36%)의 환자에서 게실들과 연관되어 보이는 분절 결장염(segmental colitis)이 확인되었는데, 주요 임상증상은 게실 출혈이었으며 직장에는 병변이 없었고 혈액검사 결과는 정상이었다. 따라서 염증성 장질환과 유사한 내시경 소견을 보이더라도 주변에 게실이 존재한다면 진단에 신중해야 할 것이다[37].
만성 염증에 의한 신경 손상은 신경 조직의 재생성, 증식, 과신경분포 등을 야기하여 만성 게실 질환 환자가 통증에 과민하게 만들기도 한다[38].
장내 세균과의 연관성
변이 배출되지 못하고 오랜 기간 정체되어 남아있게 되면 만성적으로 장내세균의 불균형이 초래되고 유해한 대사물을 만들어 장기적인 염증상태를 유도할 수 있다. 게실염에 장내 세균이 연관이 있다는 증거는 리팍시민이 재발성 게실염에서의 증상 유발을 예방하고 유증상 게실 질환을 치료할 수 있다는 점을 들 수 있다. 또한 급성 게실염이 있는 환자 60%에서 호기검사상 소장세균과증식이 있음이 확인되었다[1,39].
섬유소가 장내 세균에 영향을 줄 것이기 때문에 게실의 발생에도 장내 세균이 의미 있는 역할을 할 것인가에 대해 최근 논란이 있어 왔다. 게실 발생에 의미 있는 역할을 할 것이라는 주장은 장내세균의 변화로 점막 방어 기능이 손상되고 염증성 사이토카인 반응이 증가함으로써 약한 정도의 염증이 지속될 수 있다는 점에 기인한다[40]. 한 연구에 의하면 유증상의 게실 질환 환자를 항염증제, 유산균 그리고 두 가지를 모두 투여한 군으로 나누어 비교하였을 때 두 가지를 모두 투여한 군에서 증상 재발이 예방되었다[41,42].
장 과민성
대략 약 10-25%의 게실 질환 환자에서 경하거나 중한 증상이 발생한다. 아직까지 그 병태생리에 대해서는 명확하게 알려진 바는 없지만 염증 반응과 함께 장 과민반응에 대해서도 고려되고 있다.
흥미로운 것은 만성 대장게실 질환과 과민성 장 증후군이 역학적으로 겹친다는 것이다. 대장 신전(distention) 자극을 주었을 때 정상인이나 무증상 게실증 환자에 비해 유증상 게실 질환 환자에서는 심한 통증을 느끼는데, 게실이 있는 구불결장뿐만 아니라 게실이 없는 직장에 자극을 주었을 때에도 같은 증상이 나타나는 것으로 보아 과민성 장 증후군의 생리적 특징을 보인다고 할 수 있다. 이러한 과민반응은 염증후 반응으로 인한 neuropeptide의 증가 및 게실 질환에서의 장 내 신경 분포의 변화와 관련이 있다[1,43].
그 외 역학적 관점에서 본 병인들
대장게실 질환의 유병률은 연령 증가와 강한 상관성이 있다. 40세 미만의 나이에서는 5% 정도의 병률이지만 80세 이상에서는 60%에 달한다[44]. elastin 침착이 증가하며 노화에 따른 장벽의 약화와 콜라겐 섬유의 교차결합 증가에 따른 장력의 감소 때문으로 추측하고 있다[2]. 그러나 질병의 발생 연령이 점차 낮아지고 있는데 이는 유전적인 원인일 가능성보다는 식이습관의 변화가 중요한 위험인자일 가능성이 높다. 젊은 환자에서 발생하는 게실 질환은 더 나쁜 예후를 보이는 경우가 많은데, 25-80%의 환자가 수술을 요하며 재발율도 높다[2,45-49]. 과거부터 노인성 질환이라는 생각이 진단과 치료를 지연시킬 수 있으므로 이에 대한 인식 변화가 필요하다.
비만은 게실염과 게실 출혈의 위험을 높이는 것으로 알려져 있다. 한 연구에서 허리둘레의 게실염 발생에 대한 상대 위험도는 1.56 (95% CI 1.18-2.07)이었고 게실 출혈에 대한 상대 위험도는 1.96 (95% CI 1.30-2.97)이었다[50].
운동 부족이 대장게실 질환의 위험인자일 가능성을 보여 준 연구는, 미국의 40세에서 75세의 남성 47,678 명을 대상으로 4년간 관찰한 전향적 연구로 나이, 섬유소 및 지방 섭취량을 보정한 후 총 신체 활동량이 유증상 게실 질환 발생과 역상관 관계에 있음으로 보여주었다(RR = 0.63) [51]. 여기서 위험도를 줄여주는 신체 활동이란 달리기와 같은 격한 활동을 의미한다. 그러나 어떻게 신체 활동이 게실 질환의 위험을 감소시킬 수 있는지 그 기전은 아직까지 알려져 있지 않다.
흡연, 카페인, 알코올과의 연관성은 뚜렷하지 않다[52]. 다만, 흡연으로 인해 게실 질환의 합병증 발생의 위험이 증가할 수는 있다. 반면에 총 지방 혹은 붉은 고기의 섭취량이 높고, 식이 섬유소의 섭취량이 적은 경우에는 유증상 게실 질환의 위험성이 증가한다[8].
결 론
게실 질환은 임상에서 비교적 흔하게 보는 질병이지만 과거 수십 년간의 수많은 연구에도 불구하고 그 병태 생리는 아직까지 불분명하다. 또한 식이습관 및 생활형태의 변화에 따라 질병의 특성도 변화하고 있다. 증상 호전에 중점을 두는 현대의 치료 경향과 부합하여 새로이 제시되고 있는 염증 혹은 장내세균, 신경전달물질 등의 기전은 항염증제나 생균제 등 게실 치료 영역의 확대를 예측하게 한다. 임상의로서 변화하고 있는 질병의 특성과 병태생리의 이론을 숙지하여 다양한 모습의 게실 질환을 올바르게 진단하고 근거에 입각한 효과적인 치료 및 재발의 예방에 노력해야 한다.