뇌하수체줄기 형성 부전으로 발생한 시상하부성 뇌하수체 기능저하증 1예
Hypothalamic Hypopituitarism Caused by Pituitary Stalk Dysgenesis
Article information
Abstract
본 증례는 9세경 저신장으로 성장호르몬 및 갑상선호르몬 이상을 진단받고 불규칙하게 치료받았던 과거력이 있는 28세 남자 환자가 성기능 장애에 대한 불안으로 내원하여 뇌하수체 줄기 단절에 의한 시상하부성 뇌하수체 호르몬 이상을 진단받고 사춘기 발현과 생식기능의 유지를 위한 치료를 시행하게 된 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Functional defects of the pituitary gland are a rare cause of pubertal delay. The pituitary stalk is an important structure that connects the hypothalamus and pituitary gland. A defect in fusion of the pituitary stalk and anterior pituitary gland will block the function of the anterior pituitary gland. A 28-year-old man was referred to our clinic with poorly developed secondary sexual characteristics. He had undeveloped facial, axillary, and pubic hair and was Tanner stage I. Laboratory tests gave random serum testosterone < 0.025 ng/mL, luteinizing hormone (LH) < 0.1 mIU/mL, follicle-stimulating hormone (FSH) 0.626 mIU/mL, thyroid-stimulating hormone (TSH) 6.85 μIU/mL, and fT4 6.96 pmol/L. Sella magnetic resonance imaging (MRI) showed no pituitary stalk enhancement. The response in the combined pituitary function test revealed multiple hormonal defects, while the TSH response to thyrotropin-releasing hormone (TRH) was exaggerated and delayed. Therefore, we concluded that pituitary stalk dysgenesis had led to hypothalamic-type panhypopituitarism. (Korean J Med 2013;85:420-424)
서 론
사춘기 지연은 사춘기의 신체적 변화가 여아에서 13세, 남아에서 14세까지 나타나지 않는 경우를 의미한다. 사춘기 지연의 원인은 체질적인 지연에서부터 식이 장애 및 만성 질환, 터너증후군 및 클라인펠터증후군과 같은 유전적 질환, 갑상선 기능저하증, 뇌하수체 기능저하증 같은 호르몬 이상에 의한 것까지 다양하다[1,2].
뇌하수체 기능저하를 초래하는 원인은 종양, 외상, 구조적 이상 등 여러 가지가 있으며 그 중 가장 많은 원인은 뇌하수체 종양이다[3,4].
뇌하수체 줄기 형성 부전은 터키안장 부위에서의 이상 소견과 뇌하수체 줄기의 소실, 뇌하수체 전엽의 위축이나 결손, 이소성 신경 뇌하수체 등을 특징으로 한다. 뇌하수체줄기 형성 부전의 원인은 저산소증이나 둔위 분만으로 인한 주산기 손상이나 뇌하수체의 발생에 관여하는 PROP-1, PIT-1, HESX-1 유전자들의 변이에 의한 것으로 알려졌으나 정확한 발생기전은 밝혀져 있지 않다[5,6].
이러한 뇌하수체 줄기 형성 부전증으로 인한 뇌하수체 기능저하 및 사춘기 지연은 국내에서도 3예가 보고되어 있다[7]. 하지만 본 증례는 사춘기 이전부터 성장장애가 있어 여러 차례의 뇌하수체 기능 검사를 시행하여 이를 비교할 수 있는 증례이며 환자의 2차 성징의 발현과 생식을 위한 치료를 시행하였기에 이에 대한 경험을 보고하고자 한다.
증 례
환 자: 28세 남자
주 소: 성 기능 장애와 이차성징이 없는 것에 대한 불안감
현병력: 20년 전 저신장(108 cm)으로 종합병원 방문하여 호르몬 검사를 하였고, 성장호르몬과 갑상선호르몬 결핍을 진단받고 성장호르몬 및 갑상선호르몬 치료를 하였으나 18년 전 자의로 약물치료를 중단하였다. 13년 전 키가 자라지 않아 개인 한의원을 방문하여 약물치료를 시작하였다. 10년전 저신장(142 cm)으로 병사용 진단서 발부를 위하여 다른 종합병원에서 뇌하수체 호르몬 검사를 시행하여 이상이 있다는 이야기 들었으나(Table 1) 복용 중이던 한의원 약물치료만 3년간 더 유지하였다. 환자 이차성징이 나타나지 않고 한 달 전부터 성 기능 장애에 대한 불안감이 있어 본원 정신과 외래 내원 후 내분비내과적 검사를 위해 내분비내과로 의뢰되었다.
과거력: 출생 시 특별한 문제는 없었으며 두경부 외상을 입은 과거력은 없었다.
가족력 및 사회력: 특이사항 없었다.
진찰 소견: 입원 시 혈압 120/80 mmHg, 맥박수 54회/min, 호흡수 20회/min, 체온 36.5℃였으며 신장 163.7 cm, 몸무게 57.2 kg, 체질량지수 21 kg/m2였다. 환자 난청이나 시야 결손, 후각 기능 이상 등은 관찰되지 않았다. 갑상선 비대 및 여성형 유방은 관찰되지 않았고 음모 및 생식기 발달 정도에 따른 성 성숙 척도인 태너 1단계에 해당하였다(I/V). 고환은 양쪽 모두 음낭 내에서 만져졌으며 고환측정계 2번의 크기였다.
혈액검사 소견: 말초혈액검사에서 백혈구 6,200/uL, 혈색소 12.1 g/dL, 혈소판 220,000/uL였다. 혈청 생화학 검사에서 혈액 요소질소 9.4 mg/dL, 크레아티닌 0.8 mg/dL, 나트륨 138 mmol/L, 칼륨 3.88 mmol/L, 염소 105 mmol/L이었다.
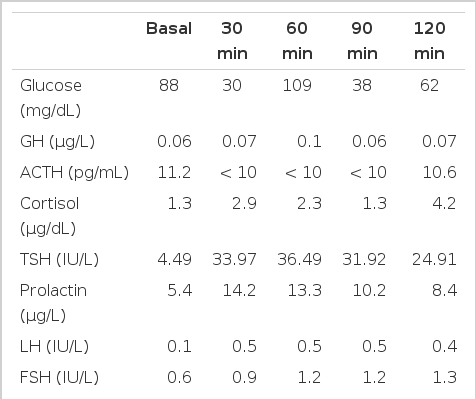
내분비 검사 소견: 기저 치의 호르몬 검사에서 총 테스토스테론 0.025 ng/mL (2.49-8.36), 유리 테스토스테론 0.16 ng/mL(8.8-27), 유리 티록신 6.69 pmol/L (11.5-23.0), 갑상선자극호르몬 6.85 uIU/mL (0.17-4.05), 인슐린 유사성장인자 23 ng/mL(69-303), 부신피질자극호르몬 15.22 pg/mL (5-60), 코르티솔 0.74 ug/dL (6.7-22.6)이었다. 복합 뇌하수체 자극검사에서 갑상선자극호르몬, 프로락틴을 제외하고 여포자극호르몬, 황체형성호르몬, 성장호르몬, 코르티솔 등은 기저치에서 증가하지 않았다(Table 2).
방사선 검사 소견: 생식기 초음파에서 음낭에 고환이 정상적으로 있었으며 크기는 오른쪽 2 cc, 왼쪽 2.5 cc 측정되었다(정상 성인 20 cc). 손목 단순 촬영에서 골연령은 17세였다(Fig. 1).

A radiograph of both hands shows opened epiphyses (arrow) in the wrist and hand. The measured bone age was 17 years.
치료 및 경과: 뇌하수체 잔여 기능 평가를 위한 복합뇌하수체 자극검사 및 구조적인 이상을 확인하기 위해 뇌하수체 자기공명영상 촬영을 시행하였다. 자기공명영상에서 정상 뇌하수체 줄기는 관찰되지 않았으며 T1 영상에서 이소성 신경 뇌하수체가 관찰되었다(Fig. 2). 복합 뇌하수체 자극검사에서 갑상선자극호르몬 분비호르몬에 갑상선자극호르몬은 정상보다 높아지고 늦어진 최대치를 보이고 있었다. 성선자극호르몬 분비호르몬(GnRH, Gonatotropin releasing hormone)을 0.1 mg을 하루에 1번, 5일간 연속적으로 투여 후 6일째에 성선자극호르몬 분비호르몬을 0.1 mg 사용 후 30분, 60분, 90분, 120분에 황체형성호르몬 및 난포자극호르몬을 측정하였다(Table 3). 그 결과 초기 수치와 비교하면 난포자극호르몬과 황체형성호르몬이 증가하였다. 저자 등은 복합 뇌하수체 자극검사 및 뇌하수체 자기공명영상, 장기 성선자극호르몬 분비호르몬 자극검사 결과에 따라 뇌하수체 줄기 형성부전과 이소성 신경 뇌하수체를 동반한 뇌하수체 기능저하증으로 진단하였다.
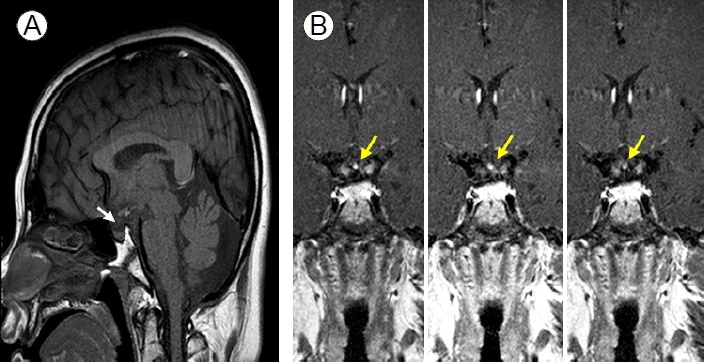
On sella MRI (A) sagittal T1-weighted images show a small high signal change suggesting ectopic neurohypophysis located at the break in the pituitary stalk. The white arrows indicate no visible pituitary stalk. (B) T1-weighted enhanced images ordered temporally show no enhancing pituitary stalk. The yellow arrows indicate the ectopic neurohypophysis.
호르몬 보충요법으로 갑상선 호르몬제(신지로이드) 100 mcg, 프레드니솔론 7.5 mg으로 치료를 시작하였으며 사춘기 발현 및 정자 형성을 위해 사람 융모 성선자극호르몬(hCG, Human chorionic gonadotropin) 5,000 IU을 1주에 3번 근육주사로 3개월 시행 후 사람 폐경성선 자극 호르몬(hMG, Human menopausal gonadotropin) 75 IU과 같이 1주에 3번 근육주사로 병용하기로 했다.
2달간 투여 후 시행한 검사에서 황체형성호르몬과 여포자극호르몬의 수치는 초기 수치와 비슷하였으나 유리 테스토스테론의 수치 13.90 ng/mL로 증가하였다. 치료 전에는 발기되지 않았으나 치료 진행 후 발기가 되었으며 아직은 초기지만 음모 생성을 확인할 수 있었다. 고환 크기는 고환측정계 3번의 크기로 증가하였다. 입원 시에는 발기되지 않아 정액 검사를 시행하지 못하였던 자로 발기 관찰되어 정액 검사를 시행하였으나 정자는 검출되지 않았다. 현재 치료를 유지하며 고환의 크기 변화와 정자의 생성 여부를 추적관찰후에 고환의 조직 검사도 고려 중이다.
고 찰
뇌하수체는 뇌하수체 줄기를 통해 시상하부와 연결되어 있으며 시상하부의 자극호르몬이 뇌하수체 줄기를 통해 뇌하수체 전엽을 자극하고 호르몬의 분비를 조절한다. 따라서 뇌하수체 줄기에 문제가 발생하게 되면 뇌하수체 전엽의 호르몬 분비기능이 저하된다[3].
뇌하수체 전엽의 기능저하에 의한 증상은 결핍된 호르몬의 종류 및 결핍된 시기에 따라 무증상에서부터 저신장 또는 이차성징 결핍 등 다양하게 나타난다. 어린 나이에 뇌하수체 기능 저하가 발생하면 저신장과 사춘기 지연이 발생할 수 있다[2].
호르몬의 분비 이상은 일차성, 이차성 그리고 삼차성으로 나눌 수 있다. 일차성 호르몬 기능저하증은 표적기관의 문제로 표적 호르몬은 감소하지만 자극 호르몬은 상승한다. 이차성 및 삼차성 호르몬 기능저하증은 표적기관에는 문제가 없으나 표적기관을 자극하는 자극 호르몬의 부족에 기인한 것으로 표적 호르몬과 자극 호르몬 모두 감소하여 있다. 본 증례의 경우에서 갑상선자극호르몬 분비호르몬의 자극에 의한 갑상선자극호르몬의 분비 최대치가 30-60분 사이로 늦어져있고 오히려 120분 이후에도 분비자극이 지속하는 현상을 보여 시상하부 이상에 의한 뇌하수체 기능장애 즉 삼차성 분비장애의 현상을 보인다[8]. 또한 삼차성 분비장애는 뇌하수체 유리호르몬의 장기간 투여로 뇌하수체 호르몬 분비를 원활하게 한 후 자극하면 뇌하수체 호르몬의 분비가 회복된다. 본 증례에서는 성선자극호르몬 분비호르몬을 5일간 투여후 검사한 결과 난포자극호르몬 및 황체형성호르몬의 수치가 증가하였다. 이에 뇌하수체 줄기의 형성 부전으로 인한 삼차 성선기능저하증으로 진단하였다.
뇌하수체의 발생 시에 여러 유전자가 관여하는데 PROP, PIT-1, HESX1 유전자들이 여기에 해당한다. Fernandez-Rodrguez 등[4] 및 Sloop 등[9]의 연구에 따르면 HESX1, LHX3, LHX4, PROP-1 등의 유전자 변이가 이소성 뇌하수체와의 연관성이 유의하게 나타나지는 않았으나 한 유전자가 아닌 다형성으로 여러 유전자가 연관되어 발생할 것으로 생각된다.
뇌하수체 줄기 형성 장애 및 이소성 신경 뇌하수체가 있는 상태에서 보이는 호르몬 결핍은 성장호르몬 단독 결핍부터 뇌하수체 전엽 호르몬의 다발성 결핍까지 다양하지만 대부분에서 뇌하수체 후엽의 기능은 보존된다. Jagtap 등[10]의 연구에서 보면 뇌하수체 줄기가 보이지 않는 군이 보이는 군에 비해 다발성 호르몬 결핍이 더 많으며 성장호르몬 단독 결핍에서 다발성 호르몬 결핍으로의 진행이 잘 나타난다. 본 증례에서는 초기 장애 시의 호르몬 검사 수치가 부족하고 사춘기 이전이어서 초기결핍이 갑상선호르몬과 성장호르몬 뿐이었는지는 확실하지 않지만 10년 전 뇌하수체 기능검사의 결과부터는 전체호르몬의 결핍이 보인다. 본 환자의 10년전 및 현재 시행한 복합 뇌하수체 자극검사 결과를 보았을 때 갑상선자극호르몬의 반응 양상은 비슷하며 모두 삼차성 기능저하증의 양상을 보이고 있다.
뇌하수체 기능저하증은 여러 가지 원인에 의해서 발생하고 임상양상은 특별한 증세가 없는 경우부터 부신피질호르몬 저하증, 갑상선 기능저하증, 사춘기 지연에 이르기까지 다양하다. 환자가 사춘기 지연은 있으면서 다른 증상이 없는 경우나 저신장만 동반된 경우에도 뇌하수체 기능저하증의 동반을 염두에 두어야 하며 환자의 상황에 따라 치료 방법이 고려되어야 한다.