자발적 약물유해반응 데이터베이스를 이용한 항암제 유해사례 현황 분석
Data Analysis for Anti-Neoplastic Chemotherapy-Related Adverse Events Reported to the Korean Pharmacovigilance Regional Network
Article information
Abstract
본 연구는 국내 자발적 보고된 항암제 유해사례에 대한 서술적 분석이었으며 가장 유해사례 보고가 많은 계열의 항암제는 pyrimidine 유사체였으며 항암제와 관련되어 가장 흔히 보고된 부작용 양상은 위장관계 부작용과 피부, 부속기계 부작용이었다. 또한 본 연구에서 확인된 미반영 유해사례에 대해서는 그 인과 관계를 평가하기 위해서 향후 지속적인 모니터링과 연구가 필요할 것으로 사료된다.
Trans Abstract
Background/Aims:
To describe the toxicity profile of anti-neoplastic agents from real clinical settings, we analyzed spontaneouslyreported adverse events (AEs) using data from the adverse drug reaction (ADR) reporting system of the Korean Food and DrugAdministration (KFDA).
Methods:
Data were extracted from the nationwide spontaneous ADR reporting system of KFDA from July 2009 to December2010. We extracted and analyzed data related to chemotherapy and identified unlabeled ADR that were not described in the packageinsert of the products.
Results:
In total, 5,867 cases of antineoplastic agent-related AE reports were identified after excluding cases for duplication andcases assessed as ‘unlikely’ and ‘unclassifiable’, based on expert opinion. Of the patients with AEs, 52.4% were males and themedian age was 56 years. In total, 460 AEs (7.8%) from 267 patients were reported as ‘serious’ AEs. The most common causativeanti-cancer drug class was pyrimidine analogs (31.5%), followed by platinum compounds (19.9%), protein kinase inhibitors(10.8%), and taxanes (8.8%). The most common clinical manifestation of AEs was gastrointestinal toxicities (25.5%), followed byskin disorders (25.3%), and generalized reactions (14.3%). In total, 168 cases (2.9%) of unlabeled AEs were identified. Amongthese, 10 were reported as serious AEs.
Conclusions:
The most common causative class of antineoplastic agents was that of pyrimidine analogs. Gastrointestinal anddermatological toxicities were the most common clinical chemotherapy-related adverse events. Further investigation and monitoring to evaluate causality associated with unlabeled AEs identified in this analysis are needed. (Korean J Med2013;85:385-395)
서 론
항암화학요법은 수술, 방사선 치료와 함께 항암치료의 3대 치료 방법 중 하나로 종양의 종류, 병기, 환자의 상태에 따라서 완치뿐만 아니라 생명연장, 질병조절, 증상경감 등의 완화 목적으로 사용된다[1]. 항암화학요법에 따른 여러 약물유해반응(adverse drug reaction, ADR)들은 약제의 작용효과가 종양세포뿐 아니라 정상세포에도 영향을 미쳐 발생하는 것들이 대부분이며 가벼운 오심부터 중증 골수부전까지 다양하게 나타날 수 있으며[1] 항암제에 대한 과민반응도 상대적으로 수는 적지만 꾸준히 발생하고 있다.
항암제에 의한 약물유해반응은 항암제의 효과만큼이나 환자 치료에 영향을 미치는 심각한 위험요소이다. 약물유해반응은 환자 개개인의 신체, 정신적 손상을 초래할 뿐 아니라 유해반응에 대한 추가치료, 입원기간 연장 등으로 인해 의료비용을 증가시킨다[2-6]. 1996년에 발표된 Lapeyere-Mestre 등이 프랑스에서 시행한 항암화학요법을 받은 환자들에 대한 병원자료를 이용한 연구 결과 입원기간 중 최소 1회의 ADR을 경험할 가능성이 3,429명의 입원 환자의 5%라고 추정하였으며 ADR에 의한 비용은 병원 전체 비용의 1.9%, 약물 비용의 15%에 해당하였으며 ADR 치료를 위해 추가로 소요된 비용은 전체 의료 비용의 32%에 해당하는 것으로 나타났다[7]. 또한 비교적 최근에 미국에서 시행된 유방암 환자의 보험 청구자료를 이용한 연구 결과에 따르면 항암화학요법을 받는 여성의 경우 그렇지 않은 환자에 비해 심각한 유해 사례로 인하여 병원에 입원하거나 응급실을 방문한 비율이 11% 더 높았으며 항암제 관련 심각한 유해사례를 경험한 환자의 경우 1인당 입원 비용이 연간 $12,907, 처방 비용이 $1,908가 추가로 소요되는 것으로 조사되었다[8].
항암제의 잠재적으로 치명적인 유해반응은 임상시험에서 발견되지 않은 채 시판 후 수십 년이 지나서 발견될 수 있어 항암제 유해반응에 대해서는 지속적인 감시가 필요하다[9]. 항암제에 의한 유해반응 정보는 대부분이 임상시험 자료와 제조회사의 허가사항에 기초하는데, 시판 후 실제 환자 투여 후 보고된 여러 기관의 자료를 기반으로 한 대규모 항암제 특이적인 유해사례 정보에 대한 분석은 아직까지 이루어진 바 없다. 본 연구에서는 약물감시연구사업단 사업의 일환으로 전국 15개 병원에서 보고된 자발적 약물부작용자료 중 항암제의 유해 사례를 분석하여 최근 국내 환자에서 발생한 항암제 유해반응의 특성을 제시하고자 하였다.
대상 및 방법
연구 대상
본 연구는 2009년 7월부터 2010년 12월까지 18개월간 식약청에 신고된 모든 자발적 약물유해사례 신고자료 중 항암제에 의한 사례들을 대상으로 하였다. 그러나 항암제가 병용 약물로서 포함된 경우 중복보고 또는 추적신고로 확인된 경우는 대상에서 제외하였다. 이 중 전문가에 의한 인과성 평가에서 ‘가능성 낮음’과 ‘평가/분류 불가’는 분석에서 제외하였다.
국내 의약품 유해사례 보고 용어 및 분류체계는 1990년에 공식적으로 처음 발표된 World Health Organization-Uppsala Monitoring Center (WHO-UMC)에서 용어를 제정, 개정하고 있는 WHO-Adverse Reaction Terminology (WHO-ART)를 이용하여 보고하고 있다[10]. 따라서 식약청에 신고된 유해사례는 WHO-ART 코드의 우선 용어(preferred term, PT)로 코딩되었으며[11], 신고일자, 신고자 및 환자정보(성별, 연령), 의심약물 성분명 및 약효군 분류, 신고된 유해사례, 결과의 심각도 여부, 전문가 의견이 포함되어 있었다.
항암제의 기준은 WHO의 Anatomical Therapeutic Chemical (ATC) 분류 코드 상위 범위 L (Anti-neoplastic and immunomodulating agents)에 포함된 약물로 하되[12], 이 중 항암목적으로 사용되지 않는 약물(immunosuppressive agents, megestrol, peg-interferon (IFN), IFN-β, other immunostimulant, colony stimulating factors)은 제외하였다.
분석 방법
항암제 계열별 유해반응 보고 건수, WHO-ART의 인체 기관계 분류(system-organ classes)에 따른 유해반응 보고 건수, 성별 및 연령에 따른 분석을 시행하였으며 기관계에 따른 유해반응 분석을 위해서 PT의 레코드 번호(adverse reaction record number, ARRN)에 두 개 이상의 기관계가 지정되어 있는 경우에는 Common Terminology Criteria for Adverse Events (CTCAE) v 4.0의 분류를 고려하여 조정하여 분석하였다[13].
유해사례의 심각도에 따라 기록된 중대한 유해사례는 선천적 기형, 생명의 위협 및 사망 여부, 입원 및 입원기간 연장 초래 여부의 카테고리로 분류하였다. 중대한 유해사례는 유형에 따라 분류하였으며 A형 유해반응은 약리학적 작용이 증강되어 나타난 것으로 용량 의존적이고 예상 가능하며 예방 가능한 것으로 정의하였으며 B형 유해반응은 환자 체질 특이적으로 발생한 것으로 용량과 상관성이 없으며 예측 불가능한 부작용으로 정의하였다[14].
보고된 유해반응 중 현재 제조회사의 제품설명서에 포함되지 않은 미반영 유해반응(unlabeled ADR)을 확인하기 위해서 보고된 유해반응과 약물의 제품설명서를 대조, 확인하여 분석하였다. 미반영 유해사례는 WHO-ART의 PT와 CTCAE의 용어를 모두 고려하여 검색하였다. 국내 제품설명서는 한국 식품의약품안전청의 의약품사이트인 이지드럭(http://ezdrug.kfda.go.kr/kfda2)의 제품정보와 BIT 드러그인포(http://www.druginfo.co.kr/) 사이트의 제품 상세정보로 확인하였다.
결 과
보고 건수 및 일반적 특성
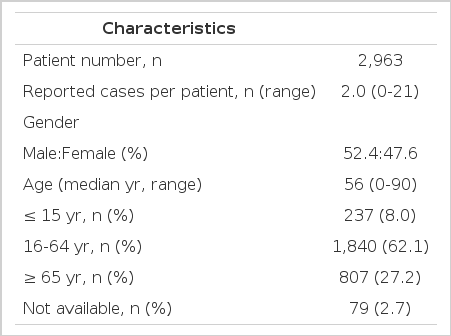
연구 기간 중 제외기준에 해당되는 사례를 제외한 항암제에 의한 유해사례 보고 건수는 총 5,925건이었다. 이들의 인과관계를 WHO-UMC의 평가 기준에 따라서 분류한 결과 확실함은 278건(4.7%), 가능성 높음이 1,824건(30.8%), 가능성 있음이 3,162건(53.4%)이었으며 가능성 희박은 40건(0.7%), 평가/분류 불가는 18건(0.3%)이었고, 전문가 의견에 인과관계 평가가 없는 경우가 603건(10.2%)이었다. ‘가능성 희박’ 40건, ‘평가/분류 불가 18건을 제외한 총 5,867건이 분석 대상에 포함되었다. 분석에 포함된 유해사례는 총 2,963명의 환자에서 보고된 5,867건으로, 환자 한 명 당 평균 1.98건이 보고되었다. 유해사례 보고의 52.4%가 남성에서 보고되었다. 이들 환자의 평균 연령은 56세로, 15세 이하의 소아가 8.0%, 65세 이상의 노인이 27.2%를 차지하였다(Table 1).
유해사례의 원인 약물
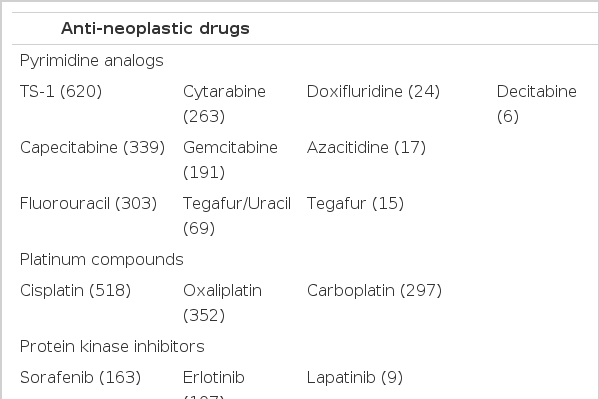
자발적 유해사례 보고의 원인 항암제는 성분명 기준으로 총 80종이었으며 표 2에 계열별로 정리하였다. ATC 분류기준에 따른 항암제 분류 계열별로 보면 pyrimidine 유사체가 차지하는 비율이 31.5% (1,847건)로 가장 높았으며 그 다음으로는 백금 화합물(19.9%), protein kinase inhibitors (10.8%), taxane (8.8%)의 순서였다. 성분별로 분석하면 전체 유해사례 중 TS-1와 관련된 유해사례의 비율이 전체의 10.6% (620건)로 가장 높았으며 그 다음으로는 cisplatin 8.8% (518건), oxaliplatin 6.0% (353건), capecitabine 5.8% (339건), fluorouracil 5.2% (303건), carboplatin 5.1% (297건), cytarabine 4.5% (263건)의 순서였다.
유해사례의 임상 증상별 분류
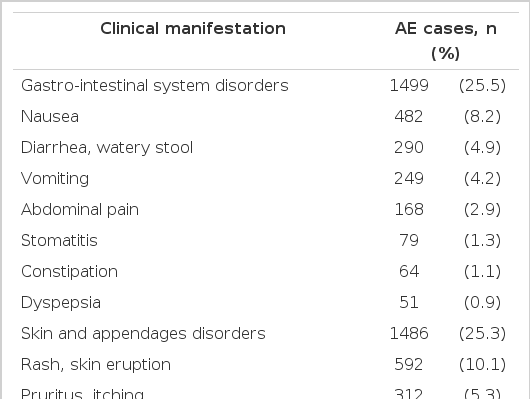
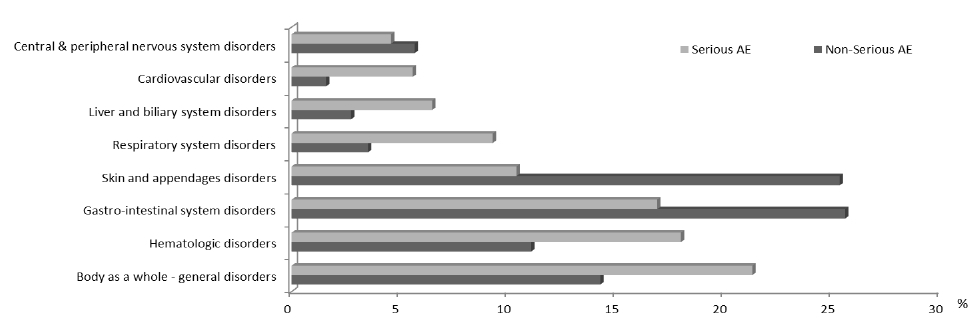
위장관계 유해사례가 전체의 25.5%로 가장 높은 비율을 차지하였으며 위장관계 유해사례의 주요 증상은 오심, 설사, 구토, 복통 등이었다. 이와 유사한 빈도로 피부 및 부속기계 유해사례가 25.3%를 차지하였으며 발진, 소양감, 두드러기가 흔히 보고된 임상양상이었다. 그 다음으로는 발열, 무기력증, 과민반응 등을 포함한 전신계로 분류된 유해사례(14.3%), 혈액계(11.0%), 중추 및 말초신경계, 호흡기계, 대사 장애, 간담도계 등의 순서였다(Table 3).
특정약물에 의한 기관계별 유해사례 보고 건수와 특정약제에 의한 주요 유해반응이 항상 일치하지는 않았다(Fig. 1). 위장관계 유해사례들의 원인약물로는 TS-1®, fluorouracil, cisplatin 등이 높은 비율을 차지하였다. 반면, 개별 항암제별로 분석해보았을 때 보고된 유해사례 중 위장관계 유해사례가 차지하는 비율이 높은 약물은 fluorouracil, tegafur/uracil, capecitabine, TS-1®과 같은 fluorouracil 유사 약물들로 주로 위장관계 유해반응이 이들 약제의 주된 부작용임을 알 수 있었다.

Number of specific drug-induced adverse events (AE) and percentage of individual AEs among all AEs related with specific drugs.
피부 유해사례의 원인 약제 중에서는 cisplatin, TS-1®이 단연 높은 비율을 차지하였다. 그러나 개별 항암제 성분 중 보고된 유해사례 중 피부 및 부속기계 유해사례가 차지하는 비율이 높은 약제는 thalidomide, erlotinib, cetuximab, gefitinib 등이었다. 이들은 보고된 건수는 상대적으로 적었으나 피부 유해사례가 주된 유해반응을 차지하였다.
전신계 유해사례 중에서는 cisplatin, TS-1®, oxaliplatin, paclitaxel에 관련된 것의 빈도가 높았으나, 보고된 유해사례 중 전신계 유해사례가 차지하는 비율이 높은 약물은 bleomycin, IFN, rituximab, docetaxel 순서였다.
혈액계 유해사례의 흔한 원인 약제로는 carboplatin, cisplatin, gemcitabine, etoposide 순이었으며 혈액학적 유해사례가 차지하는 비율이 높은 약물은 etoposide, ifosfamide, doxorubicin, gemcitabine의 순이었다.
중대한 유해사례(serious adverse events, SAEs)
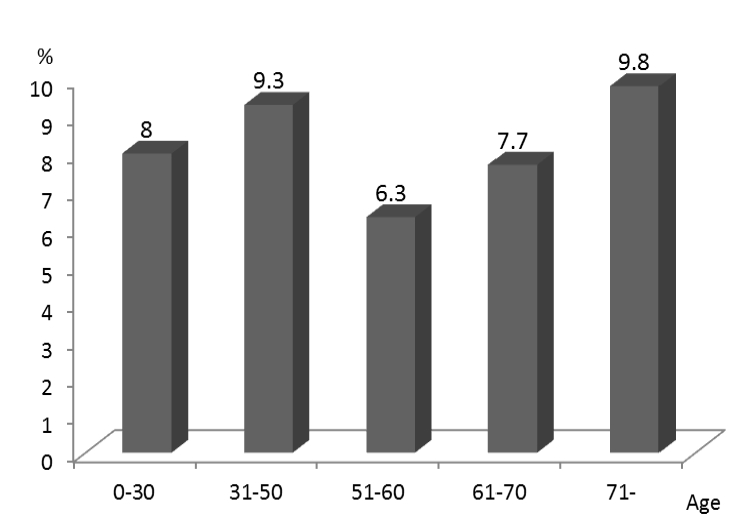
보고된 유해사례 결과의 심각도에 따라 중대한 유해사례로 보고된 건은 총 267명의 환자에서 460건(7.8%)이었다. 중대한 유해사례 보고의 55.6%가 남성에서 보고되었다. 연령대별 중대한 유해사례의 보고 비율을 분석해 보면 50대 이후에서는 나이가 많을수록 SAE의 비율이 증가하는 추세를 보였다(Fig. 2).
중대한 유해사례의 기관계별 분류를 보면 전신계 유해사례가 98건(21%)으로 가장 많았으며 그 다음은 혈액계 유해사례(18%), 위장관계 유해사례(17%)의 순서로 나타났다. 중대한 유해사례와 그렇지 않은 유해사례의 기관계별 비율을 보면 중대한 유해사례의 경우 과민반응이나 아나필락시스 반응이 포함된 전신계, 혈액계, 간담도계, 호흡기계, 심혈관계 유해사례의 비율이 높았던 반면 중대하지 않은 유해사례의 경우 위장관계, 피부․부속기계 유해사례의 비율이 높았다(Fig. 3).
중대한 유해사례 중 372건(80.8%)에서 유해사례의 유형을 분류할 수 있었으며 이 중 62.4%가 A형 유해반응이었고 37.6%가 B형 유해반응이었다.
중대한 유해사례 중 영구적 기능손상을 초래한 유해사례는 6명의 환자에서 총 10건이 보고되었다(Table 4). 생명을 위협하는 유해반응은 총 9건으로 모두 아나필락시스(anaphylactic shock)이었으며, 이를 유발하는 약물은 L-asparaginase (2건), cisplatin (2건), oxaliplatin, cytarabine, etoposide, carboplatin(각 1건)이었다.
입원을 초래하거나 재원기간 연장을 초래한 유해사례는 약 4.3%였으며 137명에서 268건 보고되었다. 유해사례의 양상은 다양하였으며 이 중에서 발열성 호중구감소증과 설사가 각각 19건씩으로 가장 큰 비중을 차지하였다(Table 5).
허가 미반영 유해사례(unlabeled adverse events)
전체 보고된 유해사례 중 허가 미반영 유해사례는 45종의 약물에서 총 168건(2.9%) 확인되었다. Carboplatin이 21건으로 가장 많은 허가 미반영 유해사례가 보고되었으며 cisplatin, methotrexate 각각 15건, fluorouracil 10건 등이 확인되었다. 미반영 유해사례 중 중대한 유해사례로 보고된 건수는 총 9건이었으며 tegafur-uracil 2건(옆구리 통증, 골반 정맥혈 전증), asparaginase 1건(담낭염), carboplatin 1건(기억 장애), cisplatin 1건(떨림), cytarabine 1건(흉막삼출), viscum album abietis (Helixor®) 1건(열성 호중구감소증), methotrexate 1건(어지러움), TS-1® 1건(담관염) 보고되었다. 약물별 허가사항 미반영 유해사례는 표 6에 정리하였다.
고 찰
본 연구는 임상시험에서 보고된 유해반응이나 특정기관의 특정 암환자에서 보고된 유해반응 분석이 아닌 식약청에 자발적으로 보고된 5,885건의 항암제 유해사례를 분석한 것이다. 자발적 보고 자료의 한계로 항암제 유해사례의 정확한 발생 빈도를 분석할 수 없었지만 보고된 원인 약물과 임상 양상을 분석할 수 있었다.
항암제 유해사례가 보고된 환자군의 특성을 보면 여성과 남성의 비율이 비슷하였는데, 이는 일반적으로 남성보다 여성이 약물유해반응에 취약한 것으로 알려진 것과는 차이가 있었다[15,16]. 본 연구에서는 전체 항암제를 투여한 환자의 수를 확인할 수 없었기 때문에 남녀별 유해반응 발생률을 구할 수 없었다. 그러나 국가암정보센터의 통계를 보면 암 발생률이 여성보다 남성에서 더 높으며 여성 암 발생률의 1위는 갑상선암으로 대부분이 표준 치료로 항암치료를 하지 않기 때문에 남성 환자가 항암화학요법을 받았을 가능성이 더 높고 따라서 이로 인한 유해사례를 경험하고 보고할 확률이 더 높았을 것으로 추정된다. 연령대별 중대한 유해사례와 중대하지 않은 유해사례의 보고 비율을 보면 71세 이상의 노인 환자에서 중대한 유해사례의 보고 비율이 높음을 확인할 수 있었고, 이는 이전에 70세 이상의 노인에서 다른 연령군에 비해서 중대한 유해 사례가 증가된 연구와 일치하는 결과로 볼 수 있다[15,17].
본 연구에서 항암제 중 유해사례가 가장 많이 보고된 계열은 pyrimidine 유사 약물이고 단일 성분으로는 TS-1®이 가장 많았다. TS-1®은 일본에서 개발되어 사용되고 있는 경구용 항암 치료제로 진행성 위암이나 진행성 대장암 등 위장관 종양치료에 적응증이 있으며 주된 항암성분은 5-fluorouracil(5-FU)의 전구약물인 tegafur와 두 종류의 효소억제제인 gimeracil, oteracil potassium의 복합제이다[18,19]. 보고 빈도가 높은 유해사례를 기관계별로 보면 위장관계, 피부 및 부속 기계, 전신계 그리고 혈액계의 순서로 높았다. 위장관계 부작용의 신고 비율이 높은 약물은 TS-1®, capecitabine, 5-fluorouracil, tegafur/uracil으로 모두 5-fluorouracil와 이의 전구약물이었으며 이는 임상시험에서도 모든 등급의 부작용 빈도 분석에서 설사, 구내염, 오심, 구토의 위장관계 부작용의 빈도가 높은 것과 일치하는 결과였다[20]. 혈액계 부작용, 즉 골수독성의 경우 일부 항암제를 제외한 대부분의 항암제의 주요 부작용이지만 본 연구에서는 전체 보고 비율의 11.1%를 차지하여 상대적으로 빈도가 높지 않았는데 이는 대부분 항암제 투여시 예상되는 부작용이기 때문에 자발적인 부작용 신고가 실제 발생보다 적게 반영되었던 것으로 추정된다.
본 연구에서 분석 가능한 중대한 유해사례의 62.4%가 A형 반응이었다. 중대한 유해사례의 특성상 B형 반응의 보고 비율이 높을 것으로 예상되지만 항암제의 특성상 용량 의존적이고 예측 가능한 부작용임을 알더라도 치료 유익성을 고려할 때 반드시 사용해야 하는 경우가 많기 때문에 A형의 유해반응이 상대적으로 많았던 것으로 사료된다.
자발적인 약물유해사례 보고는 사전에 예측하지 못한 약물유해반응을 찾을 수 있는 실마리 정보로 활용이 가능하다. 본 연구에서 국내 제조회사의 제품설명서에 반영되지 않은 미반영 유해사례가 168건을 확인하였다. 유해사례는 증상 및 질병명 모두가 포함되어 있으나 제조회사 제품설명서에 포함되는 유해사례의 범위나 용어의 기술 방식이 회사마다 달라 분석에 어려움이 있었다. 유해사례 용어는 WHO-ART의 동일 ARRN에 해당하는 PT, CTCAE 용어 모두를 고려하였으며 구체적으로 증상이나 질병명이 기술되어 있지 않은 경우에는 미반영 유해사례로 분석하였다. 예를 들어 ‘간장애’로만 기술되어 있지만 ‘담낭염’의 사례가 보고된 경우에는 미반영으로 간주했다. 그러나 발진의 경우 광범위한 의미에서는 두드러기, 소양감을 포함할 수도 있지만 제조회사마다 각각 기록된 경우도 있었으며 일부 항암제의 경우 두드러기나 소양감에 대한 언급 없이 발진으로만 표시한 경우도 있어 본 연구에서는 이러한 경우는 광의의 발진으로 고려하여 미반영 사례 분석에는 포함시키지 않았다. 본 연구에서 미반영 유해사례로 확인된 사례 중 중대한 유해사례로 보고된 cytarabine의 흉막삼출의 경우 심낭염 및 이로 인한 증상으로 흉막삼출에 대한 사례 보고들이 있어[21,22] 향후 수집되는 사례에 대한 주의 깊은 관찰이 요구된다. TS-1®의 중대한 유해사례로 보고된 담낭염의 경우에도 최근 일본에서 TS-1® 의한 경화성 담관염의 증례를 보고한 바 있어 향후 유사한 사례 발생에 주의를 기울여야 하겠다[23]. 항암치료 후 특히 고용량의 함암치료 후에 인지기능 저하에 대한 연구 결과가 있기 때문에 carboplatin에 의한 인지 기능저하도 유해사례 보고도 허가사항에는 반영되어 있지 않지만 충분히 개연성이 있다고 사료된다[24]. 가장 빈번한 미반영 유해사례로 분석된 methotrexate의 어지러움의 경우 외국 허가사항에는 흔하게 발생하는 부작용으로 기술되어 있으며[25] tamoxifen과 관련되어 보고된 관절통과 감각이상도 외국의 허가사항에 반영되어 있으나[26] 국내 제품설명서에 포함되어 있지 않아 국내 제품설명서의 개정이 요구된다. 또한 cisplatin에 의한 유해사례로 보고된 진전의 경우에는 증상을 기술한 것으로 원인 질환 및 구체적인 증상의 형태를 평가하여 보고한 것이 아니어 정확한 판단은 어려우나 외국 허가사항에는 저마그네슘혈증으로 인해 발생할 수 있는 증상으로 기술되어 있으며[27] 또한 허가 반영된 유해 사례인 말초신경병증의 한 증상일 수도 있다[28]. 그러나 국내 제품설명서에는 말초신경병증은 기술되어 있으나 저마그네슘혈증 및 이로 인한 진전 또는 떨림 등의 증상 발현 모두가 명시되어 있지 않아 이에 대한 개정을 고려해 볼 수 있겠다. Carboplatin의 유해사례로 보고된 진전의 경우 cisplatin과 마찬가지로 저마그네슘혈증 및 말초신경병증과 관련된 증상으로 발현되었을 수도 있으나 외국 문헌에서 carboplatin 포함 항암화학요법 후 진전/운동실조 증후군의 증례 보고도 있으므로[29] carboplatin에서 발생 가능한 유해사례로 판단되며 향후 이에 대한 주의 깊은 관찰이 필요하다.
대부분의 항암화학요법이 단일 항암제가 아니고 2-3종의 항암제를 조합하여 사용하기 때문에 실제 보고된 유해반응이 이중 특정 항암제와의 인과성을 확인하는 것은 어려울 수 있다. 따라서 일부 항암제의 유해사례에 대한 연구에서는 개별 항암제보다 병용요법별 부작용 양상을 보고한 경우도 있다[7]. 그러나 현재 식약청의 유해반응 보고 자료로는 병용요법별 유해사례 분석은 불가능하다는 제한점이 있었다. 따라서 향후 항암제 유해사례 보고형식에 의심 약물로서 또는 병용 약물로서의 항암제를 기록하는 형식보다 전체 항암제 병용요법을 기록하는 형식을 추가하는 것을 고려해 볼 필요가 있겠다.
미국 국립암연구소(National Cancer Institute)는 항암치료에 사용하는 약물의 부작용의 표준화된 분류와 보고를 위해서 CTCAE를 개발했으며 실제로 모든 종양 임상시험에서는 이의 용어와 등급을 이용하여 유해사례를 보고하고 있다[12]. 식약청 보고에서 기준으로 하는 WHO-ART와 CTCAE의 용어 및 기관계별 분류는 차이가 있으며 식약청 보고 형식에는 항암제에 의한 독성 반응의 등급을 기록하는 형식이 없어 보다 자세한 분석은 한계가 있었다. 항암제의 유해반응은 발생 자체도 중요하지만 독성 반응의 심한 정도(등급) 또한 치료 결정에 중요한 역할을 하므로 이러한 기록이 이루어질 수 있도록 항암제의 경우 별도 형식으로 관리하는 것도 고려해 볼 수 있겠다.