동종조혈모세포 이식 후 기관지 내에서 재발한 급성 골수성 백혈병 1예
Endobronchial Relapse of Acute Myeloid Leukemia after Allogeneic Stem Cell Transplantation
Article information
Abstract
다수의 경우 골수성 육종은 진단 내리기 쉽지 않고 감염이나 다른 고형 종양으로 오진하기 쉽다. 특히 이전에 혈액 질환의 기왕력이 없는 경우는 더욱 그러하다. 임상의들은 고형 종괴에 대해 검사를 진행함에 있어서 진단이 명확치 않은 경우 드문 질환이긴 하지만 골수성 육종의 가능성을 염두 하여야 하며 조직 검사를 통한 진단을 위해 노력을 기울여야 할 것이다. 이전 혈액 질환의 기왕력이 없던 환자에서 골수성 육종이 진단되었을 경우에는 동반되어 있을지 모르는 혈액 질환에 대한 조사가 동반되어야 한다. 또한 이전 완전 관해를 이루었던 환자에서 골수 외 재발이 확인되었을 경우에는 골수 외 재발이 골수 재발과 동반되거나 선행하여 나타날 수 있으므로 골수에서의 재발 여부에 대한 평가도 다시 이루어져야 할 것이다.
Trans Abstract
Myeloid sarcoma is an uncommon extramedullary tumor of immature myeloid cells or myeloblasts. It may occur alone or concurrently with an underlying hematological malignancy. Although it can develop anywhere in the body, common sites include bones, particularly the skull and vertebra, soft tissues, and lymph nodes. However, there have been few reports of myeloid sarcoma occurring in the respiratory system, especially the large airways. We describe a case of endobronchial relapse of acute myeloid leukemia in a patient who achieved complete remission after allogeneic stem cell transplantation. To our knowledge, this is the first such report in Korea. (Korean J Med 2013;85:318-323)
서 론
녹색종 또는 과립성 육종으로도 알려져 있는 골수성 육종은 골수 외 부위에서 발생하는 골수계 미분화 세포로 구성된 종양이다. 1811년 Burns에 의해 골수성 육종이 처음 보고된 이후 혈액질환과 연관된 몇몇의 사례들이 보고되었으나 급성 골수성 백혈병과 골수성 육종과의 관계를 처음으로 기술한 것은 1893년 Dock [1]이 처음이다. 비특이적 증상으로 사후에 진단이 이루어지는 경우가 많아 정확한 발생률은 알 수 없으나 문헌 보고에 따르면 급성 골수성 백혈병 환자에서 골수성 육종의 발생률은 1.4-9% 정도로 매우 드물다[2]. 골수성 육종은 신체 내 어느 부위에나 발생 가능하나 호흡 기계를 침범한 사례들은 흔치 않으며 특히 기관지를 침범한 사례는 극히 드물게 보고되었다[3-6]. 국내에서는 아직 사례 보고가 없는 상태로 저자들은 동종조혈모세포 이식 후 완전 관해를 이루었던 급성 골수성 백혈병 환자에서 기저 질환의 재발과 함께 기관지 내에서 발생한 골수성 육종 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 41세 여자 환자
주 소: 2개월 가량의 마른 기침
현병력: 내원 2년 전 급성 골수성 백혈병(M1)을 진단 받고 관해 유도 항암치료 이후 골수조직검사상 완전 관해 소견을 보여 13개월 전 동종 조혈모세포이식(family mismatched transplantation)을 받고 추적관찰하던 중 1개월 전 골수 조직 검사에서 재발이 확인되어 항암치료를 계획하였다. 내원 2개월 전부터 시작하여 호전 없이 지속되는 마른 기침에 대한 검사 및 평가를 위해 내원하였다.
과거력: 과거 폐결핵 및 폐질환의 병력은 없었다. 이식 후 6개월간 tacrolimus 0.5 mg을 1일 1회 복용하였고 내원 7개월 전부터는 복용을 중지한 상태였다.
가족력 및 사회력: 특이 사항 없었다.
이학적 소견: 내원 당시 혈압은 120/80 mmHg, 맥박 90/분, 호흡수 20/분, 체온은 37.0℃, 산소포화도 98%였다. 두부 진찰에서 이상 소견은 없었다. 흉부 청진상 좌측 하부 폐야에서 수포음이 청진되었고 심음은 정상이었다. 복부 검사상 압통 및 반발 압통 없었고 종괴 및 간 비종대도 없었다.
검사 소견: 말초혈액검사에서 백혈구 4,750/mm3 (호중구 1.0%, 림프구 73.0%, 단핵구 1.0%, 모세포 25%), 혈색소 7.4 g/dL, 혈소판은 44 × 109/L였다. 혈청생화학 검사에서 BUN/Cr 13.0/0.75 mg/dL, AST/ALT 35/42 IU/L, 총 단백/알부민 7.1/4.1 mg/dL, Na/K 140/4.0 mEq/L, LDH 356 U/L, 적혈구침강속도는 22 mm/h, C-reactive protein 0.38 mg/dL였다.
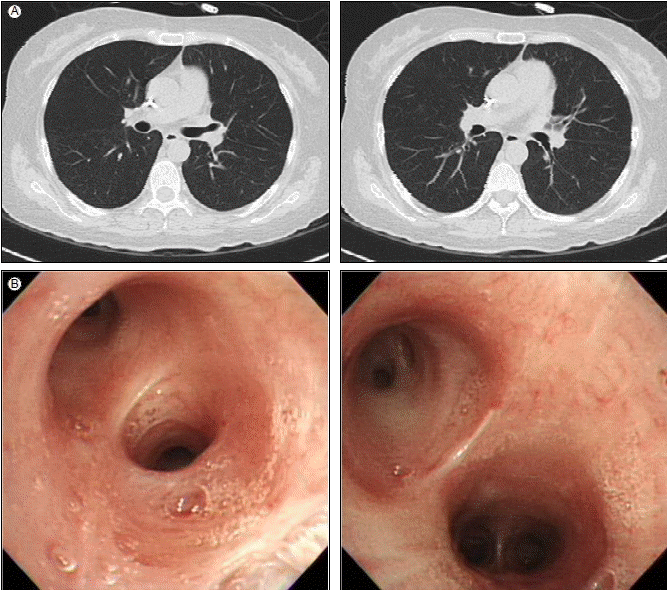
방사선 소견: 부비동 단순 X-선 촬영에서 부비동염 등의 이상 소견은 보이지 않았다. 흉부 단순방사선 사진에서는 좌측 폐문부의 음영이 증가되어 있었고 좌주기관지의 원위부와 좌하부엽 기관지가 우측과 비교하여 볼 때 좁아져 있었다(Fig. 1). 흉부 전산화 단층촬영에서는 좌상엽과 하엽 기관지의 협착과 기관지벽의 비후를 보였고 전종격종에는 타원형의 종괴가 관찰되었으며 여러 개의 종격종 림프절들이 비후되어 있었다(Fig. 2).
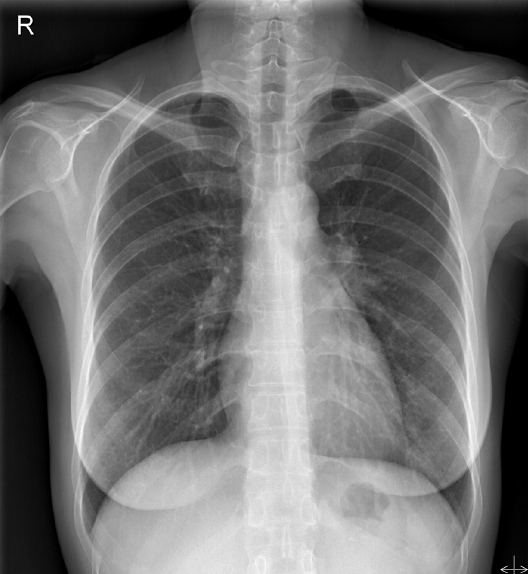
Chest X-ray shows slightly prominent left hilar shadow and narrowing from the left main bronchus to lower lobe bronchus, as compared with the right lung airway.
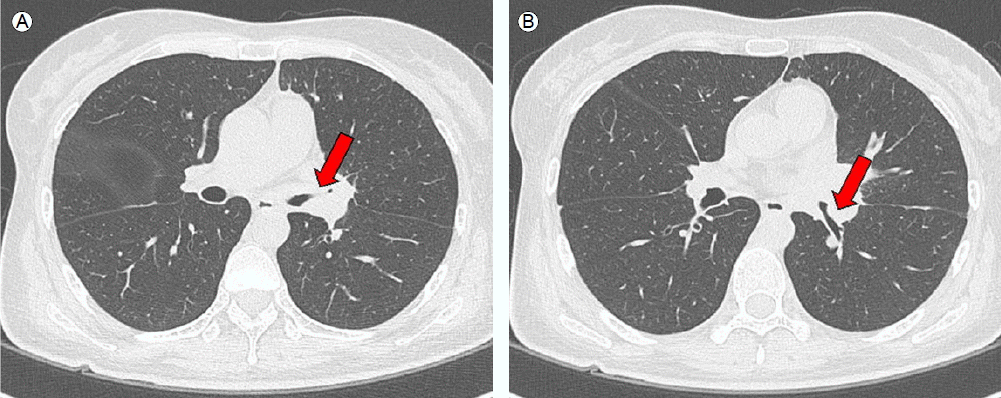
High-resolution CT showed narrowing and wall thickening in the (A) left upper and (B) lower lobar bronchi.
폐기능 검사 소견: 폐기능 검사에서 노력성 폐활량(FVC)는 2.58 L (81.4%), 1초간 강제호기량(FEV1)은 2.05 L (76.5%)였고, FEV1/FVC는 79.49%였다. 메타콜린기관지유발 시험은 음성이었다.
경과: 기관지내시경 검사상 좌주기관지, 좌상엽과 좌하엽기관지 점막의 비후 및 울혈 소견과 접촉성 출혈(easy touch bleeding)이 관찰되었다(Fig. 3). 좌하엽기관지에서 기관지 찰과술과 세척술을 하였고 좌주기관지 원위부에서 기관지 점막 조직 검사를 하였다. 기관지 세척액에서 시행한 세균, 바이러스 PCR, 항산균 및 곰팡이, 폐포자충 PCR 등의 미생물 검사에서 동정된 균은 없었다. 기관지 점막 조직 검사에서는 비정형 골수세포 침윤이 관찰되었고 면역 조직 화학 검사상 CD34, CD117, Myeloperoxidase (MPO) 양성이었다. Ki-67 index는 50-60%였으며 TdT는 음성이었다(Fig. 4). 골수에서 시행한 면역 조직 화학 검사에서는 CD 33, 64, 117, cy-MPO가 양성이었다. 환자는 급성 골수성 백혈병의 재발과 함께 기관지 내에서 발생한 골수성 육종으로 진단되었고 mitrone, cytarabine, etoposide을 포함한 재유도 항암치료를 받았다. 치료 2개월 후 추적한 저선량 흉부 전산화 단층 촬영에서 백혈병 침윤에 의해 나타났던 좌상엽 기관지 벽의 전반적인 비후 및 좌상엽 폐허탈 모두 이전과 비교하여 호전된 모습을 보였고 기관지 내시경에서도 기관지 내 병변은 확인되지 않았다(Fig. 5). 그러나 골수 조직 검사에서는 이전과 같은 백혈병 세포의 침윤이 20%에서 관찰되어 clofarabine, cytarabine으로 변경하여 재유도 항암치료를 하였고 이후 시행한 추적 골수 조직 검사에서는 관해가 확인되었다. 환자는 말초 조혈모세포이식을 하였고 현재 재발 진단 후 8개월째 생존해 있다.
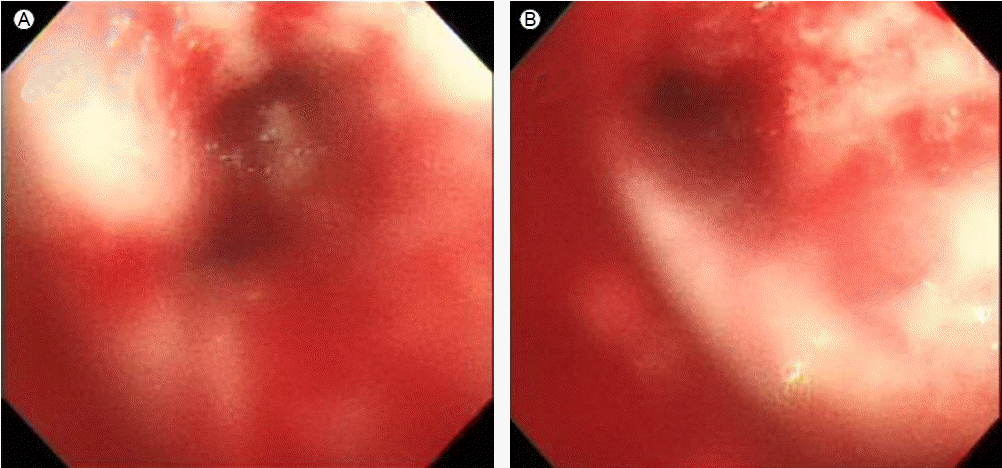
During bronchoscopy, there were edematous, hyperemic mucosal changes with easy touch-bleeding tendencies, resulting in diffuse luminal narrowing in the airway (A) Left distal main bronchus, (B) Left upper lobar bronchus.
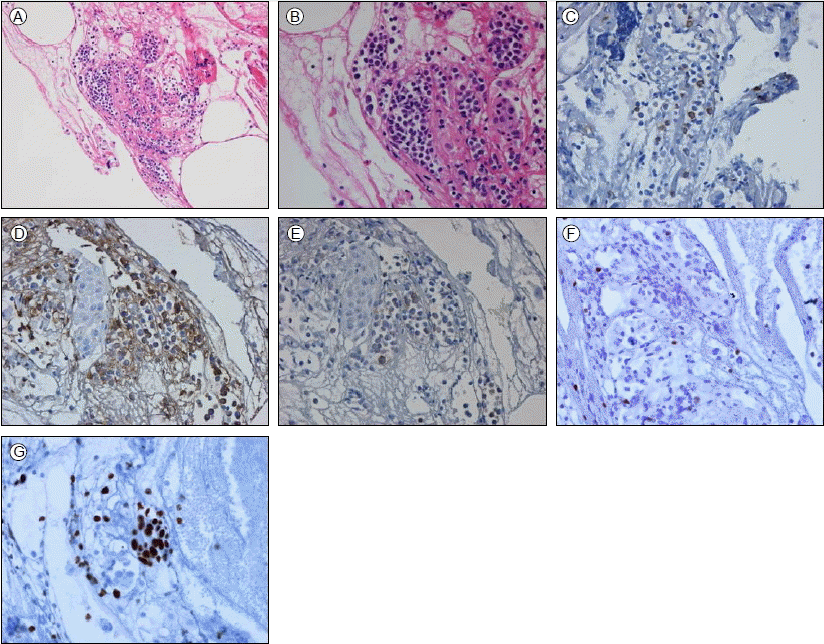
(A) Atypical myeloid cell aggregation was seen in the bronchial mucosa (hematoxylin and eosin staining, × 200), (B) A higher magnification of tumor cells revealed eccentric nuclei with hypogranulated cytoplasm (hematoxylin and eosin staining, × 400). Immunohistochemically, the atypical cells were positive for (C) myeloperoxidase (× 200), (D) CD34 (× 200), (E) CD117 (× 200), negative for (F) TdT (× 200), and showed (G) a high proliferation index with ki-67.
고 찰
급성 골수성 백혈병 환자에서 골수성 육종의 발생률은 1.4-9% 정도로[2], 급성 골수성 백혈병의 첫 진단 이전이나 진단 시, 혹은 병의 경과 중에 확인될 수 있으며 완전 관해 이후 재발 시에도 관찰이 가능하다. 모든 나이 대에서 발생하며 남녀 비율에는 큰 차이를 보이지 않는다.
골수성 육종이 발생하는 기전은 아직 밝혀지지 않았다. 그러나 어린 나이, FAB 아형 중 M4/M5, t (8:21), inversion 16 또는 11q23과 같은 염색체 이상, CD 56 발현이 있는 경우들 에서 발생 빈도가 더 높은 것으로 나타나고 있다. 특히 조혈모세포 이식 후 재발한 골수성 육종의 경우, 자가조혈모세포 이식보다는 동종조혈모세포이식을 한 경우, 이식 후 면역조절 치료를 한 경우, 두 번째 조혈모세포이식을 한 경우 골수성 육종의 발생이 더 높았다[7]. 본 환자 역시 동종조혈모세포이식 후 골수성 육종이 발생한 사례였다.
골수성 육종은 발생 위치에 따라 다양하고 비특이적인 증상 및 증후를 보인다. 신체 내 어느 부위에서든 발생 가능하지만 흔히 발생하는 부위는 두개골이나 척추와 같은 골부위, 연조직, 림프절 등이어서 통증, 운동 이상, 안구돌출증 등이 다른 증상보다 흔하게 관찰된다[7]. 폐실질이나 늑막, 기도 등 호흡기 계통을 침범하는 사례들도 있기는 하나 매우 드물게 발생하고 있으며 특히 급성 골수성 백혈병 환자에서 기관지를 침범한 경우는 문헌고찰상 오직 4예밖에 보고되지 않았다. 두 사례는 첫 진단된 급성 골수성 백혈병 환자에서 한 사례는 전신 항암 치료로 완전 관해를 이루고 1년 뒤 골수 조직 검사상 재발을 확인한 환자에서 호흡곤란 및 기침 등을 보여 시행한 검사에서 기관지 내 골수성 육종을 진단한 경우였고 마지막 한 사례는 전신 항암치료 이후 7년간 완전 관해 상태로 지내던 중 발열, 기침, 호흡곤란으로 검사 후 기관지내 골수성 육종을 진단받았으나 골수 검사에서는 재발의 증거를 보이지 않았던 경우였다[3-6]. 본 증례는 타 증례와 달리 급성 골수성 백혈병에 대한 치료로 조혈모세포 이식을 받고 1년 후 기관지 병변으로 골수성 육종이 진단된 경우로 국내에서는 최초 보고이다.
감염이나 다른 고형 종양을 감별하고 골수성 육종을 확진하기 위해서는 조직 검사가 필수적이다. 본 증례에서도 영상검사에서는 좌측 기관지의 내경 감소 및 벽 비후가 있어 조직 검사 전에는 기관지를 침범한 아스페르길루스증 혹은 기관지 결핵을 먼저 의심하였으나 조직 검사에서 골수성 육종이 확인되었고 앞서 기관지를 침범한 4예의 경우 모두에서도 진단을 위하여 기관지 내시경적 조직 검사를 시행하였다. 골수성 육종은 미성숙한 과립구들로 이루어져 있으며 골수성 분화 정도에 따라 광학 현미경상 관찰되는 종양의 형태가 달라진다. 대부분의 경우 면역 조직 화학 검사가 진단을 위해 필요하고 Myeloperoxidase가 골수성 분화 정도에 대한 지표로서 유용하게 사용된다[2,7,8]. Terminal deoxynucleotidyl transferase (TdT)의 경우 미성숙 림프구의 지표로 급성 림프구성 백혈병을 포함한 림프구성 종양들에서는 전형적으로 관찰되는 소견이나 본 증례처럼 급성 골수성 백혈병에서는 문헌에 따라 차이는 있지만 평균 18% 정도에서만 양성을 보인다[9]. 영상학적 검사의 경우 비특이적인 소견을 보이기 때문에 동반한 혈액 질환의 기왕력이 없다면 림프종이나 다른 고형 종양으로 오해하기 쉽다. 최근에는 골수성 육종의 조기 진단 및 전신의 잠재 병변에 대한 확인 그리고 치료 후 반응평가의 한 방법으로 FDG-PET이나 FDG-PET/CT를 사용하는 경우들이 보고되고 있다. 그러나 FDG 섭취 증가가 백혈병 침윤에 특이적인 것이 아니기 때문에 진단을 위한 조직 검사는 필수적이다[10].
아직까지 골수성 육종에 대해 정립된 치료 시기나 방법은 없으나 골수 침범이 없는 독립적으로 발생한 골수성 육종의 경우라 할지라도 단독 국소 치료 보다는 전신 항암치료를 기본으로 하며 필요시 국소 치료를 병행하는 것이 더 적절할 것으로 고려되고 있다. 왜냐하면 국소적으로 발생한 골수성 육종의 경우 전신적인 치료가 지연되거나 적절히 이루어지지 않을 경우 다수의 사례에서 급성 골수성 백혈병으로 진행하는 경과를 보였기 때문이다[8]. 그러나 전신적인 항암 치료에도 불구하고 골수성 육종의 예후는 불량한 편이다. 특히 조혈모세포 이식 이후 골수성 육종이 재발한 환자들을 대상으로 조사한 한 연구의 보고에 따르면 골수와 골수 외 재발이 동반되어 있는 경우 진단 후 6개월 생존율이 8%로 골수 외 재발만 있었던 경우나(69%) 골수에서의 재발만 있었던 경우(27%, p < 0.01)에 비해 매우 낮았다[10]. 본 증례의 환자도 내원 1개월 전 골수 검사상 재발이 있었고 입원 시 시행한 흉부 전산화 단층 촬영에서 기관지 병변 및 앞측 종격동의 종괴 소견으로 기관지 조직 검사를 시행하고 골수성 육종이 확인되어 골수 및 골수외 재발이 동반되어 있었다. 환자는 재 관해 유도 항암치료를 하였고 현재 재발 진단 후 6개월째 생존해 있다.