상염색체 우성 다낭신에서 발견된 무증상의 I형 담관낭종
Autosomal Dominant Polycystic Kidney Disease with an Asymptomatic Type I Choledochal Cyst
Article information
Abstract
상염색체 우성 다낭신은 가장 흔한 유전성 신질환의 하나로서 유병률이 인구 약 1,000명당 1명에 이르고 국내 혈액 투석 환자의 약 2%를 차지한다. ADPKD에서 신장 외 낭종은 간에서 가장 흔하게 나타나며 그 외 장기로 췌장, 비장 등에서도 발견되지만 담관낭종이 동반된 경우는 매우 드물다. ADPKD를 진단받고 외래 경과관찰 중이던 60세 여자 환자가 전신쇠약과 식욕 저하로 내원하였고 입원 후 실시한 복부 컴퓨터단층촬영 및 복부 자기공명 담췌관조영술에서 다낭신에 동반된 I형 담관낭종으로 진단되었다. 환자는 담석 혹은 담도염 등의 과거력이 전혀 없고 임상증세가 없으며 영상의학적 검사에서 외부 종괴에 의한 담관 압박 소견이 없이 전형적인 선천성의 담관낭종 형태를 보이고 있어 외과적 수술 등의 치료는 시행하지 않고 외래에서 경과관찰 중이다. 전신적 섬유 다낭종의 일환으로 볼 수 있는 다낭신과 담관낭종의 동반 발생에 대해서는 아직 발생 기전이 명확하게 밝혀지지 않았고 치료방법 또한 정립되어 있지 않다. 앞으로 두 질환의 유전적, 발생학적 상관관계 및 치료에 대한 연구가 필요할 것으로 생각한다.
Trans Abstract
Autosomal dominant polycystic kidney disease (ADPKD) is the most common inherited renal disease. Polycystic liver disease is commonly observed in ADPKD but rarely has it been associated with a choledochal cyst. We report a case of a choledochal cyst with ADPKD in a 60-year-old female patient with ADPKD and concomitant chronic renal failure who was admitted because of acute deterioration of kidney function due to poor oral intake. There was no history of a biliary disorder and her kidney function recovered promptly after fluid replacement. Non-enhanced computed tomography was performed to evaluate ADPKD and revealed numerous cysts in both kidneys and liver. It also showed fusiform dilatation of the extrahepatic bile ducts, a finding indicative of a choledochal cyst. Liver function was within the normal range and there was no evidence of extrahepatic biliary obstruction. Magnetic resonance cholangiopancreatography confirmed the diagnosis of a type I choledochal cyst combined with ADPKD. (Korean J Med 2013;85:205-209)
서 론
상염색체 우성 다낭신(autosomal dominant polycystic kidney disease, ADPKD)은 가장 흔한 유전성 신질환의 하나로서 유병률이 인구 약 1,000명당 1명에 이르고 국내 혈액 투석 환자의 약 2%를 차지한다[1]. ADPKD에서 신장 외 낭종은 간에서 가장 흔하게 나타나며 그 외 장기로 췌장, 비장 등에서도 발견된다. 그러나 실질 장기가 아닌 내장(hollow viscus)에서는 낭종 발생이 거의 보고되어 있지 않다. 간내 담관에서 발생하는 낭종과 관련된 낭종성 신장질환은 상염색체 열성다낭신(autosomal recessive polycystic kidney disease, ARPKD)이 있다. ARPKD는 간내 담관낭종과 간섬유화를 일으키는 유전질환인 Caroli 병과 연관성이 높은 것으로 밝혀져 있는 상태이다[2]. ARPKD에 비해 ADPKD는 담관낭종과의 관련성에 대한 보고가 없었으나 최근 ADPKD에서 Caroli 병이 발견되고 간외 담관낭종이 수예 보고되면서 ARPKD뿐만 아니라 ADPKD와 담관낭종과의 관련 가능성이 제기되었다[3]. 현재까지 국내에서는 ADPKD 환자에서 담관낭종이 동반된 증례는 1예만이 보고되어 있다[4].
저자들은 최근 간담도 질환의 과거력이 없는 ADPKD 환자에서 복부 전산화단층촬영과 복부 자기공명 담췌관조영술을 시행하여 무증상의 담관낭종을 진단하였기에 ADPKD와 담관낭종과의 관련성에 대한 문헌고찰과 함께 보고하는 바이다.
증 례
60세 여자 환자가 3일간의 전신쇠약과 식욕 저하로 내원하였다. 환자는 6년 전 타병원에서 복부초음파검사로 ADPKD를 진단받았고 당시 유전학적 검사는 시행하지 않았다. 이후 별다른 치료 없이 지내오다 4년 전에 대뇌 동맥류 결찰술을 했고, 9개월 전에 심방세동으로 고주파절제술을 했던 과거력이 있었다. 내원 3개월 전 외래에서 검사했던 혈청 크레아티닌 수치는 2.65 mg/dL로 MDRD GFR은 19 mL/min/1.73 m2이었으며 심부전증 치료제로 furosemide 40 mg, carvedilol 6.25 mg을 복용하고 있었다. 환자는 전신쇠약과 식욕저하로 체중이 2 kg 감소되었고 저혈압이 발생하여 입원하였다. ADPKD의 유전학적 검사는 이루어지지 않았으며 담관 결석, 췌장염 등의 간담도 및 췌장질환 과거력은 없었다. 가족 중에 어머니가 ADPKD를 진단을 받았으며 간담도 및 췌장질환 가족력은 확인되지 않았다. 내원 당시 활력징후는 혈압 100/60 mmHg, 맥박수 54회/분, 호흡수 20회/분, 체온 36.5℃였다. 구강점막은 건조했고 결막은 창백하게 보였다. 흉부 청진은 이상이 없었고 복부 검사에서 압통이나 반발통은 없었고 정상 장음이 청진되었으며 간비장종대는 없었고 양측 복부에 다낭신으로 의심되는 종괴가 촉지되었다. 검사실 소견은 일반혈액 검사에서 백혈구 6,010/mm3, 혈색소 7.2 g/dL, 혈소판 171,000/mm3였으며 혈액요소질소 72.3 mg/dL, 크레아티닌 5.04 mg/dL, AST 12 IU/L, ALT 8 IU/L, ALP 95 IU/L, 총 빌리루빈 0.76 mg/dL, 직접 빌리루빈 0.28 mg/dL, Na 138 mEq/L, K 4.2 mEq/L, Cl 101 mEq/L, 총 콜레스테롤 143 mg/dL, 아밀라제 128 IU/L였다. 철분 검사 결과 철 54 ug/dL, 총철결합능 131 ug/dL, 페리틴 694.5 ng/mL였다. 요 검사에서 특이 소견 없었고 24시간 요화학 검사에서 요단백양은 0.13 g/day였다. 종양표지자 검사에서 CA 19-9과 CEA는 각각 13.73 U/mL, 1.0 ng/mL로 정상 범위였다. 단순 흉부엑스선 촬영과 심전도에서 별다른 이상은 없었다.
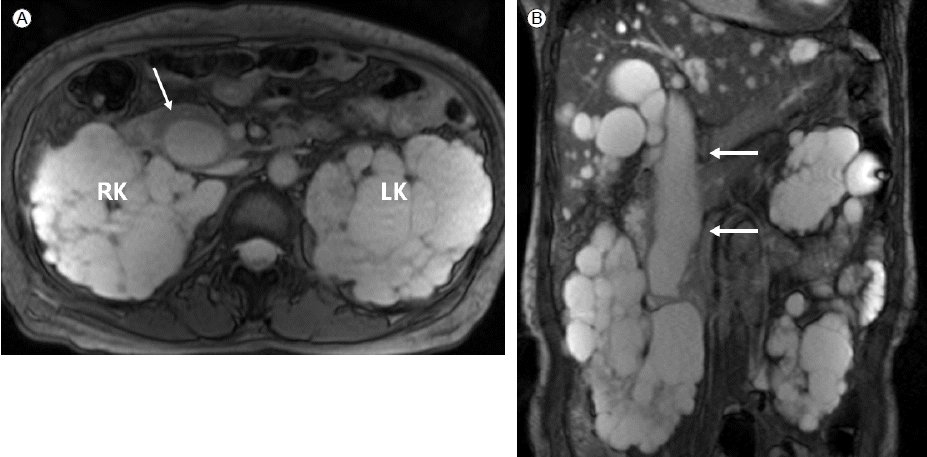
ADPKD에 의한 만성신부전증에 수분섭취 장애와 이뇨제 투여에 의한 혈장액 감소로 급성신부전증이 합병되었다고 판단하여 곧바로 이뇨제를 중단하고 수액주사를 시행하였고 신성 빈혈에 대한 치료로 조혈호르몬을 피하주사 하였다. 이후 환자 상태가 점차 안정되고 혈청 크레아티닌치도 기저치로 회복하였다. 환자는 본원에서 ADPKD에 대한 영상학적 검사를 한 차례도 받지 않은 상태여서 조영제를 사용하지 않은 복부 컴퓨터단층촬영을 시행하기로 하였다. 검사결과 양쪽 신장 및 전체 간에 걸쳐 다발성 저음영의 낭종 소견 보여 ADPKD에 합당한 소견을 보였으며 추가로 간내 담관과 총담관에 걸쳐 방추형의 확장이 관찰되었다(Fig. 1). 담관낭종 혹은 간 외 담관협착에 대한 감별진단을 위해 복부 자기공명 담췌관조영술을 시행하였고 간내 담관과 총담관에 걸쳐 방추형의 확장이 관찰되었으며 총담관 협착이나 유두부주위 종양은 관찰되지 않아 제1형 담관낭종으로 진단되었다(Fig. 2). 환자는 복부 통증 등의 임상증세가 없고 담관 폐색증을 시사하는 혈청학적 검사 소견이 없었고 자기공명검사에서 담낭액의 배출에 이상이 없어 외과적 수술 등의 치료는 하지 않기로 하고 퇴원하여 현재 외래에서 경과관찰 중이다.
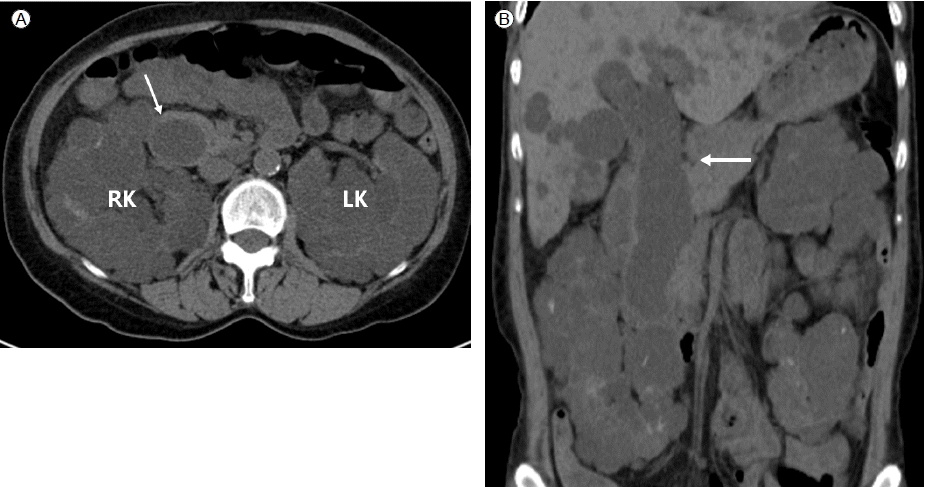
Pre-contrast computed tomography axial (A) and coronal (B) images reveal fusiform dilatation of the common bile duct (arrows) and multiple kidney cysts in the right (RK) and left (LK) kidneys.
고 찰
ADPKD는 양측 미만성 낭성 신장이 특징적인 유전적인 전신성 낭종질환으로 현재까지 알려진 가장 흔한 유전병 중 하나이다. 임상경과는 보통 30세 이전에 신낭종들이 생기고 40대 후반에 신기능이 감소하기 시작하여 50대 후반에 말기 신부전에 이르는 경과를 밟는다. ADPKD는 신장뿐만 아니라, 간, 뇌혈관, 심장 등 여러 장기를 침범하는 전신적 질환으로[5] 본 증례와 같이 ADPKD에 동반하는 담관낭종은 매우 드문 것으로 알려져 있다. ARPKD 환자에서는 Caroli 병 등의 담관낭종이 동반된 증례가 다소 보고되어 있으나 본 증례와 같이 ADPKD 환자에서 담관낭종이 동반된 경우는 표 1에 요약한 바와 같이 세계적으로도 매우 드물어 수예만 이 보고되어 있고[3,6] 국내에서는 1예만이 보고되어 있을 뿐이다[4].
담관낭종은 간내 또는 간외 담도의 낭포성 확장을 보이는 질환으로 병인론에 있어서는 선천적, 후천적 또는 선천적 기형이 후천적 질환을 유발시키는지는 아직도 논란의 대상이 되고 있다. 선천적 병인으로는 원시 담관 발생 도중 담도가 완전히 연결되기 전에 상피세포 증식의 불균형이 발생하게 되고 담관의 형성증식이 더 많은 근위부는 비정상적으로 넓어지고, 상대적으로 원위부는 좁아진 상태에서 담관낭종을 형성하는 것으로 알려지고 있다[2]. 후천적 병인으로는 췌관과 담관 사이의 비정상적인 관계로 인하여 췌관의 정상 압력보다 높은 압력에 담관이 노출되기 때문에 총수담관 내로 췌액의 역류를 초래하여 담관낭종이 형성된다[7]. 담관낭종과 감별진단이 필요한 질환 중 단순 총수담관 확장은 영상학적 검사를 통해 진단하게 되는데, 총수담관 확장의 경우 간내담관 확장도 동반되어 나타나는 경우가 대부분이고 총수담관 확장 부위 하방에 2차적인 원인 병변이 있을 가능성이 높다. 이번 증례의 경우 간내 담관 확장이 없고 2차적인 원인 병변이 없으며 혈청학적 검사에서도 담관 폐색의 증거가 없으므로 담관낭종으로 진단하는 것이 합당할 것으로 보인다.
다낭신과 담관낭종이 동반되는 발생 기전에 대해서는 아직 알려진 것은 없다. V형 담관낭종의 경우 Caroli 병에서와 같은 전신적 섬유 다낭종 질환의 발생과 관련되어 ARPKD 환자에서 종종 보고되고 있고 최근 ARPKD 환자에서 간외 담도의 확장 소견이 관찰되는 것에 대한 유전자 이상에 대한 연구가 보고되고 있다[8]. 드문 경우지만 ADPKD에서 관찰된 Caroli 병에 대한 유전자 이상에 대한 연구도 보고된 바 있다[9]. 이번 증례의 경우 복부 컴퓨터단층촬영이나 복부 자기공명 담췌관조영술에서 비정상 췌담관 접합이 관찰되지 않았고 아밀라제 역시 정상 범위로 확인되어 담관 폐색증을 시사하는 혈청학적 검사 소견이 없었으며 담관 협착의 과거력 또한 없었기 때문에 비정상 췌담관 접합에 의한 것이 아니라 발생 시 담관 상피세포 증식의 불균형과 같은 선천적 요인에 의해 담관낭종이 형성되었거나 우연히 두 질환이 함께 발생하였을 것으로 추정된다[10].
담관낭종은 담관 협착, 담석 형성, 담관염 등의 합병증이 발생할 수 있고 악성화의 위험도가 높은 것으로 알려져 있어서 수술적으로 제거하는 것이 좋다고 알려져 있다. 하지만 이번 증례와 같이 다낭신에 동반된 담관낭종의 경우 수술적 절제는 아직 논의의 여지가 있다. Kim 등[4]이 발표한 증례에서는 환자가 복통을 호소하였고 합병증 발생 가능성을 고려하여 담관낭종에 대해 수술을 시행하였으며 수술 중 총담관내 종양이 발견되어 동결절편 생검을 실시한 결과 선암종 소견이 보여 유문 보존 췌-십이지장문합술과 담낭절제술을 시행하였다. Hasegawa 등[3]이 발표한 증례에서는 비정상 췌담관 접합이 완전히 배제되지 않았기 때문에 담낭절제술, 담관낭종 절제술, 간소장문합술을 시행했고 수술할 때 담석이나 종양은 관찰되지 않았으며 수술 중 시행한 담관조영술에서 비정상 췌담관 접합은 관찰되지 않았다. 만약 비정상 췌담관 접합이 완전히 배제된다면 장기적인 추적관찰을 하는 것도 좋은 선택방안이 될 수 있다고 기술하고 있다. 이번 증례의 경우 환자는 복부통증 등의 임상 증세가 없고 담관 폐색의 검사실 소견이 없어 외과적 수술 등의 치료는 시행하지 않고 외래에서 합병증 발생 여부에 대해 경과관찰 중이다.
결론적으로 ADPKD 환자에서 담관낭종이 동반된 경우는 세계적으로도 매우 드물어 수예만이 보고되어 있고 치료에 대해서도 확실히 정립되지 않았다. 향후 ADPKD와 담관낭종의 연관성에 대한 유전학적, 발생학적 연구 및 치료 방법에 대한 연구가 필요할 것으로 사료된다.