수술 전후 항혈소판제제의 관리
Management of Perioperative Antiplatelet Therapy
Article information
Trans Abstract
Drug-eluting stent (DES) implatation was the major method of coronary revascularization and marked reduction in target-lesion revascularization. Stent thrombosis (ST) is a severe complication that is associated with a high incidence of acute myocardial infarction and death. To prevent ST, dual antiplatelet therapy (DAPT) with aspirin and clopidogrel is recommended for at least 12 months. The premature discontinuation of DAPT is the single most significant predictor of perioperative ST. The risk of surgical bleeding is increased approximately 20% by aspirin or clopidogrel alone, and 50% by DAPT. But the increased risk of perioperative bleeding is not necessarily associated with increased mortality or surgical outcome. Usually, the risk of a cardiovascular event when stopping antiplatelet agents preoperatively is higher than the risk of surgical bleeding when continuing these drugs, except during high risk surgery in a closed space. We remember that DES are never low risk situation for ST and aspirin must never be stopped in all patients with DES. (Korean J Med 2013;85:22-28)
서 론
약물용출 스텐트를 이용한 관상동맥 중재시술은 관상동맥 질환의 가장 중요한 치료법이 되었다. 반면 약물용출 스텐트 시술은 일반 금속 스텐트에 비해 재협착률 및 표적 병변 재시술률을 의미 있게 감소시켰지만 후기 스텐트 혈전증이라는 생명을 위협하는 치명적인 합병증이 중요한 문제로 대두되었다[1,2]. 스텐트 혈전증 예방의 가장 중요한 방법은 아스피린(aspirin)과 클로피도그렐(clopidogrel)을 함께 사용하는 이제 항혈소판제(dual antiplatelet therapy) 치료이며 이는 시술 후 최소 1년 동안 유지해야 하는 것으로 권고되고 있다[3]. 스텐트 시술을 받은 환자 중 약 5%는 1년 이내에 비심장 수술을 요하며 수술 전후 항혈소판제 중단으로 인한 스텐트 혈전증이 약 40%까지 발생할 수 있다는 보고가 있다[4]. 스텐트 시술 후 스텐트 혈전증 예방을 위해서는 항혈소판제치료는 필수적이나 수술 중 항혈소판제 치료가 출혈의 위험을 증가시킬 수 있기 때문에 수술 전에 중단해야 하는 딜레마가 있다. 이에 본 장에서는 스텐트 혈전증 위험성과 출혈 위험성을 평가하고 수술 전후 항혈소판제제 사용에 대해 간략하게 알아보고자 한다.
본 론
이제 항혈소판제 치료
혈전증 발생의 시작은 혈소판 유착, 혈소판 활성화 및 혈소판 응집에서부터 시작한다. 따라서 혈전증 예방의 가장 기본적인 치료는 혈소판 활성화 및 응집을 억제하는 항혈소판제 치료이다. 관상동맥 스텐트 삽입술 후 아스피린과 클로피도그렐을 함께 사용하는 이제 항혈소판제 치료는 스텐트 혈전증 예방을 위한 가장 필수적인 치료이다. 아스피린은 혈소판의 cyclo-oxygenase를 비가역적으로 억제하여 thromboxan A2의 형성을 차단함으로써 혈소판 활성화를 억제하고 thienopyridine계열의 클로피도그렐은 혈소판 P2Y12 수용체를 비가역적으로 억제하여 혈소판 활성화 및 응집을 억제하는 약제이다. 최근에는 클로피도그렐보다 더 강력한 효과를 갖지만 출혈 위험이 약간 더 높은 프라수그렐(prasugrel)과 티카그렐러(ticagrelor)가 새롭게 개발되어 사용되고 있다[3].
스텐트 혈전증 발생은 아스피린 단독 사용(3.5%)에 비해 이제 항혈소판제 사용(0.5%) 시 의미 있게 감소되어 이제 항혈소판제 사용은 스텐트 시술 후 표준 치료가 되었다[3]. 일반적인 이제 항혈소파제 치료 원칙은 아스피린은 평생 동안 사용하고 클로피도그렐은 일반 금속 스텐트를 시술 받은 경우에는 최소 1개월 이상 사용하고 가능하면 1년 동안 유지하며 약물용출 스텐트를 시술받은 환자는 최소 1년 동안 반드시 사용할 것을 권장하고 있다[3]. 약물용출 스텐트 시술 1년 이후에 이제 항혈소판제 유지하는 것이 사망률이나 심근경색증 발생을 줄인다는 보고도 있는 반면 1년 이후에 아스피린만 유지해도 그 효과는 지속된다는 보고도 있어 1년 이후에 이제 항혈소판제 사용에 대한 논란은 아직 남아 있다[5,6]. 그러나 일반적으로 좌주간동맥 병변, 근위부 병변, 분지혈관 병변, 만성 폐쇄병변, 석회화 병변, 작은 혈관 병변, 다혈관 질환, 여러 개 스텐트 시술, 중복 스텐트 시술 및 당뇨병, 만성 신부전 환자 등 고위험 환자군에서는 1년 이후에도 더 오랫동안 사용할 것을 권장하고 있다[3].
스텐트 혈전증 발생
스텐트 혈전증은 대부분 급성 심근경색증(22-90%)으로 발현되며 10-45%의 높은 사망률을 보이는 치명적인 합병증이다[7]. 스텐트 혈전증은 이제 항혈소판제를 사용하여도 장기적으로는 약 2%에서 발생할 수 있으며 특히 1세대 약물용출 스텐트를 삽입한 환자의 경우에는 매년 0.4-0.6%씩 발생하는 것으로 보고되고 있다[2]. 최근에 개발되어 널리 이용되고 있는 2세대 약물용출 스텐트는 1세대에 비해 스텐트 혈전증을 의미 있게 감소시켰지만 아직까지 스텐트 혈전증으로부터 자유롭지는 못한 상태이다[8].
스텐트 혈전증은 발생 시기에 따라 급성(acute, 24시간 이내), 아급성(subacute, 1-30일), 후기(late, 1-12개월) 및 아주 후기(very late, 1년 이후)로 구분하며 스텐트 시술 후 30일 이내에 발생하는 초기 스텐트 혈전증이 전체 발생의 60-75%를 차지하는 것으로 알려져 있다. 스텐트 혈전증 발생 기전은 시기에 따라 차이가 있다. 초기 스텐트 혈전증은 시술과 관련된 원인이 가장 많고 1개월 이후에 발생하는 후기 스텐트 혈전증은 스텐트 시술 부위의 불완전한 재내피화로 대표되는 지연된 치유가 주된 원인이며 1년 이후에 발생하는 아주 후기 스텐트 혈전증은 스텐트나 폴리머에 대한 과민반응, 섬유소의 과다 축적 및 신생죽상경화증 등의 비정상적인 혈관 반응이 주된 원인이 되는 것으로 알려져 있다[9]. 후기 스텐트 혈전증의 발생은 시술 부위의 지연된 치유 및 비정상 혈관 반응이 주된 원인이기 때문에 항혈소판제의 조기 중단은 가장 강력한 스텐트 혈전증의 유발인자이며[10] 이제 항혈 소판제의 조기 중단 시 스텐트 혈전증 발생이 90배 이상 증가하는 것으로 알려져 있다[7]. 스텐트 혈전증은 생명을 위협하는 치명적인 합병증이기 때문에 반드시 예방해야 할 합병증이며 항혈소판제 치료를 적극 고려해야 한다.
수술과 관련된 스텐트 혈전증 발생(Fig. 1)
수술과 관련되어 발생할 수 있는 스텐트 혈전증 발생은 항혈소판제의 갑작스런 중단, 수술 자체 및 수술 시기가 중요하게 관여한다. 장기적으로 사용했던 환자에서 항혈소판제의 갑작스런 중단은 혈소판 반응 및 반동효과 증가로 혈전증 발생을 증가시킬 수 있다[11,12]. 수술 자체는 수술 스트레스에 대한 내분비적 반응으로 혈관 경련 같은 혈관 반응도 증가, 혈소판 활성화, 혈장 내 응고인자 증가, 생리적인 혈전 용해 감소 등 수술 자체가 혈전 생성 상황을 초래할 수 있으며 수술에 대한 이런 반응은 이제 항혈소판제 치료로도 예방할 수 없는 강력한 위험인자이다[12,13]. 스텐트 삽입술 후 초기에는 협착 병변이 불안정하기 때문에 스텐트 삽입 후 초기에 비심장 수술을 시행하는 것은 환자의 사망률과 이환율을 5-10배 정도 증가시킬 수 있으며[14], 6주 이내 비심장 수술은 사망률을 증가시킬 수 있음이 보고되었다[15]. 또한 일반 금속 스텐트 삽입 환자의 경우 30일 이내 수술 시 주요 심혈관 사건 발생률이 30일 이후에 수술한 환자보다 10배 이상 높고 약물용출 스텐트 삽입 환자의 경우 1년 이내 수술이 1년 이후 수술에 비해 역시 2배 이상 높다는 보고가 있다[16].
수술에 의한 스텐트 혈전증의 발생의 가장 중요한 기전은 항혈소판제의 갑작스런 중단과 수술 자체에 의한 강력한 혈전증 성향 및 염증 반응 증가가 상승적으로 작용하여 불완전하게 재내피화된 스텐트에 혈전이 발생하는 것으로 설명할 수 있다(Fig. 1) [12]. 결국 수술과 관련된 스텐트 혈전증 발생을 줄이기 위해서는 수술 자체가 혈전 형성에 중요하게 관여하기 때문에 항혈소판제 중단은 반드시 피해야 하며 약물용출 스텐트를 삽입한 환자에서 수술 시기는 응급수술이 아닌 경우 1년 이후로 연기할 것을 권장하고 있다.
수술 중 항혈소판제 치료에 따른 출혈 위험성
수술 중 출혈의 원인은 항혈소판제 사용과 수술 자체에 의한 출혈이다. 아스피린 단독 사용에 비해 이제 항혈소판제 사용 시 출혈 위험이 증가하는 것은 당연한 사실이다. 이제 항혈소판제 사용은 아스피린 단독 사용에 비해 출혈 시간을 3-4배 증가시키고 출혈을 30-50%까지 증가시키는 것으로 알려져 있다[17,18]. 이에 비해 아스피린 단독 사용은 출혈의 위험을 2.5-20%까지 약간 증가시키지만 환자의 사망률이나 이환율은 증가시키지 않는 것으로 알려져 있다[11,18]. 결국 비심장 수술 시 출혈은 경한 합병증이며 심각한 사건은 스텐트 혈전증으로 인해 심장으로부터 발생하기 때문에 아스피린 단독 요법은 모든 수술 환자에서 실시해야 한다고 권장하고 있다.
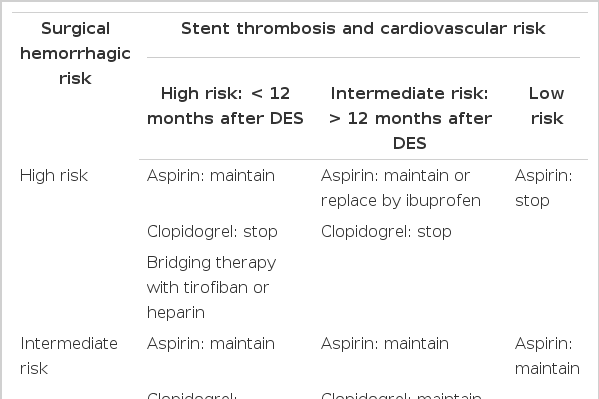
출혈에 따른 수술 위험도 계층화(Table 1)
여러 연구 결과를 토대로 출혈에 따른 수술 위험도를 계층화하였다[12,18-20]. 고위험 수술은 폐쇄된 공간에서 소량의 출혈만 있어도 심각한 결과를 초래할 수 있는 두개 내 수술, 척주관 수술 및 후안방 수술 등이 포함된다. 중등도 위험수술은 수혈을 가끔 필요로 하는 수술로 내장 수술, 심혈관 수술, 중요한 정형외과, 이비인후과, 성형외과 수술, 그리고 내시경적 비뇨기과 수술이 해당된다. 저위험도 수술은 정상적으로 수혈이 필요치 않는 수술로 내시경, 발치 및 치과수술, 말초 수술, 성형수술, 간단한 정형외과 및 이비인후과 수술, 조직 검사, 전안방 수술 등이 해당된다. 최근 항혈소판제 중단 여부에 대해 가장 많이 의뢰되고 있는 내시경과 발치 및 치과수술은 저위험 수술에 해당하기 때문에 약물용출 스텐트를 시술받은 환자는 아스피린과 클로피도그렐을 지속적으로 투여해야 한다.
스텐트 혈전증의 위험도 계층화(Table 1)
많은 연구 결과를 토대로 스텐트 혈전증 발생의 위험도를 계층화하였다[12,18-20]. 스텐트 혈전증 발생의 고위험 환자는 12개월 이내에 약물용출 스텐트 시술을 받은 환자, 6주 이내에 심근경색증, 일반 금속 스텐트 시술, 풍선확장 성형술 및 관상동맥 우회로술을 받은 환자 등이 포함된다. 중등도 위험 환자는 약물용출 스텐트 시술 받고 12개월이 지난 환자, 6-24주 사이에 심근경색증, 일반 금속 스텐트 시술, 풍선확장 성형술 및 관상동맥 우회로술 등을 받은 환자, 좌주간동맥 병변, 근위부 병변, 분지혈관 병변, 만성 폐쇄병변, 석회화 병변, 작은 혈관 병변, 다혈관 질환 병변, 여러 개 스텐트 시술, 중복 스텐트 시술 등 고위험 병변에 스텐트 시술을 받은 환자, 좌심실 구혈률이 낮은 환자, 당뇨병 혹은 만성 신부전 환자 등이 포함된다. 저위험 환자는 심근경색증, 일반 금속 스텐트 시술, 풍선확장 성형술 및 관상동맥 우회로술 등을 받고 6개월이 지난 환자들이 포함된다. 결국 약물용출 스텐트를 시술받은 환자 중 1년이 지나지 않은 환자는 모두 스텐트 혈전증 발생의 고위험 환자이며 1년이 지난 환자는 중등도 위험 환자로 약물용출 스텐트를 시술받은 모든 환자는 절대 저위험 환자가 아님을 반드시 기억하고 항혈소판제치료를 지속해야 한다.
출혈 위험도와 스텐트 혈전증 위험도에 따른 항혈소판제 치료 방법(Table 2) [12,18-20]
아스피린은 약물용출 스텐트를 시술받은 모든 환자에 수술과 상관없이 반드시 투여해야 한다. 약물용출 스텐트를 시술받고 1년이 지난 환자가 두개 내, 척주관 및 후안방 수술 같은 고위험 수술을 받는 경우에는 아스피린을 유지하거나 필요시 아스피린을 ibuprofen으로 대체하여 사용할 수 있다. Ibuprofen은 cyclo-oxygenase-1을 선택적으로 차단하는 비스테로이드성 항염증 약물로 아스피린과는 달리 가역적으로 차단하기 때문에 중단 후 24시간 이내에 혈소판 기능이 완전히 회복되는 점을 이용하여 고위험 수술 환자에서 아스피린을 대신하여 사용할 수 있다[21]. 수술 전 아스피린 200 mg을 투여받고 있는 환자는 아스피린 100 mg으로 감량하고 항혈소판제 단독요법으로 클로피도그렐을 사용하고 있는 환자는 아스피린으로 바꾸어 투여할 수 있다. 결국 아스피린은 약물용출 스텐트를 시술받은 모든 환자에서 수술 및 출혈 위험도와 상관없이 지속적으로 투여해야 한다.
클로피도그렐은 출혈에 대한 고위험 수술을 받는 환자에서는 반드시 중단해야 한다. 그리고 클로피도그렐은 약물용출 스텐트를 시술받고 1년이 지나지 않은 환자는 반드시 투여하고 1년이 지난 환자에서는 투여하고 있다면 지속적으로 유지할 수 있으며 필요 시 일시적으로 중단할 수 있다. 수술과 스텐트 혈전증 모두에서 고위험 환자인 경우는 아스피린은 유지하면서 클로피도그렐은 중단하고 대신 헤파린(heparin)이나 티로피반(tirofiban)을 연결치료(bridging therapy)로 유지하면서 수술할 것을 권장하고 있다[18-20]. 헤파린이나 티로피반의 연결치료는 클로피도그렐 중단 후 2-4일 이내에 시작하여 수술 전 4-8시간 전에 중단하고 수술하는 치료법이나[22,23], 현재까지 연결치료를 안전하게 권장할 만큼 충분한 증거는 없는 상태이다. 헤파린은 혈액응고 체계에서 트롬빈(thrombin)의 기능을 차단하여 혈액응고를 억제하는 항트롬 빈제로 항혈소판제가 아니기 때문에 기본적으로 혈소판 활성화 및 응집에 의해 발생하는 스텐트 혈전증 예방에 이상적인 약제는 아니며 오히려 사망률을 증가시킬 수 있다는 보고도 있다[24]. 티로피반은 혈소판의 당단백 IIb/IIIa 수용체를 차단하여 혈소판 응집을 신속하고 강력하게 억제하는 주사제로 반감기가 짧아 중단 후 2-4시간 후에 혈소판 기능이 회복되기 때문에 고위험 수술 환자에서 연결치료로 이용될 수 있으나 출혈 증가 가능성은 항시 고려해야 한다[23]. 당단백 IIb/IIIa 수용체 차단제 중 abciximab은 반감기가 길기 때문에 연결치료로 절대 사용해서는 안 된다.
아스피린이나 클로피도그렐의 중단 시간은 가능한 최소화해야 한다. 아스피린은 수술 2-5일 전, 클로피도그렐은 5일 전, 티카그렐러는 5일 전, 프라수그렐은 7일 전에 중단하는 것을 권장하고 있다[20]. 또한 수술 후 다시 투여 시작은 가능한 12-24시간 이내에 빠르게 해야 하며 부하용량(loading dose)으로 아스피린은 250 mg, 클로피도그렐은 300-600 mg, 프라수그렐은 60 mg, 티카그렐러는 180 mg을 투여 후에 치료를 시작할 것을 권장하고 있다[24].
수술 전후 항혈소판제 치료 시 기억해야 할 사항
약물용출 스텐트를 시술받은 환자에서 스텐트 혈전증은 대부분 심근경색증으로 발현되며, 사망률이 10-45%에 달하는 치명적인 합병증이다.
수술 자체는 혈전증 발생을 촉진하며 수술을 이유로 항혈소판제 중단 시 서로의 상승작용으로 스텐트 혈전증 발생이 20-40%까지 급증할 수 있다.
수술 중 항혈소판제 사용은 출혈을 증가시킬 수 있으나 출혈이 수술의 결과나 사망률을 증가시키지 않는다.
약물용출 스텐트를 시술받고 1년이 지나지 않은 환자는 모두 스텐트 혈전증 발생의 고위험 환자이며 1년이 지난 환자는 중등도 위험 환자로 약물용출 스텐트를 시술받은 모든 환자는 스텐트 혈전증 발생에서 절대 저위험 환자가 아니다.
약물용출 스텐트를 시술받은 모든 환자는 수술 종류에 상관없이 반드시 아스피린을 유지해야 한다.
약물용출 스텐트를 시술받고 1년이 지나지 않은 환자는 두개 내, 척주관 및 후안방 수술처럼 폐쇄된 공간에 소량의 출혈로도 중대한 영향을 미치는 고위험 수술을 제외한 모든 수술 시 클로피도그렐을 투여해야 한다.
약물용출 스텐트를 시술받고 1년이 지난 환자는 클로피도그렐 투여를 일시 중단할 수 있다.
응급을 요하지 않는 대기 수술은 약물용출 스텐트 시술 1년 이후로 연기하는 것이 안전할 수 있다.
약물용출 스텐트를 시술받은 환자에서 비심장 수술 시 출혈은 경한 합병증이며 심각한 사건은 스텐트 혈전증으로 인해 심장에서 발생하기 때문에 가능한 항혈소판제를 지속적으로 치료해야 한다.
결 론
약물용출 스텐트를 시술받은 환자가 수술을 해야하는 경우 항혈소판제 치료 지속 여부에 대해 많은 논란이 있다. 약물용출 스텐트를 시술받은 환자는 스텐트 혈전증 발생 시 대부분 급성 심근경색증으로 발현하고 사망률이 높기 때문에 스텐트 혈전증 예방을 위해 반드시 이제 항혈소판제를 사용한다. 또한 항혈소판제를 유지하면서 수술하는 경우 출혈의 위험이 증가하는 것 역시 사실이다. 그러나 수술 중 출혈 증가는 수술 결과 및 사망률과 직접 관련이 없기 때문에 수술 중 지속적인 항혈소판제 치료를 권장하고 있다. 약물용출 스텐트를 시술받은 환자는 두개 내, 척주관 및 후안방 수술 등 고 위험 수술을 제외한 모든 수술 시 가능한 이제 항혈소판제를 유지해야 한다. 특히 항혈소판제 중단의 가장 많은 원인이 되고 있는 내시경이나 발치를 위해 항혈소판제를 중단하는 경우는 절대 없어야 하겠다.