젊은 성인의 정상신에서 발생한 유암종
A Carcinoid Tumor Arising from a Normal Kidney in a Young Man
Article information
Abstract
현재까지 우리나라에서는 본 증례를 포함해 아주 적은 수의 원발성 신유암종이 보고되었으며, 치료 및 임상적 특성 예후에 대해 아직 밝혀지지 않은 부분이 많으므로 지속적인 증례 보고 및 연구가 필요할 것으로 생각된다.
Trans Abstract
Carcinoid tumors are low-grade malignant tumors arising from neuroendocrine cells. Primary renal carcinoid tumor is very rare due to the absence of neuroendocrine cells in the kidney and ureter. Therefore, little is known about the management and prognosis of renal carcinoid. Here, we report a case of a primary renal carcinoid tumor arising from a normal kidney in a 21-year-old man. He presented with a left renal mass, which was found accidentally. Abdominal computed tomography (CT) showed a 5.5 × 5.0-cm cystic mass with calcification. We suspected a cystic renal cell carcinoma and performed a laparoscopic radical nephrectomy. However, the histology revealed a well-differentiated neuroendocrine tumor. We concluded that it was a primary renal carcinoid tumor with no distant metastasis and did not administer chemotherapy or radiation therapy. He is recurrence-free after 8 months. (Korean J Med 2013;84:747-750)
서 론
정상적으로 신장 및 신우 요관에는 신경 내분비세포가 존재하지 않기 때문에 신장에서 발생한 원발성 신유암종은 전 세계적으로 약 70예 정도만 보고될 정도로 아주 드문 종양으로 알려져 있다. 국내에서도 2012년 현재까지 7예 정도만의 신유암종이 보고되었으며, 많은 경우는 마제신과 동반되거나 기형종과 동반된 신유암종이었다[1,2]. 저자들은 젊은 성인의 정상신에서 발생한 신유암종을 경험하였기에 문헌고찰과 함께 보고하고자 한다.
증 례
현병력: 23세 남자가 타 병원에서 건강 검진 중 시행한 신장 초음파에서 우연히 발견된 좌측 신장의 종괴로 본원에 내원하였다. 옆구리 통증이나 복통은 없었으며, 설사나 안면 홍조 등의 소견은 관찰되지 않았다.
과거력: 특별한 과거력이나 가족력은 없었다.
진찰 소견 및 검사실 소견: 문진과 이학적 검사 및 검사실 소견에서 특이 이상은 없었다. 일반혈액검사, 혈액화학 검사는 정상이었으며 소변 검사에서도 혈뇨는 관찰되지 않았다.
방사선 소견: 복부 컴퓨터단층촬영에서 왼쪽 신장에서 약 5.5 × 5.0 cm 크기의 주변부위 석회화와 부분적으로 낭종성 변화를 동반한 종괴가 확인되었다(Fig. 1).
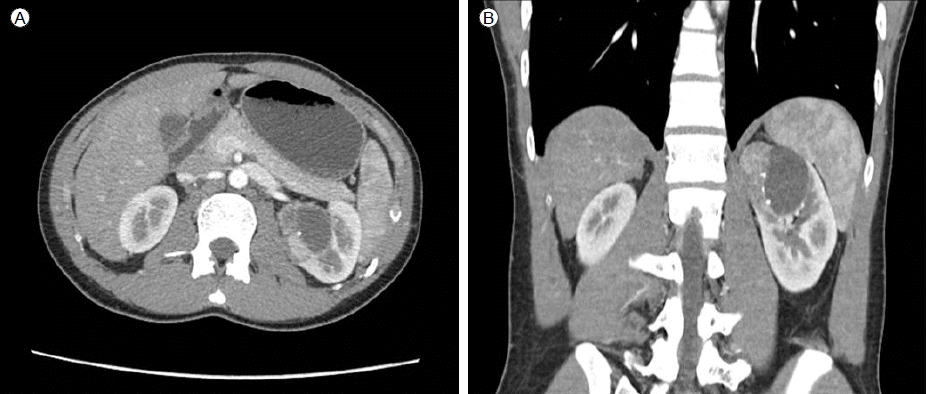
Enhanced abdominal CT with axial (A) and coronal images (B) showed a left cystic renal mass with calcification.
치료 및 경과: 수술 전 방사선 소견상 신세포암을 의심하였고, 복강경을 통한 왼쪽 신장 광범위절제술을 시행하였다. 종양의 육안적 소견은 5.5 × 5.0 cm 크기로 신문 주변에 위치하고 있었고, 피막에 둘려 싸여진 종괴는 주변과 경계가 명확하였으며 부분적으로 낭성변화를 보이고 절반가량은 연황색의 고형종괴 형태였다. 주위 임파선종대나 혈관 등에 다른 특이소견은 없었으며 종양주변의 신장은 정상신의 소견을 보였다(Fig. 2).

The bisected kidney revealed a well-demarcated, wellencapsulated multi-lobulated tumor. This partly cystic, partly solid tumor was confined to the renal parenchyma. The cut surface of the solid part of the tumor was yellow-tan.
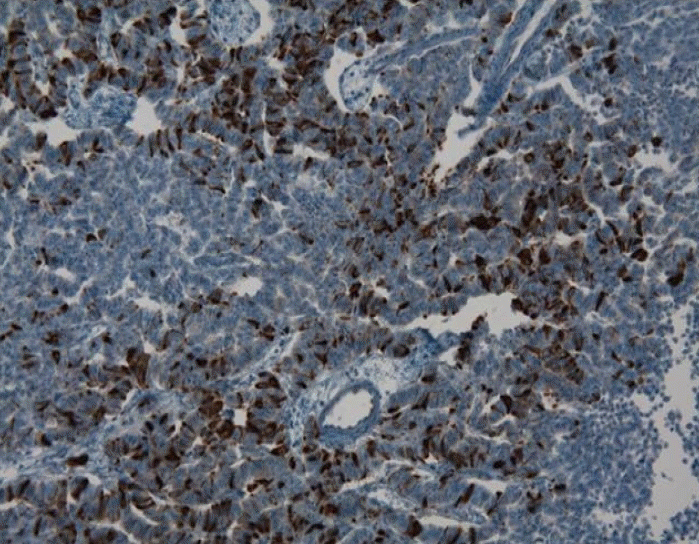
조직학적으로 종양은 둥근 핵과 과립성 세포질을 가진 작고 균일한 입방형의 종양세포가 모여 기둥모양을 이루거나 군집을 만들어 크고 작은 섬의 형태를 보여 잘 분화된 신경내분비종양(neuroendocrine tumor)으로 확진되었다(Fig. 3). 종양의 일부에서 석회화와 뼈 형성을 보였으나 괴사는 없었다. 유사분열은 1/10 high-power fields (HPF) (× 400)로 드물게 관찰되었으며 혈관 내 종양 색전이 관찰되었다. 종양은 신장피막을 침범하고 아주 국소적으로 신장주변 연부조직으로의 침범이 보였으나 신우, 제로타근막(Gerota’s facia)이나 부신으로의 침범은 관찰되지 않았다. 면역염색에서 Chromogranin과 CD56에 양성을 보여 종양의 근원이 신경내분비 세포임을 확인할 수 있었다(Fig. 4). 원발성 신유암종은 매우 드물기 때문에 유암종이 다른 곳에서 전이되지 않았는지 확인하기 위해 흉부 컴퓨터단층촬영을 하였으며, 신장을 제외한 부위에서 암종은 관찰되지 않았기 때문에 신장에서 발생한 전이가 없는 원발성 신유암종으로 진단하였다. 그리고 종양이 완전 절제되었기 때문에 추가적인 항암 치료나 방사선 치료는 시행하지 않았다. 현재 수술 후 8개월 경과하였으며 복부 컴퓨터 단층 검사 및 I-131 MIBG Scan 검사에서 재발 등의 소견 없이 외래에서 추적관찰 중이다.
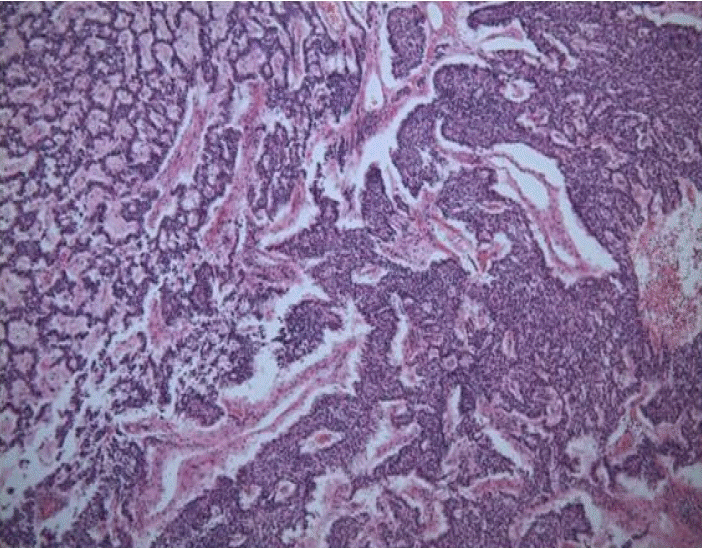
Microscopically, small round, uniform tumor cells formed trabecular, glandular, variable sized cell nests. Infrequent mitosis (1/10 HPF) was seen (HE, × 100).
고 찰
원발성 신유암종은 1966년 Resnick 등에 의해 처음 보고된 이후 전 세계적으로 약 70예 정도만 보고될 정도로 매우 드물게 발생하는 신생물이다[3,4]. 이러한 이유로 원발성 신유암종의 치료 및 임상양상, 예후 등에 대해서는 아직 알려지지 않은 부분이 많다. Shurtleff 등[5]은 신유암종 43예를 종합하여 보고하였는데, 평균발생 연령은 50세, 연령별 분포는 23-79세로 광범위하였으며, 성별 분포의 차이는 없었다. 정상 신장과 비교하여 마제신에서의 유암종의 발생은 약 62-82배 정도의 높은 빈도를 보이는 것으로 알려져 있는데, 11예(25%)는 마제신에서 발생하였고, 5예(11.4%)는 기형종으로부터 발생하였으며, 1예에서는 다낭성 낭종질환에서 발생하였다.
복통 혹은 측복통, 혈뇨 등이 절반의 환자에서 관찰되는 흔한 증상이었으며 15% 미만에서 피부 홍조, 설사 등의 유암종 증후군과 같은 증상을 호소하였다. 본 증례의 경우처럼 20% 정도에서는 무증상으로 발견되는 경우도 있었다[5]. 대부분의 경우, 유암종 증후군의 증상이 없으며, 수술 후 신유암종으로 진단되는 경우가 많기 때문에 시행되어지지 않는 경우가 많으나, 소변에서 serotonin의 대사산물인 5-Hydroxyindoleacetic acid (5-HIAA)를 측정하는 것이 진단에 도움을 줄 수 있다. 그리고 컴퓨터단층촬영에서 보이는 신유암종의 특징은 다양하며, 주로 고형 종괴를 보이고 낭성변화를 보이거나 중심성 또는 주변부의 석회화를 동반할 수 있으며 흔히 섬유성 피막을 가지는 경우가 많다. 하지만 이러한 소견들은 신세포암에도 관찰될 수 있으므로 컴퓨터단층촬영을 통한 감별은 어려운 경우가 많다. 그러므로 대개의 경우 신세포암으로 진단하고 수술 후의 병리적 소견으로 확진하게 되는 경우가 대부분이었다.
신유암종의 예후는 평균 27.6개월의 관찰기간 동안에 4예(9%)의 사망이 발생하였고, 10예(23%)에서 진단 당시 또는 관찰 기간 동안에 전이가 관찰되어 전체적인 예후는 신장에서 가장 흔히 발생하는 신장세포암보다 양호한 것으로 생각된다[5]. 그리고 정상 신장에서 발생하는 유암종과 비교하여 마제신에서 발생하는 유암종은 더욱 양성적인 임상경과를 나타낸다고 보고하였다[6,7]. 여러 증례를 종합하여 분석한 보고에 따르면 원발성 신유암종의 예후에 영향을 미치는 요소로 종양의 크기(4 cm 이상), 나이(40세 이상), 고형종물, 1/10 HPF 이상의 유사분열, 진단 시 전이가 있는 경우에서 예후가 나쁜 것으로 나타났다[8]. 또한 신유암종의 진단과 치료에서 유의할 점은 원발성 신유암종의 낮은 발생 빈도를 고려할 때 신장에서 유암종이 발견되었을 경우 신장 이외의 다른 원발 부위가 있을 가능성에 대해 평가하는 것이 중요할 것으로 생각한다.
국내에서 보고된 신유암종이 비교적 나이가 많고 특히 마제신과 다낭신 등의 비정상적인 형태의 신장에서 주로 발생한 점과 비교하여 볼 때, 본 증례에서는 무증상의 젊은 환자의 정상 신장에서 발생한 원발성 신유암종을 왼쪽 신장 광범위절제술을 통해 치료하였다. 그리고 종괴가 완전 절제되었고, 젊은 나이, 진단 당시 전이가 없는 상태임을 고려할 때 비교적 양호한 예후가 예상되지만 신장피막의 침범, 정상 신장에서 발생, 4 cm 이상의 크기 등을 고려할 때 지속적인 주의 깊은 추적관찰이 필요할 것으로 생각한다.