고용량 셀레늄 투여가 전신 염증 반응 증후군에 미치는 영향: 예비 보고
Effect of Intravenous High-Dose Selenium Supplementation in Patients with Systemic Inflammatory Response Syndrome: A Pilot Study
Article information
Abstract
목적:
전신염증반응증후군과 패혈증에 빠지면 과도한 산화성 스트레스가 발생한다. 고용량 셀레늄 정맥내 투여가 인체의 염증 조절 작용을 보완하여 일부 전신염증반응증후군 및 패혈증 환자의 예후에 영향을 미친다는 보고가 있어 본 연구에서는 전신염증반응증후군 환자에게 고용량 셀레늄을 정맥내 투여할 경우의 효과에 대해 알아보고자 하였다.
방법:
대상 환자들은 무작위로 셀레늄군 또는 대조군으로 분류하였고, 셀레늄군에 1주일간 매일 셀레늄 800 μg을 30분에 걸쳐 정맥내 일시주사하였고, 대조군에는 생리 식염수를 주사하였다. 급성기 반응물질과 질환 중증도지표가 호전되는 속도를 비교하기 위하여 진찰 및 혈액 검사를 시행하였다.
결과:
2010년 3월부터 2011년 8월까지 경증 전신염증반응증후군 환자와 중등증 전신염증반응증후군 환자 23명이 등록되었다. 셀레늄군의 혈청 셀레늄 농도는 시험 0일 9.95 μg/dL에서 시험 7일 18.15 μg/dL로 유의하게 호전되었으나(p = 0.005), 대조군의 혈청 셀레늄 농도는 시험 0일에 비해 시험 7일에 유의한 변화가 없었다(p = 1.000). 백혈구 수와 SOFA 점수는 셀레늄군에서 시험 0일에 비하여 시험 7일과 시험 14일에 유의한 호전을 보였으나 대조군에서는 시험 7일과 시험 14일 모두 유의한 호전이 없었다. 혈청 CRP 수치는 셀레늄군에서 시험 0일에 비하여 시험 7일과 시험 14일에 유의하게 호전을 보였으나 대조군에서는 시험 7일에는 유의한 호전이 없었고, 시험 14일에 유의한 호전을 보였다. APACHEII (Acute Physiology and Chronic Health Evaluation II) 점수는 셀레늄군과 대조군 모두에서 시험 0일에 비하여 시험 7일과 시험 14일에 유의한 호전을 보였다. 셀레늄 투여와 연관된 특별한 부작용은 관찰되지 않았다.
결론:
경증 전신염증반응증후군 환자와 중등증 전신염증반응증후군 환자에 고용량 셀레늄 정맥내 일시주사는 일부 급성기 반응물질 및 질환중증도지표를 호전키는 효과가 있다. 그러나 본 연구는 대상자의 수가 적고, 이중 눈가림 방법이 사용되지 않아 편견의 가능성이 있으며, 투약의 효과지표로 급성기 반응물질과 질환중증도지표만을 모니터하였고, 7일 사망률, 28일 사망률 등 예후지표를 보지 않았다는 한계점이 있어 향후 대규모 연구의 필요성을 환기시키는 점에 그 의의가 있다고 판단된다.
Trans Abstract
Background/Aims:
Systemic inflammatory response syndrome (SIRS) can induce occurrence of oxidative stress. Several reportshave evaluated selenium supplementation in SIRS patients with encouraging results. Therefore, we evaluated the effect ofintravenous high-dose selenium supplementation in patients with SIRS.
Methods:
Patients were randomly assigned to one of two groups: the selenium group (800 μg/day of selenoic acid by intravenousbolus injection for 7 days) or the placebo group. Physical and biochemical measurements were used to assay acute phase reactants,severity of illness index and serum selenium concentration.
Results:
A total of 23 patients classified as mild-to-moderate severity of illness index were enrolled between March 2010 andOctober 2011. Serum selenium concentration increased in the selenium group after intervention, but there was no significant changein the placebo group. In the selenium group, the white blood cell (WBC) count, serum level of c-reactive protein (CRP), AcutePhysiology and Chronic Health Evaluation II (APACHEII) score and Sequential Organ Failure Assessment (SOFA) scoreimproved significantly by days 7 and 14 compared with day 0. In the placebo group, only the serum CRP level at day 14 andAPACHE II score at days 7 and 14 improved significantly compared to day 0.
Conclusions:
Intravenous supplementation with high-dose selenium improved acute phase reactants and the severity of illnessindex in patients with SIRS. However, larger prospective clinical trials are required to determine the efficacy of seleniumsupplementation in SIRS patients. (Korean J Med 2013;84:531-540)
서 론
패혈증과 전신염증반응증후군은 중환자실 환자의 주된 사망 원인으로 항생제 및 수액 요법의 발전에도 불구하고 이환율과 사망률이 크게 감소하지 않는 경향을 보인다[1-3]. 전신염증반응증후군이 발생하면 여러 전염증성 사이토카인의 과다 생성과 비정상적 면역 체계 활성화로 인하여 활성산소종이 대량으로 합성, 분비되어 조직 손상을 유발한다[4,5].
인체 내에는 활성산소종으로부터 조직 손상을 보호하는 다양한 형태의 항산화 기전이 존재하며, 셀레늄은 이 항산화 기전에 중요한 물질 중 하나이다. 셀레늄은 바닷물과 토양 속에 미량으로 존재하는 미네랄로 인체 내에서는 주로 selenoprotein P (Se-P) (60%), glutathione peroxidase (GPx-3) (30%)의 형태로 존재하고 일부는 albumin과 결합(6-10%)하여 간, 신장, 심장 그리고 비장 등에 분포되어 있다[6-12]. 전신염증반응증후군이 발생하면 셀레늄이 소모되어 혈청 농도가 감소하고 셀레늄 요구량이 증가한다[13-15]. 고용량 셀레늄을 투여하여 활성산소종을 중화하는 것이 환자의 예후를 호전시킨다는 연구 보고가 있으나, 적응증과 용량, 투여기간 등의 기준치는 확립된 바가 없다[12,16].
본 연구에서는 전신염증반응증후군 환자의 혈청 셀레늄 농도를 확인하고, 정맥내 고용량 셀레늄 투여가 혈청 셀레늄 농도, 급성기 반응물질과 질환 중증도지표에 주는 영향을 분석함으로서 고용량 셀레늄 보충의 의의를 확인하고자 한다.
대상 및 방법
대상
2010년 3월부터 2011년 8월까지 분당제생병원에 입원한 만 18세 이상 95세 미만의 환자들 중 전신염증반응증후군에 해당되고 본 연구에 자발적인 의사로 동의한 자를 대상으로 하였다. 전신염증반응증후군은 1992년 미국의 American College of Chest Physicians (ACCP)/Society of Critical Care Medicine (SCCM)의 정의[17]에 따라, 1) 체온 38℃ 초과 혹은 36℃ 미만 2) 심박수 분당 90회 초과 3) 호흡수 분당 20회 초과 혹은 동맥혈 이산화탄소 분압 32 mmHg 미만 4) 백혈구 수 12,000/mm3 초과 혹은 4,000/mm3 미만 혹은 띠(band) 형태의 백혈구 수 10% 초과 중 2개 이상을 충족할 때로 정의하였다. 임상 시험에 참여한 이후 7일 이내에 퇴원 또는 수술이 예정되어 있는 환자나 활력징후에 영향을 줄 수 있는 조절되지 않는 부정맥이 있는 환자 또는 임신부나 임신을 계획하고 있는 환자는 제외하였다. 대상 환자를 셀레늄군 및 대조군으로 배정하는 과정은 무작위로 하여 전향적으로 연구를 진행하였다. 셀레늄군 3명, 대조군 4명이 동의 철회 및 추적검사 실패로 중도 탈락하여 셀레늄군 12명 대조군 11명, 총 23명이 최종 분석 대상 환자가 되었다.
윤리적 고려
본 연구는 연구 대상의 윤리적 보호를 위하여 분당제생병원 기관생명윤리심의위원회(Institutional review board, IRB)의 승인하에 진행하였다. 연구 대상자에게 모집 시, 연구 목적 및 방법, 익명성 보장, 자발적 참여와 거부, 중도 포기 가능성, 발생할 수 있는 이익과 불이익 등에 대하여 구두와 서면을 통한 설명을 진행하고 동의서를 받았다.
방법
전신염증반응증후군 환자 중 셀레늄군으로 선정된 환자들에는 일주일간 매일 셀레늄 800 μg (셀레큐어주 400 μg, LG생명과학, 서울, 한국)을 0.9% 생리식염수 200 cc에 희석하여 1일 1회, 30분 동안 정맥내 일시주사 하였다. 대조군에는 같은 기간 동안 0.9% 생리 식염수 200 cc를 동일한 방법으로 투여하였다. 전신염증반응증후군의 원인이 감염인 환자에게는 적절한 항생제를 함께 투여하였다. 셀레늄 혹은 식염수 정맥 주사 전(시험 0일), 모든 연구 대상자들의 혈청 셀레늄 농도, 백혈구 수, 혈청 CRP 수치, APACHE II 점수, SOFA 점수를 평가하였다. 시험 개시 후 7일, 14일에 혈청 셀레늄 농도를 제외한 위 항목에 대한 재평가를 시행하였고 혈청 셀레늄 농도는 시험 7일에만 측정하고, 시험 14일에는 측정하지 않았다. 혈청 셀레늄 농도는 말초혈액 6 mL을 SST-II tube에 채취하여 재단법인 네오딘 의학 연구소에서 원자흡수분광법을 사용하여 측정하였다.
셀레늄 투여의 효과는 셀레늄군과 대조군에서 각각 시험 7일과 시험 14일의 급성기 반응물질과 질환중증도지표를 시험 0일과 비교하여, 호전을 보이는 시점별 지표수에 따라 판정하였다. 급성기 반응 물질은 백혈구와 CRP (C-reactive protein)로서 각각의 혈중 수치와 농도를 측정하였다. 질환중증도지표는 APACHE II (Acute Physiology and Chronic Health Evaluation II) 점수와 SOFA (Sequential Organ Failure Assessment) 점수로 판정하였다.
통계 분석
자료는 중앙값과 최대, 최소값을 각각 산출하였으며, 연속 변수는 Mann-Whitney U test를 비연속 변수는 Fisher’s exact test를 이용하여 분석하였다. 각 집단에서 투여 전, 후의 혈청 셀레늄 농도, 급성기 반응물질, 질병 중증도의 변화는 Wilcoxon signed-rank test로 비교하였다. 통계학적 의의는 p 값이 0.05 미만일 때 유의한 것으로 간주하였다.
결 과
연구 대상 환자의 임상적 특징
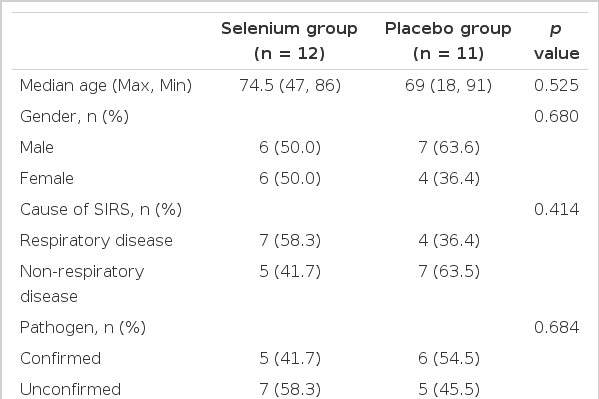
총 대상 환자 수는 23명으로 남자는 13명(56.5%), 여자는 10명(43.5%), 중앙 연령은 71.9세이었다. 셀레늄군은 12명(52.1%), 대조군은 11명(47.8%)이었고 중앙 연령은 각각 74.5세와 69세였으며(p = 0.525), 남녀 비는 각각 1:1과 1.75:1 (p = 0.680)로, 셀레늄군과 대조군 간에 유의한 차이가 없었다. SIRS의 원인은 전부 감염이었고, 호흡기계 감염과 비호흡기계 감염으로 분류하였으며 호흡기계 감염은 전부 폐렴이었고, 비호흡기계 감염은 담도염, 담낭염, 연부조직염, 도관감염, 요로감염이 있었다. 호흡기계 감염의 빈도는 셀레늄군에서 58.3%, 대조군에서 36.4%였고, 비호흡기계 감염의 빈도는 셀레늄군에서 41.7%, 대조군에서 63.5%로 유의한 차이가 없었다(p = 0.414, Table 1). 대상 환자에 동반된 만성 질환은 당뇨, 고혈압, 만성 폐쇄성 폐질환, 심부전, 신부전, 간질환, 종양 등이 있었고, 대상 환자를 세 가지 미만의 만성 질환을 동반한 경우와 세 가지 이상의 만성 질환을 동반한 경우로 분류하였다. 만성 질환이 세 가지 미만인 경우는 셀레늄군에서 75.0%, 대조군에서 72.7%였고 만성 질환이 세 가지 이상인 경우는 셀레늄군에서 25.0%, 대조군에서 27.3%로 유의한 차이가 없었다(p = 1.000, Tables 1 and 3). 원인균 및 적용한 항생제의 경우, 원인균이 동정되어 항생제 감수성이 확인된 경우와 원인균이 동정되지 않아 경험적 항생제를 사용한 경우로 분류하였다. 원인균이 동정된 경우는 셀레늄군에서 41.7%, 대조군에서 54.5%였고 원인균이 동정되지 않은 경우는 셀레늄군에서 58.3%, 대조군에서 45.5%로 두 군 간 기저 환자 특성에 유의한 차이는 없었다(p = 0.684, Table 2). 병원균이 동정된 경우, 모두 적용 중인 항생제에 적절한 감수성을 나타내었다. 대상 환자의 질환 중증도로 APACHE II 점수의 중앙값은 셀레늄군에서 15.5, 대조군에서 19 (p = 0.316), SOFA 점수의 중앙값은 셀레늄군에서 3, 대조군에서 4 (p = 0.379)로 두 군 간 기저 환자 특성에 유의한 차이는 없었고, 경증 전신염증반응증후군 환자와 중등증 전신염증반응증후군 환자가 대상이 되었다.
혈청 셀레늄 농도 변화
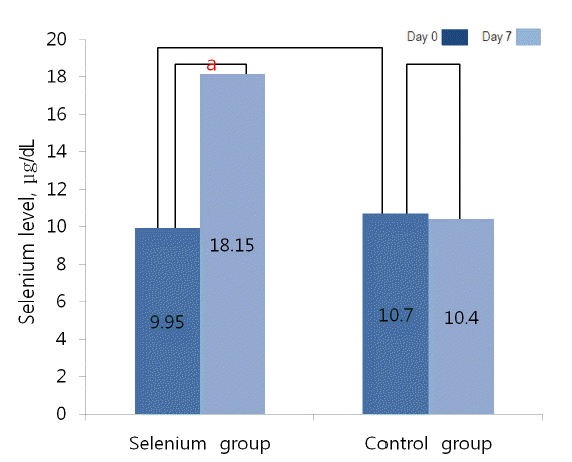
혈청 셀레늄 농도는 시험 0일 셀레늄군 9.95 μg/dL, 대조군 10.7 μg/dL로 두 군 간 의미 있는 차이는 없었다(p = 0.651). 시험 7일에 측정한 혈청 셀레늄 농도는 셀레늄군에서 18.15 μg/dL로 시험 0일 측정치와 비교하여 유의하게 증가하였으나(p = 0.005), 대조군에서는 10.4 μg/dL으로 시험 0일 측정치와 비교하여 유의한 변화가 없었다(p = 1.000) (Table 4, Fig. 1).
급성기 반응 물질 변화
백혈구 수는 시험 0일 셀레늄군 11,950/mm3, 대조군 8,300/mm3로 두 군 간 의미 있는 차이는 없었다(p = 0.1000). 시험 7일과 14일에 측정한 백혈구 수는 셀레늄군에서 각각 8,250/mm3 (p = 0.033), 9,050/mm3 (p = 0.011)로 시험 0일 백혈구 수에 비교하여 유의하게 호전되었으나, 대조군에서 각각 6,400/mm3 (p = 0.241), 6,350/mm3 (p = 0.333)로 시험 0일 백혈구 수에 비하여 유의한 변화가 없었다(Table 4, Fig. 2).
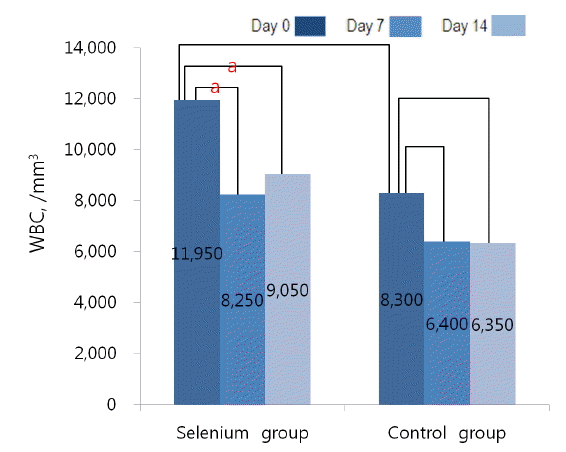
Changes in WBC concentration (/mm3) compared with baseline.
aStatistical significance was noticed (p = 0.05).
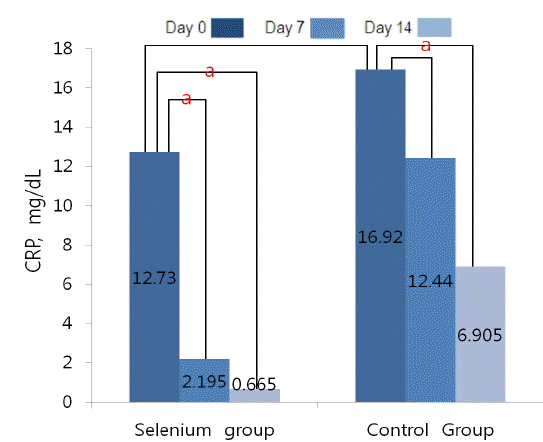
혈청 CRP 수치는 시험 0일 셀레늄군 12.73 mg/dL, 대조군 16.92 mg/dL로 두 군 간 의미 있는 차이는 없었다(p = 0.487). 시험 7일과 14일에 측정한 혈청 CRP 수치는 셀레늄군에서 각각 2.20 mg/dL (p = 0.003), 0.67 mg/dL (p = 0.002)로 시험 0일 혈청 CRP 수치에 비교하여 모두 유의하게 호전되었으나, 대조군에서는 각각 12.44 mg/dL (p = 0.062), 6.91 mg/dL (p = 0.013)로, 시험 0일 혈청 CRP 수치에 비하여 시험 7일에는 유의한 호전이 없었고, 시험 14일에 유의한 호전을 보였다(Table 4, Fig. 3).
질환 중증도 지표 변화
APACHEII 점수는 시험 0일 셀레늄군 15.5, 대조군 19.0로 두 군 간 의미 있는 차이는 없었다(p = 0.316). 시험 7일과 14일에 측정한 APACHEII 점수는 셀레늄군에서 각각 11 (p = 0.008), 10.05 (p = 0.011), 대조군에서 각각 17 (p = 0.024), 15.5 (p = 0.011)로, 셀레늄군, 대조군 모두에서 시험 0일 점수에 비하여 유의한 호전을 보였다(Table 4, Fig. 4).
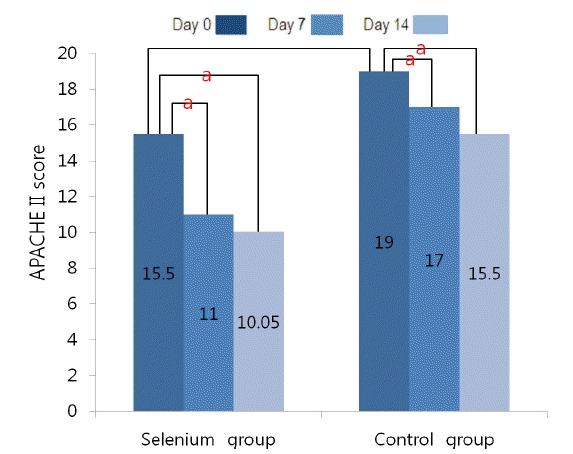
Changes in APACHE II score compared with baseline.
aStatistical significance was noticed (p = 0.05).
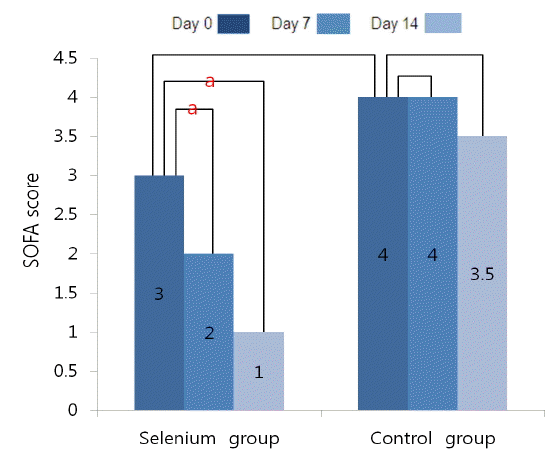
SOFA 점수는 시험 0일 셀레늄군 3, 대조군 4로 두 군 간 의미 있는 차이는 없었다(p = 0.379). 시험 7일과 14일에 측정한 SOFA 점수는 셀레늄군에서 각각 2 (p = 0.030), 1 (p = 0.024)로 시험 0일 점수에 비교하여 시험 7일과 14일에 모두 유의하게 호전되었다. 반면 대조군에서는 각각 4 (p = 0.129), 3.5 (p = 0.480)로 시험 0일 점수에 비하여 유의한 변화가 없었다(Table 4, Fig. 5).
이상 반응
셀레늄군에서 시험 기간 중 셀레늄 투여와 관련된 특별한 부작용은 관찰되지 않았다.
고 찰
셀레늄은 원소주기율표 16족에 속하는 반금속성을 띠는 물질로 1817년 Berzelius에 의해 처음 발견되었다. 셀레늄은 과다 섭취 후에 나타날 수 있는 독성 때문에 과거에는 기피 대상으로 알려졌지만, 1957년 K. Schwar 박사[18]가 쥐를 이용한 연구에서 셀레늄의 공급이 부족하면 간의 괴사를 야기시키는 것을 증명함으로써, 셀레늄이 생물의 대사에 매우 중요한 기능을 갖는 것이 알려지기 시작했다. 이후 셀레늄에 대한 광범위한 연구가 진행되어 셀레늄은 인체 내에서 산화 환원 반응, 갑상선 호르몬 조절, 염증 조절, 면역 증강 등 신진 대사에 중요한 작용을 하는 것이 알려졌다[19,20].
셀레늄은 아미노산인 셀레노시스테인으로 병합된 후, 인체 내에서 셀레노프로테인의 형태로 존재하며 항산화(anti-oxidant) 작용을 한다[21]. 현재까지 밝혀진 셀레노프로테인은 열 네 가지로, glutathione peroxidase, selenoprotein W, selenoprotein P, iodothyronine deiodinase 등이 있다[22]. 전신염증반응이 나타나면 산화스트레스가 증가하고 셀레늄이 소모되어 혈청 셀레늄 농도가 급격하게 감소하므로[13-15] 셀레늄을 보충하여 염증 조절 작용을 보완하려는 시도가 진행되어 왔다.
Angstwurm 등[23]은 전신염증반응증후군 환자 189명을 셀레늄군 92명과 대조군 97명으로 나누어, 셀레늄군에 시험 0일 셀레늄 1,000 μg을 일시주사하고 이어 14일간 매일 셀레늄 1,000 μg을 지속정맥주입 하였고, 대조군에는 같은 기간 매일 약 100 μg의 셀레늄을 정맥주입하였다. 연구 결과 APACHEIII 점수는 셀레늄군 대조군 모두에서 유의하게 호전되었으나, 혈청 셀레늄 농도 상승과 시험 시작 28일째 사망률 호전은 셀레늄군에서만 의미 있게 관찰되었다. Mishra 등[24]은 패혈증 환자 40명을 셀레늄군 18명과 대조군 22명으로 나누어, 셀레늄군에 sodium selenite 474 μg, 316 μg, 158 μg을 각각 3일씩 총 9일간 지속정맥주입하고 대조군에는 sodium selenite 31.6 μg을 매일 같은 기간 투여하였는데, 셀레늄군에서만 셀레늄 투여 이후 혈청 셀레늄 농도가 셀레늄 투여 전에 비하여 유의하게 상승하고, 시험 7일과 14일의 SOFA 점수가 유의하게 호전되었다.
본 연구에서는 셀레늄군에 셀레늄 800 μg을 7일간 매일 투여하였고 대조군에 생리식염수를 투여하였다. 연구 결과 셀레늄군에서는 혈청 셀레늄 농도가 셀레늄 투여 전에 비하여 셀레늄 투여 이후 유의하게 상승하였으나, 대조군에서는 혈청 셀레늄 농도가 시험 기간 전에 비하여 시험 기간 후에 유의한 변화가 없었다. APACHEII 점수는 셀레늄군과 대조군 모두 시험 기간 전에 비하여 시험 기간 후에 호전되었으나, SOFA 점수는 셀레늄군에서만 시험 기간 전에 비하여 시험 기간 후에 호전되어 상기 선행 연구와 일치 하는 결과를 보였다. 일부 문헌에서는 패혈쇼크 환자에게 하루 400 μg 이상의 고용량 셀레늄을 관례적으로 투여하도록 가이드라인을 제시하기도 한다[25-27].
한편, 고용량 셀레늄 정맥내 투여가 사망률과 질환 중증도 호전에 유의한 영향이 없다는 보고도 있다. Forceville 등[28]은 중증 패혈증 환자 60명을 셀레늄군 31명 대조군 29명으로 나누어, 셀레늄군에 시험 0일 셀레늄 4,000 μg을 지속정맥주입하고 이어 9일간 매일 셀레늄 1,000 μg을 지속정맥주입 하였고, 대조군에는 셀레늄을 투여하지 않았다. 연구 결과 셀레늄군과 대조군의 사망률, 승압제 적용 기간, 인공환기기 적용 기간에 유의한 차이가 없었다. Valenta 등[29]은 전신염증반응증후군 환자 150명을 셀레늄군 75명, 대조군 75명으로 나누어, 셀레늄군에 시험 0일 셀레늄 1,000 μg을 30분에 걸쳐 일시주사하고 이어 13일간 매일 셀레늄 500 μg을 일시주사하였고, 대조군에는 셀레늄 < 75 μg을 매일 같은 기간 투여하였다. 연구 결과 셀레늄군과 대조군의 사망률에 유의한 차이는 없었다.
셀레늄 보충이 급성기 반응물질과 질환 중증도에 영향을 미치는 기전에 대하여 살펴보면, cyclooxygenase pathway와 lipoxygenase pathway의 중간대사물인 과산화수소를 감소시켜 염증성 prostaglandins과 leukotrienes 생산을 억제하고, 인체 내 인지질과 지질의 과산화수소를 감소시킴으로써 과도한 활성산소종과 자유라디칼의 생산을 억제하여 세포손상을 최소화한다는 의견이 제시된 바 있으나, 아직 정확한 기전은 밝혀지지 않았다[23,30].
셀레늄을 일시정맥주사할 경우 지속정맥주입하는 경우에 비해 급격히 혈청 셀레늄 농도가 상승하고 셀레노프로테인으로 병합되기 전의 무기화합물 형태의 셀레늄이 셀레늄 투여 초기에 증가한다. 무기 화합물 형태의 셀레늄은 전구산화(pro-oxidant) 효과가 있어 nuclear factor kappa-B (NF-kB) 억제를 통해 전염증성 사이토카인의 합성을 억제하고, 이미 활성화된 전염증성 세포는 세포자멸사를 유도하며, 병원균에 대한 직접적인 살균 작용을 한다[31,32]. 셀레늄이 무기 화합물 형태에서 작용하는 전구산화 효과에 의한 항염증작용은 Wang 등[32]의 연구에서 명확히 관찰된다. 이 연구는 패혈증을 동반한 양을 세 군으로 나누어 셀레늄 일시정맥주사, 셀레늄 지속정맥주입, 식염수 주입을 각각 하였고, 그 결과 셀레늄 일시정맥주사군에서만 유의하게 혈압, 심장박출지수 등 혈역학적상태가 개선되었음이 보고된 바 있어, 본 시험에서는 셀레늄 투여 방법을 일시정맥주사로 하였다.
고용량 셀레늄 섭취와 연관된 독성 발현은 중국에서 보고된 바 있는데, 중국 후베이 성 언스 시 주민들이 조갑취약증, 모취약증, 소양감을 동반한 반점과 호기 시 마늘 냄새를 보였고, 역학 조사 결과 지역 토양의 고농도 셀레늄에 의한 셀레늄 중독증으로 판명되었다[33]. 세계보건기구에서는 건강한 성인을 대상으로 0.4 μg/kg/day의 셀레늄을 섭취하도록 권고하고 섭취 상한치를 400 μg/day로 제한하고 있으나[27] 전신염증반응증후군 환자에서 섭취 상한치를 초과하는 고용량 셀레늄투여와 연관된 특별한 부작용은 보고된 바 없다[34]. Angstwurm 등[23]이 전신염증반응증후군 환자에게 셀레늄 1,000 μg을 일시주사하고 14일간 매일 셀레늄 1,000 μg을 지속정맥주입 하였으나 고용량 셀레늄 주입과 관련한 부작용은 관찰되지 않았다. Manzanares 등[35] 또한 전신염증반응증후군 환자에게 셀레늄 2,000 μg을 일시 주사하고 이후 매일 1,600 μg을 10일간 지속정맥주입하였으나 역시 고용량 셀레늄 주입과 관련한 부작용은 관찰되지 않았다.
본 연구는 선행 연구들에 적용된 셀레늄 투여량보다 적은 용량인 800 μg/일을 7일간 투여하는 것으로 계획하여, 셀레늄 주입과 연관된 부작용의 가능성은 매우 낮을 것으로 예상하였고, 본 임상 시험 시행 완료 후 셀레늄 관련 부작용은 관찰되지 않았다.
한편 혈청 셀레늄 농도의 참고치로 Tietz [36]는 8-27.2 μg/dL를 제시하였으나, 지역별 토양의 셀레늄 함량의 차이에 따라 핀란드 5.7-10.8 μg/dL, 체코슬로바키아 7.2-8.1 μg/dL 등, 혈청 셀레늄 농도의 표준화된 참고치는 지역에 따라 편차가 크다. 국내에서는 Lee 등[37]이 건강한 20대 여성을 대상으로 혈청 셀레늄 농도 참고치로 10.29-14.49 μg/dL를 제시한 바 있다. 그러나 이 참고치는 제한된 연령 범위의 여성에 국한된 수치라는 면에서 한국인을 대표하는 참고치로 보기에는 무리가 있고, 국내 전 인구에 적용할 수 있는 표준화된 혈청 셀레늄 농도 참고치는 보고된 바 없다. 전신염증반응 환자의 체내 셀레늄이 소모되어 혈청 셀레늄 농도가 급격하게 감소한다는 연구 기존 결과들이 있으나[13-15] 본 연구의 시험 0일 셀레늄군의 셀레늄 농도 9.95 μg/dL와 대조군의 셀레늄 농도 10.07 μg/dL가 과연 표준화된 참고치보다 감소된 농도인지 여부를 판단할 수는 없다. 즉 국내 혈청 셀레늄 농도 참고치로 인정되는 범위는 아직 정립되지 않아 한국인의 표준화된 혈청 셀레늄 농도 참고치는 추가 연구가 필요하다.
본 연구 결과를 종합하면, 고용량 셀레늄 정맥내 투여는 혈청 셀레늄 농도를 상승시키고, 특별한 부작용 없이 경증 전신염증반응증후군 환자와 중등증 전신염증반응증후군 환자의 급성기 반응물질과 질환중증도지표를 일부 호전시키는 효과가 있다. 그러나 본 연구는 대상자의 수가 12, 11명으로 통계적으로 의미 있는 결론을 내기에 적은 숫자이고, 셀레늄군과 대조군 배정에 이중 눈가림 방법이 사용되지 않아 편견의 가능성이 있다. 또한 투약의 효과지표로 급성기 반응물질과 질환중증도지표만을 모니터하였고, 7일 사망률, 28일 사망률 등 예후지표를 보지 않았다. 즉 급성기 반응물질과 질환중증도지표의 호전이 질환의 예후 호전으로 직결되는지 여부는 알 수 없다. 그러므로 중증 전신염증반응증후군 환자를 포함한 다양한 중증도의 전신염증반응증후군 환자를 대상으로 한 큰 규모의 추가 연구가 반드시 필요하다. 전신염증반응증후군 환자에 대한 고용량 셀레늄 투여의 효과는 논란이 되고 있는 주제로 국내에서 처음으로 진행된 임상 연구이고 향후에 진행할 대규모 전향적 연구의 예비 보고로 그 의의가 있다고 판단되어 연구 결과를 보고하는 바이다.