특발성 간질성 폐렴의 영상의학적 접근
Radiologic Approach to the Idiopathic Interstitial Pneumonias
Article information
Trans Abstract
Idiopathic interstitial pneumonias (IIP), a heterogeneous group of diffuse parenchymal lung diseases, include seven clinicopathologic entities: idiopathic pulmonary fibrosis (IPF), nonspecific interstitial pneumonia (NSIP), cryptogenic organizing pneumonia (COP), acute interstitial pneumonia (AIP), respiratory bronchiolitis (RB)-associated interstitial lung disease (ILD), desquamative interstitial pneumonia (DIP), and lymphoid interstitial pneumonia (LIP). Each of these entities has a typical histologic pattern that correlates well with imaging features. Thus, imaging plays an essential role in classifying and differentiating this group of diseases. The characteristic HRCT findings of IPF are reticular opacity with honeycombing and traction bronchiectasis in a predominantly basal and peripheral distribution. NSIP manifests as basal ground-glass opacity and reticular opacity. Honeycombing is rare. COP is characterized by patchy peripheral or peribronchovascular consolidation. AIP appears as extensive, mixed ground-glass opacity and consolidation. RB-ILD and DIP are smoking-related diseases associated with CT features of poorly defined centrilobular nodules and ground-glass opacity. LIP is a rare disease characterized by ground-glass opacity sometimes associated with perivascular cysts. Although some of idiopathic interstitial pneumonias may show diagnostic CT features, the final diagnosis of IIPs is usually made by means of evaluation of all the combined clinical, radiologic, and pathologic findings. (Korean J Med 2013;84:489-497)
서 론
간질성 폐렴은 염증과 섬유화로 인한 폐 손상으로부터 발생하는 여러 종류의 다양한 질환들을 포함한 미만성 폐질환군을 지칭한다[1,2]. 폐손상의 주된 위치는 간질부위(interstitium)이며 인접한 구조물들, 즉 폐포, 기관지, 혈관들이 같이 영향을 받기도 한다. 간질성 폐렴은 폐손상 원인에 따라 특발성과 이차성 질환으로 구분할 수 있으며 이차성 질환에는 결합조직병, 감염, 진폐증, 약물손상 등이 포함된다[1].
특발성 간질성 폐렴(idiopathic interstitial pneumonia) 자체가 임상의들에게 알려진 지는 오래되었지만 그동안 이들 질환의 정확한 정의, 분류, 용어 등에 있어서는 학자들 간에 부분적으로 이견이 있어 왔다[3,4]. 이에 American Thoracic Society와 European Respiratory Society는 2002년에 임상적, 방사선학적, 조직학적인 특성을 기준으로 특발성 간질성 폐질환군에 속한 질환들을 분류하여 각각의 명칭과 전형적인 패턴을 규정한 바 있다[1]. 이 분류에 의하면 IIP는 발생 빈도순으로 특발성 폐섬유증, 비특이성 간질성폐렴, 특발성 경결성폐렴, 급성 간질성폐렴, 호흡세기관지염 간질성폐렴, 박리성 간질성폐렴, 림프구 간질성폐렴 등 7개의 질환으로 구분된다. 또한 이들 각 질환의 정확한 진단을 위해서는 임상적 소견, 방사선학적 소견, 조직병리학적 소견 등을 모두 종합하여 결정하는 것이 바람직한 것으로 알려져 있다[5].
이들 질환을 분류하는 데 우선적으로 기준이 되는 조직학적인 특성은 방사선학적으로 HRCT상 병변의 육안적인 형태와 일치되는 면이 많기 때문에 이들 질환의 형태적 특성, 분포, 범위, 시간적 변화 등을 보여주는 방사선학적 소견들은 IIP의 정확한 진단에 많은 도움을 줄 수 있다. 이 종설에서는 IIP에 속하는 7개의 간질성 폐렴별로 전형적인 방사선학적 소견들을 설명하고 이들 질환에 있어서 HRCT의 진단정확도와 감별점 등을 기술함으로써 특발성 간질성 폐렴의 진단에 있어서 HRCT의 역할과 유용성을 이해할 수 있도록 하고자 하였다.
특발성 폐섬유증
특발성 폐섬유증(idiopathic pulmonary fibrosis, IPF)은 만성 섬유화 간질성폐렴(chronic fibrosing interstitial pneumonia)의한 형태로 조직학적으로는 usual interstitial pneumonia (UIP)의 패턴을 보이는 원인불명의 폐질환이다[1]. IPF는 특발성 간질성폐렴 중 가장 흔히 보는 질환으로(50-60%) 임상적으로 50대 이상의 환자에서 수년에 걸쳐 천천히 악화되는 호흡곤란과 마른기침을 주소로 대부분 내원한다.
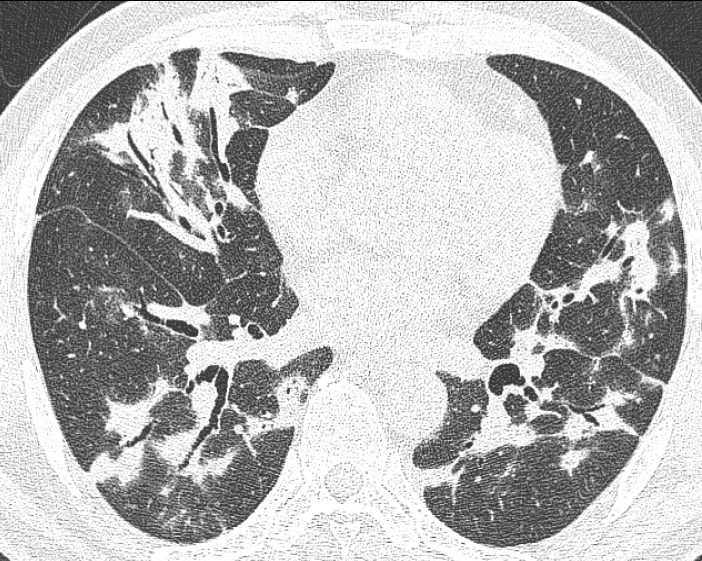
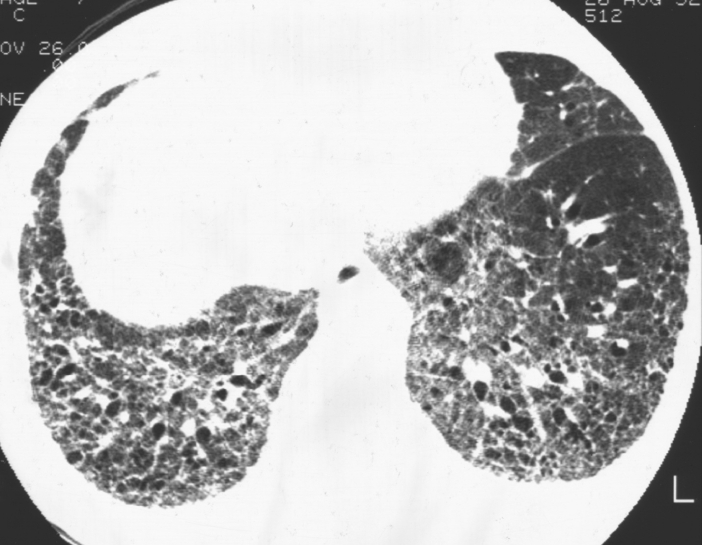
단순흉부방사선사진상 초기에는 정상으로 보일 수 있으며 병이 진행됨에 따라 양측폐, 특히 폐하부와 주변부에 불규칙한 망상음영(reticular opacity)가 나타나고 점차 폐상부 쪽으로 범위가 확장되면서 폐용적도 감소하게 된다[6]. HRCT에서는 불규칙한 폐섬유화로 인해 특징적인 소엽내 간질비후(intralobular interstitial thickening)가 주로 폐하부와 주변부에서 reticular pattern으로 보이게 된다(Fig. 1) [7]. 망상음영 내에는 견인성 세기관지확장(traction bronchiolectasis) 소견이 흔히 동반되어 볼 수 있으며 섬유화가 좀더 심해지면 견인성 기관지확장(traction bronchiectasis)이 또한 나타난다[8]. 섬유화가 진행된 많은 예에서는 벌집모양(honeycombing)이 주된 HRCT 소견으로 나타나며 이때는 폐실질의 구조적 왜곡이 상당부분 이루어진 상태로 볼 수 있다. 벌집공기낭(honeycomb cysts)는 대부분 크기가 2-20 mm 정도로 양측 폐하부와 폐주변부에서 흉막과 인접해서 여러 층으로 나타난다(Fig. 2) [9].

A 50-year-old man with IPF. High-resolution CT shows reticular opacities with traction bronchiectasis in both basal lungs.

A 66-year-old man with IPF with progression over 4 years. (A) Initial HRCT image shows reticular opacities with mild honeycombing in periphery of both lower lobes. (B), (C), and (D). Follow-up HRCT images obtained 1 year, 3years, and 4 years later respectively show increase in extent of honeycombing and reticular opacities in both lower lobes.
젖빛유리음영(ground-glass opacity)이 HRCT에서 또한 보일 수 있으며 이는 조직학적으로 활성 염증(active inflammation)이나 CT 해상도 이하의 미세한 섬유화(fibrosis)에 의한 소견이다(Fig. 3) [10]. 따라서 HRCT상 젖빛유리음영 부위를 활성 과정의 병변으로 간주하기 위해서는 주변에 망상음영, 견인성 세기관지확장 및 기관지확장, 벌집모양 등의 섬유화 소견이 동반되지 않은 경우로 제한하여야 한다. 또 다른 주요한 소견은 앞에서 기술한 여러 가지 HRCT 소견들이 비균질 분포(heterogeneous distribution)을 보인다는 것이다[11]. 즉 정상, 활성 염증, 경증 혹은 중증의 섬유화 부위들이 서로 같은 폐, 같은 엽내에서 동시에 나타나는 것이 특징적이라 할 수 있다.
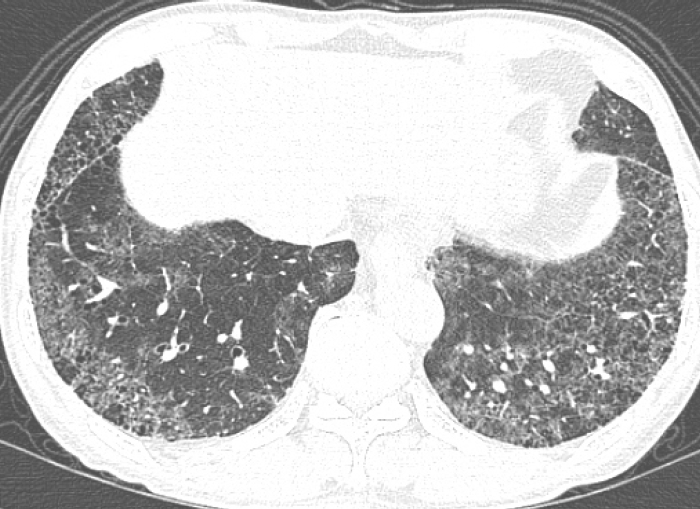
A 63-year-old man with IPF. HRCT image shows patchy ground-glass opacity with reticular opacity in both basal lungs.
IPF 환자의 추적검사 시에는 HRCT상 수개월에서 수년에 걸쳐 망상음영과 벌집모양 병변의 범위가 점진적으로 증가하는 것을 볼 수 있다(Fig. 2). 때로는 추적관찰하는 환자들 중 일부에서 특별한 원인 없이 임상적으로 급격한 악화를 보이는 경우가 있는데 이는 조직학적으로 미만성 폐포손상(diffuse alveolar damage) 혹은 급성 기질화폐렴(acute organizing pneumonia)을 동반한 폐의 급성손상과 관련된 것으로 알려져 있다. IPF의 급성 악화 시에는 HRCT상 기존의 망상음영과 벌집모양의 병변에 더하여 젖빛유리음영과 폐경화(pulmonary consolidation)의 소견이 미만성, 다국소성, 혹은 주변부 등의 분포로 나타나게 된다[12].
비특이성 간질성폐렴
비특이성 간질성폐렴(nonspecific interstitial pneumonia, NSIP)은 만성 간질성폐렴 환자의 14-35%를 차지하는 비교적 흔한 질환으로 조직학적으로 폐포벽에 염증과 혹은 섬유화로 인한 비후를 보이며 UIP와 달리 상대적으로 이러한 병변들이 시간적 공간적으로 균질성(homogeneity)을 보이는 것이 특징이다[13]. 발병 시 환자들의 연령은 다양하지만 보통 40-50대에서 많이 보이며 증상은 UIP 환자와 같이 수개월에서 수년에 걸친 호흡곤란과 기침을 주소로 내원한다.
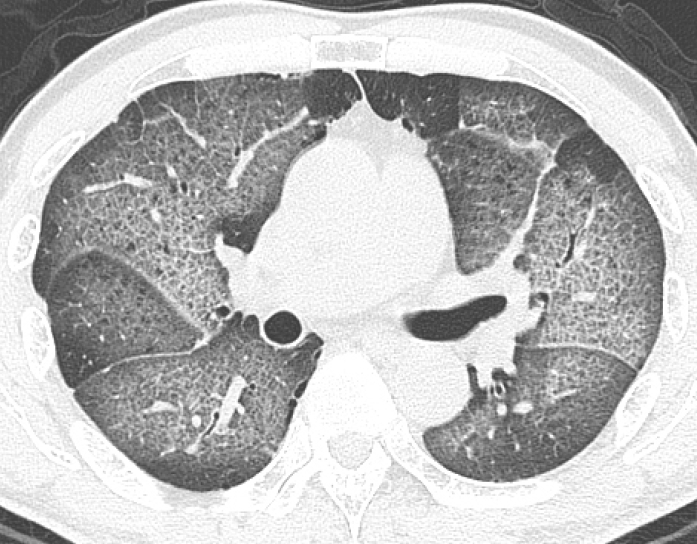
단순흉부방사선사진에서는 주로 양측폐 하부에 젖빛유리음영 혹은 폐경화 소견이 주로 보이며 이 외에도 망상음영이 같이 보이기도 한다[14]. HRCT에서는 폐하부 및 주변부에 분포하는 젖빛유리음영이 주된 소견이며 여기에 불규칙한 망상음영이 같이 동반되어 보이거나 아니 보일 수도 있다(Fig. 4) [15]. 망상음영이 동반될 때에는 견인성 기관지확장 및 세기관지확장 소견이 또한 흔히 볼 수 있다. 이외에 폐경화가 보일 수 있지만 흔하지 않은 소견이며, 벌집모양 소견은 환자의 5-30%에서 볼 수 있으며 UIP에 비해서 경한 정도로 나타나게 된다[15,16]. NSIP 환자에서 HRCT상 망상음영 없이 젖빛유리음영만이 보일 경우에는 조직학적으로 NSIP의 아형 중 하나인 cellular (inflammatory) NSIP에 해당하는 소견으로 볼 수 있다. 그렇지만 젖빛유리음영, 망상음영, 견인성 세기관지확장 등이 보이는 경우에는 cellular NSIP와 fibrotic NSIP를 구분하기가 어려우며, 벌집모양은 fibrotic NSIP 환자에서 주로 나타나는 소견이다(Fig. 5) [15,17].

A 59-year-old man with NSIP. HRCT image shows patchy ground-glass opacity in periphery of both lower lobes.
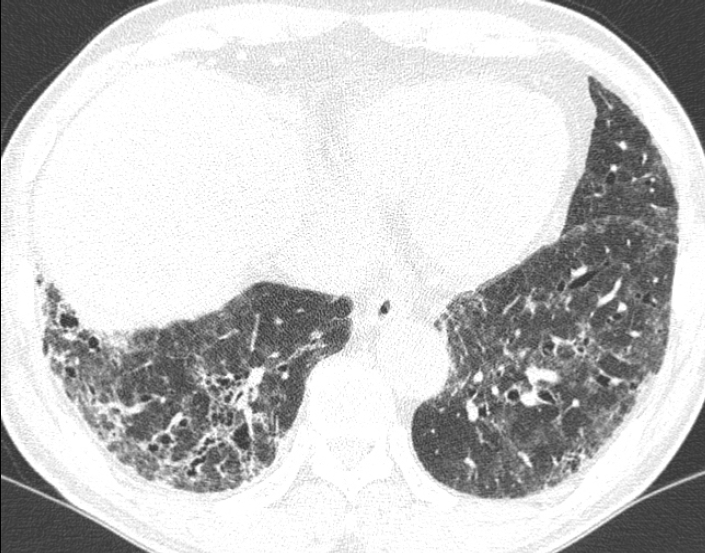
A 68-year-old man with fibrotic NSIP. HRCT image shows patchy ground-glass opacity with reticular opacity and traction bronchiectasis in both basal lungs.
NSIP 환자의 초기 HRCT상 젖빛유리음영이 주된 소견으로 보인 경우에는 치료 시 추적검사상 젖빛유리음영이 점차 호전을 보이며 섬유화 소견을 주로 보이는 환자에 비해 예후가 좋은 것으로 알려져 있다[18]. 또한 IPF 환자에서와 같이 NSIP 환자에서도 특별한 원인 없이 질환이 급성 악화를 보이는 경우가 있으며 이때는 HRCT상 기존의 소견 외에 광범위한 젖빛유리음영 혹은 폐경화가 동반되어 나타나게 된다.
특발성 기질화폐렴
특발성 기질화폐렴(cryptogenic organizing pneumonia, COP)은 조직학적으로 폐포관과 인접한 폐포내에 특징적인 육아조직 폴립이 존재하며 주변에는 만성간질성 염증이 동반되는 질환이다[1]. 환자들은 평균 50대의 연령분포를 보이며 보통은 수주간의 마른 기침을 주소로 내원하며 약간의 열과 호흡곤란을 동반하기도 한다.
단순흉부방사선사진에서는 비분절성(nonsegmental)의 일측 혹은 양측성 폐경화의 소견으로 흔히 나타나 폐렴과 유사한 소견을 보이게 된다[19]. 일부 환자에서는 결절모양의 음영으로 나타나기도 하며 폐용적은 대부분 유지되는 경향이 있다. HRCT에서 가장 흔히(~80%) 볼 수 있는 병변은 양측폐의 주변부 혹은 기관지 주변의 폐경화 소견이다(Figs. 6 and 7) [20,21]. 젖빛유리음영도 흔히(~60%) 볼 수 있는 소견으로 보통은 폐경화와 같이 동반하여 나타난다(Fig. 6). 폐소엽 주변에 아케이드 혹은 다각형 모양의 불명확한 선상음영으로 보이는 소엽주위 패턴(perilobular pattern)도 ~60%의 높은 빈도로 보이는 것으로 알려져 있다[22]. 이외에도 기관지벽 비후 및 기관지 확장, 결절 혹은 종괴 음영, 망상음영, 역달무리징후(reversed halo sign), 소량의 흉막삼출 등의 CT 소견들을 볼 수 있다. 추적검사 시 HRCT상 폐경화 음영을 주로 보인 환자에서는 치료 시 대부분 호전을 보이며 망상음영이 주로 보이는 경우에는 병변이 지속되거나 악화되는 경향이 있다[23].
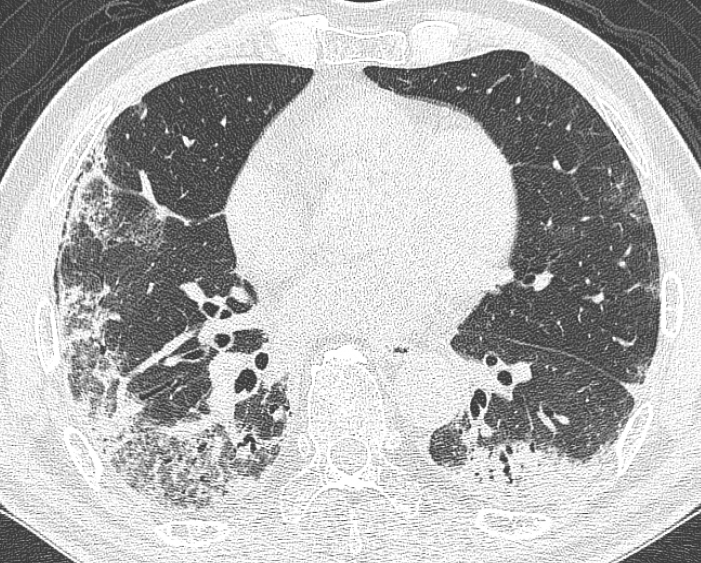
A 65-year-old man with COP. HRCT image shows patchy, bilateral consolidation and ground-glass opacity in periphery of both lungs.
급성 간질성폐렴
급성 간질성폐렴(acute interstitial pneumonia, AIP)은 다른 만성 간질성폐렴과 달리 1-3주 이내에 급격히 진행하는 원인불명의 심한 호흡곤란과 조직학적으로 미만성 폐포손상(diffuse alveolar damage, DAD)를 특징으로 하는 급성 질환이다[24]. 환자들은 다양한 연령대를 보이지만 평균 50-60대이며 이전에 건강하게 지내다가 급격하게 발생하는 심한 호흡곤란을 주소로 내원하게 되며 이후 호흡부전으로 진행하여 50% 이상의 사망률을 보이게 된다. 임상적, 조직학적으로 선행원인이 알려진 급성호흡곤란증후근(ARDS)와 구분이 되지 않으며 단지 원인불명에 의해 발생한 DAD 환자의 경우에 한하여 AIP로 진단하게 된다[25,26].
단순흉부방사선사진에서는 양측폐에 공기기관지조영상(air bronchogram)을 보이는 폐경결 음영이 폐의 일부에서 나타난 후 빠르게 진행되어 폐의 대부분을 차지할 정도로 광범위한 확산을 보이게 된다[27]. HRCT상에서는 양측폐에 광범위한 젖빛유리음영과 체위의존 부위(dependent area)에서 주로 보이는 폐경화 음영이 주된 소견이다(Fig. 8) [28]. 젖빛유리음영 내에는 소엽간(interlobular) 및 소엽내(intralobular) 선상음영이 겹쳐져 “crazy-paving” pattern이 나타나기도 한다(Fig. 9) [5]. 시간이 경과함에 따라 섬유화가 발생하게 되면 구조적 왜곡, 견인성 기관지확장, 흉막하 벌집모양이 나타날 수 있다. 이들 섬유화와 연관된 소견들은 비의존 부위(nondependent area)에서 좀더 심하게 보이며 이는 기계적 환기(mechanical ventilation)의 사용시 의존 부위는 무기폐와 폐경화로 인하여 기계적 환기에 의한 손상을 덜 받기 때문인 것으로 알려져 있다[29].
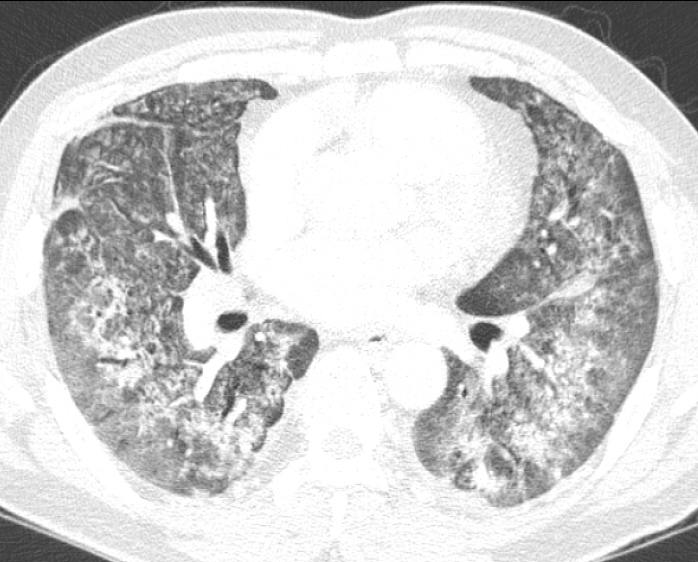
A 53-year-old man with AIP. HRCT shows diffuse ground-glass opacity and patchy consolidation in both lungs.
호흡세기관지염 간질성폐렴과 박리성 간질성폐렴
호흡세기관지염(respiratory bronchiolitis, RB), 호흡세기관지염 간질성폐렴(respiratory bronchiolitis-associated interstitial lung disease, RB-ILD), 그리고 박리성 간질성폐렴(desquamative interstitial pneumonia, DIP)은 흡연과 관련된 동종의 폐질환군에 속하면서 중증도가 서로 다른 질환들로 볼 수 있다[30]. RB는 특별한 증상이 없는 흡연자들에게서 우연히 발견되는 조직학적 이상 소견을 지칭한다. RB를 보이는 흡연자들 중 소수에서는 간질성 폐질환과 유사한 임상소견을 보이는 경우가 있으며 이러한 예들은 RB-ILD 환자로 분류한다[31]. DIP는 RB-ILD 스펙트럼의 한쪽 끝부분에 해당하는 질환으로 RB-ILD와 임상적, 방사선학적, 조직학적으로 많은 공통점을 보이면서 중증도에 있어서 차이를 보이는 간질성 폐질환이다[32]. DIP는 일부에서 비흡연자에서도 발생이 되며 이들은 폐감염, 분진노출, 약물반응 등과 관련이 있는 것으로 알려져 있다[33]. RB-ILD는 조직학적으로 색소 대식세포(pigmented macrophage)들이 호흡세기관지 및 인접한 폐포 내에 국소적으로 축적되는 소견이 특징이다. DIP는 RB-ILD보다 더 심하고 광범위하게 색소 대식세포들이 폐포 공간을 채우고 있는 것이 특징적이며 폐간질에서는 경증의 섬유화와 염증 소견을 볼 수 있다[34].
단순흉부방사선사진상 RB-ILD는 정상으로 보이거나, 기관지벽 비후 혹은 망상음영 등이 관찰된다. DIP에서는 양측폐 하부에 젖빛유리음영이 보이는 경우가 많으며 일부에서는 정상으로 보일 수도 있다. RB-ILD 환자의 HRCT에서는 경계가 불명확한 중심소엽성 결절(poorly defined centrilobular nodules), 부분적인 젖빛유리음영(patchy GGO), 기관지벽 비후 등을 폐전체에서 흔히 볼 수 있다(Fig. 10) [35]. 또한 흡연관 관련된 폐기종이 폐상부에서 자주 동반된다. DIP에서는 좀더 광범위한 젖빛유리음영이 양측폐에서 보이며, 특히 폐하부와 폐주변부에서 잘 보이는 경향이 있다(Fig. 11) [36]. 또한 망상음영과 폐기종 소견 등이 자주 동반되지만 벌집모양 음영은 흔치 않은 편이다.

A 39-year-old woman with RB-ILD. HRCT shows poorly-defined centrilobular nodules and patchy ground-glass opacity in both lungs.
림프구 간질성폐렴
림프구 간질성폐렴(lymphocytic interstitial pneumonia, LIP)은 조직학적으로 림프구, 형질세포, 조직구 등이 폐간질에 광범위한 침윤을 특징으로 하는 드문 질환이다[37]. 원인불명의 LIP는 매우 드물며 대부분은 쇠그렌증후군, AIDS, 자가면역질환 등의 기저질환과 연관되어 발생을 하는 경우가 많다[38]. 중년 여성에서 호발하며 수년에 걸쳐 천천히 진행하는 호흡곤란과 기침을 주소로 내원을 한다.
단순흉부방사선사진에서는 양측폐에 망상 혹은 망상결절(reticulonodular) 음영이 주로 폐하부에서 나타난다[39]. HRCT에서는 젖빛유리음영과 경계가 불명확한 중심소엽성 소결절 음영이 양측 폐에서 광범위하게 혹은 폐하부에서 주로 나타나는 것이 가장 흔한 소견이다(Fig. 12) [40]. 이외에 자주 볼 수 있는 소견으로는 흉막하 결절, 기관혈관다발(bronchovascular bundle)의 비후, 공기낭(air cysts), 소엽간격막 비후(interlobular septal thickening) 등이 있다. 특히 HRCT상 젖빛유리음영과 공기낭이 같이 보일 때에는 LIP를 시사하는 소견으로 볼 수 있다[11]. LIP의 공기낭들은 UIP의 벌집모양낭(honeycomb cysts)들과 달리 좀더 얇은 벽을 보이며 폐실질 내 혈관 주변에 주로 분포하는 특징을 보인다.
IIP에서 CT진단의 정확도
IIP에 속하는 간질성 폐렴들은 각각 특징적인 HRCT 소견들을 보이기도 하지만 상당수에서는 CT 소견들이 유사하게 중복되는 모양을 보여 감별이 어려운 경우가 흔히 있다. IPF환자에 대한 한 연구에서 CT 진단의 전체 민감도, 특이도, 정확도, 양성예측치는 각각 77%, 72%, 75%, 85%를 보였으며 이 중 진단에 자신이 있는 예들을 대상으로만 한 경우에는 각각, 87%, 95%, 90%, 96%의 매우 높은 정확도를 보였다[41]. 즉 경험 있는 영상의학과 의사가 HRCT상 자신을 갖고 IPF로 진단을 할 수 있는 예에서는 매우 높은 정확도를 보인 것이다.
IIP에 속하는 5종류의 간질성 폐질환을 대상으로 CT 진단의 정확도를 평가한 다른 연구에 의하면 UIP는 71%, COP는 79%, AIP는 65%, DIP는 63%, NSIP는 9%의 진단 정확도를 보인다고 기술하여 간질성 폐렴 중 NSIP가 다른 질환에 비해 CT 진단이 어려운 것으로 보고한 바 있다[42]. 그렇지만 또 다른 연구에서는 NSIP환자에서 CT 진단의 민감도, 특이도, 정확도가 각각 70%, 63%, 66%로 이전보다 높은 CT 진단의 정확도를 보고하였다[43].
전반적으로 IIP중 IPF와 COP는 전형적인 CT 소견이 보일 경우(벌집모양음영, 흉막하 혹은 기관지주변 폐경화)에 CT 진단의 정확도가 높은 편이다. AIP는 환자가 급성의 저산소혈증 호흡부전을 보이므로 임상적으로 다른 만성 간질성 폐렴과의 감별에 포함이 되지 않는다. NSIP, DIP, RB-ILD, LIP 에서는 HRCT상 젖빛유리음영이 흔히 보이는 소견이므로 공기낭(air cysts) 등 도움이 되는 다른 소견이 동반되지 않는 경우에는 구분이 어려운 경우가 종종 있다[32]. 특히 NSIP의 경우 젖빛유리음영 혹은 폐경화 소견이 주로 보일 경우에는 DIP와 COP와의 감별 진단이 필요하며 섬유화 병변(망상음영, 견인성 기관지확장) 등이 주로 보일 경우에는 UIP와의 감별이 어려울 수 있다.
결 론
특발성 간질성 폐렴은 7종류의 간질성 폐렴 질환을 포함한 질환군으로 각각의 질환은 임상증상, 영상소견, 조직소견, 예후 등에서 다양한 특성을 보인다. 이들 간질성 폐렴 각 질환을 분류하고 감별 진단하는 데 있어서 영상학적 소견은 주요한 역할을 하고 있다. 일부 간질성 질환에서는 CT 소견이 특징적이어서 매우 높은 진단적 가치를 갖는 반면 다른 예들에서는 영상소견이 서로 유사하여 CT상 정확한 진단을 하기 어려운 경우도 흔하다. 따라서 특발성 간질성 폐렴의 정확한 진단을 위해서는 임상적, 영상학적, 조직학적 소견들을 모두 종합하여 판단하여야 한다.