EGFR 돌연변이가 있는 폐의 육종양 암종에서의 Gefitinib을 사용하여 치료한 2예
Gefitinib Treatment for Pulmonary Sarcomatoid Carcinoma Driven by an EGFR Mutation: Two Cases
Article information
Abstract
저자들은 EGFR 돌연변이가 있는 폐의 육종양 암종에서 EGFR 표적치료제인 gefitinib을 사용하여 치료한 2예를 경험하였고, 부분관해(partial response) 이상의 반응을 나타내었다. 이에 증례고찰과 함께 보고하는 바이다.
Trans Abstract
Sarcomatoid carcinoma of the lung is defined as a group of poorly differentiated non-small cell carcinomas that contain a component of sarcoma or a sarcoma-like element. Most sarcomatoid carcinomas are known to have a poor prognosis. We describe a 45-year-old female never smoker and 49-year-old female never smoker with sarcomatoid carcinomas of the lung that expressed a specific EGFR mutation: microdeletion of exon 19. Their cancers progressed rapidly, despite appropriate conventional chemotherapy. After they took the EGFR-targeted agent gefitinib, there was a dramatic reduction in tumor size. Sarcomatoid carcinoma of the lung is a rare cancer whose pathogenesis is not well understood. According to these cases, the EGFR mutation could be a driver mutation and the potential therapeutic target of EGFR-targeted agents for sarcomatoid carcinoma in lung cancer patients, especially never smokers. (Korean J Med 2013;84:446-451)
서 론
폐에 발생하는 육종양 암종(pulmonary sarcomatoid carcinoma)은 비소세포암(NSCLC) 중에서도 매우 드문 조직유형이다. 이는 분화도가 나쁜 비소세포 폐암에 육종성 병변이 포함되어 있을 때 진단할 수 있다[1]. 육종양 폐암은 전체 폐암 중 약 1-3% 정도의 빈도를 보인다고 알려져 있다[2]. 흡연과 연관관계를 보이며, 남성이 여성에 비해 약 4배 정도 더 많은 빈도로 발생한다. 조직학적 아형(subtype)으로 pleomorphic carcinoma, spindle cell carcinoma, giant cell carcinoma, carcino-sarcoma와 pulmonary blastoma로 나눌 수 있다. 최근 이러한 육종양 암종에서 epithelial growth factor receptor (EGFR)의 돌연변이가 발견되는 경우가 보고되고 있다[3]. 이에 저자들은 EGFR 돌연변이가 확인된 육종양 폐암 환자에서 EGFR 표적항암치료제를 사용하여 치료한 2예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
증례 1
45세 여자 환자가 5개월 전부터 점점 심해지는 호흡곤란과 흉곽통증을 주소로 내원하였다. 과거력상 20년 전 결핵 림프절염을 앓은 것 이외에 특이소견 없었으며, 비흡연자였다. 청진상 오른쪽 흉부 호흡음이 감소되었고 흉부엑스레이에서 오른쪽 폐에 약 8 cm의 종괴가 관찰되어 검사 진행하였다. 흉부 CT상 오른쪽 폐 상엽과 중엽에 걸쳐 약 7.3 × 5.2 cm 종괴와 함께 다수의 종격동 림프절의 증대 및 다발성 간종괴가 관찰되었고(Fig. 2A), 전신 전이여부를 위해 시행한 FDG- PET 검사상 경부림프절, 종격동 림프절 및 복부림프절의 전이가 의심되었고, 양측 부신과 비장의 전이소견 및 다발성 뼈전이 소견이 관찰되었다. 뇌 자기공명단층촬영에서 다발성 뇌전이도 같이 확인되었다.
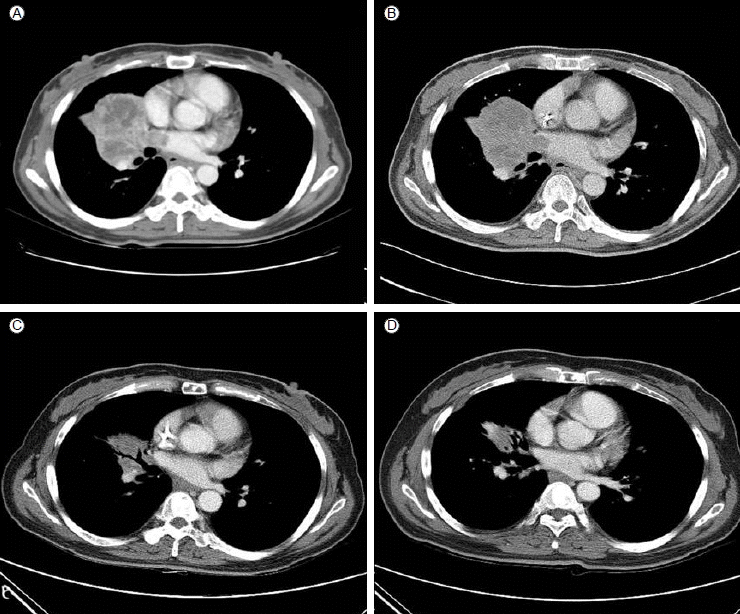
Chest CT scans in case 1. (A) At diagnosis. (B) After the first cycle of conventional chemotherapy. (C) After the second cycle of gefitinib, partial response of disease status according to RECIST 1.1 criteria. (D) After the fourth cycle of gefitinib.
이에 폐암의 다발성 전이 진단하에 기관지내시경을 통한 폐생검을 시행하였다. 병리조직검사상 분화도가 나쁜 악성종양이었으며, 면역화학염색 결과상 Vimentin 양성, Epithelial membrane antigen 양성, TTF-1 약양성, p63 음성 및 CK7 부분양성 소견으로 거대세포 암종(giant cell carcinoma)으로 진단되었다(Fig. 1A).

(A) H&E and immunohistochemistry of the giant cell carcinoma. (B) Chromatogram of EGFR exon 19 p.Glu746_Ala750 del.
환자는 뼈전이에 대해 통증경감을 위한 방사선치료를 시행하였고, 이후 Giant cell carcinoma에 준하여 ifosfamide와 adriamycin의 2제 항암요법을 1회 시행하였다. 4주 후 2차 항암요법 위해 입원하였을 때 환자는 이전보다 심한 호흡곤란을 호소하였고, 이에 흉부 CT 시행한 결과 폐병변의 악화로 progressive disease (RECIST criteria 1.1)로 평가하였다(Fig. 2B).
이후 EGFR 돌연변이 검사 결과, EGFR exon 19 microdeletion mutation을 확인하였고(Fig. 1B), 이에 환자는 gefitinib 항암치료를 시행하였다. 2개월 동안의 gefitinib치료 후 반응평가 위해 시행한 흉부CT 및 뇌 자기공명영상에서 부분 관해(partial response) 소견 확인하였다(Fig. 2C). 환자는 호소하는 증상 없는 상태로 현재까지 6개월째 gefitinib 투약 중이다.
증례 2
49세 여자 환자가 2달 전부터 시작된 전신 위약감과 기침, 가래를 주소로 내원하였다. 과거력상 특이병력 없었으며, 비흡연자였다. 신체검진상 우측 폐음이 전반적으로 감소되어 있었다. 흉부방사선검사상 우측 폐 중엽의 종괴와 함께 흉수가 발견되어 검사를 시행하였다. 흉부 CT상 우중엽의 6.8 cm 종괴와 함께 흉곽침범이 관찰되었고 흉막전이소견 및 종격동 림프절 증대 및 왼쪽 부신의 종괴가 관찰되었다(Fig. 4A). 전신 전이여부를 위해 시행한 FDG-PET 검사상 종격동 림프절 및 흉막, 다발성 뼈전이 및 왼쪽 부신 전이 소견이 관찰되었다.

Chest CT scans in case 2. (A) At diagnosis. (B) After the first cycle of conventional chemotherapy. (C) After the first cycle of gefitinib, partial response of disease status according to RECIST 1.1 criteria. (D) After the third cycle of gefitinib.
폐암의 다발성 전이 진단하에 경피적 침 조직 생검을 시행하였다. 병리조직검사상 육종성 악성종양이 진단되었고, 면역화학염색결과상 Vimentin 양성, High Molecular Weight Cytokeratin 부분양성, TTF-1 음성, p63 음성 CK7 양성 소견으로 육종양 암종(sarcomatoid carcinoma)으로 진단되었다(Fig. 3A).

(A) H&E and immunohistochemistry of the sarcomatoid carcinoma. (B) Chromatogram of EGFR Exon 19 p.Glu746_Ser752 delins Val.
이에 육종양 암종(sarcomatoid carcinoma)에 준하여 etoposide, ifosfamide, cisplatin의 3제 항암요법을 1회 시행하였다. 4주 후 외래를 방문하였을 때 환자는 호흡곤란이 악화된 소견을 보였으며, 반응 평가 위해 시행한 흉부 CT 결과 폐병변의 악화로 progressive disease (RECIST criteria 1.1)으로 평가하였다(Fig. 4B).
진단 당시 시행한 EGFR 돌연변이 검사 결과, EGFR exon 19 microdeletion mutation을 확인하였고(Fig. 3B), 이에 환자는 gefitinib 항암치료를 시행하였다. 1개월 gefitinib 치료 후 반응 평가를 위해 흉부 CT를 시행하였고 부분 관해(partial response) 소견을 확인하였다(Fig. 4C). 이후 4개월 동안 gefitinib 항암치료를 지속하던 중 뼈전이 소견 진행하였고 이로 인한 척수압박(cord compression)이 발생하여 alimta (pemetrexed) 단독항암요법으로 치료약제를 변경하였으나 치료반응을 보이지 않고 급격히 악화되어 발병 7개월 후 사망하였다.
고 찰
폐암에서의 EGFR 돌연변이는 폐암을 유발시키는 돌연변이(driver mutation)로 알려져 있다. 대부분의 경우 선암(adenocarcinoma)에서 발견되고 이러한 경우 EGFR TKI인 gefitinib 혹은 erlotinib를 사용하여 치료하는 것이 표준치료이다[4]. 이러한 EGFR TKI에 반응을 보이는 돌연변이 중 잘 알려진 것으로 EGFR 유전자의 21번째 exon의 L858R (leucine-858 to arginine) 점돌연변이(point mutation)와 19번째 exon의 미세결손(microdeletion)이 있다[5].
폐의 육종양 암종에서의 EGFR 돌연변이는 최근 여러 차례 증례보고가 되어 있다. 문헌마다 빈도는 다른데 약 20%의 환자에서 EGFR 점돌연변이가 관찰되었으나[6], 일부 기관에서는 22예 중 1예도 보고되지 않았다[7]. 공통적으로 남성에서보다 여성에서 흡연자보다는 비흡연자에서 이러한 EGFR 돌연변이의 빈도가 높았고, 진행한 병기의 암종에 있어서 이러한 EGFR 돌연변이가 발견되는 경우가 많았다. 이는 폐선암에서의 EGFR 돌연변이가 비흡연 여성에게 흔한 것과 일치하는 결과이다. 이러한 EGFR 점돌연변이의 유무와 생존기간의 상관관계는 없었다[8].
이 중 Ushiki 등[3]이 보고한 1예에서 사망 후 조직검사를 시행한 결과 육종양 암종 중 선암(adenocarcinoma)에서는 19번 exon의 미세결손 돌연변이가 발견된 것에 비하여, 육종(sarcoma)에서는 19번 exon의 미세결손 돌연변이와 함께 20번 exon의 T790M 돌연변이가 관찰되었다. 이는 EGFR 표적치료제인 gefitinib에 내성(resistance)을 나타내는 돌연변이로 잘 알려져 있다[9]. 또한 Sequist 등[10]이 발표한 자료에 따르면 EGFR 표적치료제에 대한 내성기전으로 소세포 폐암으로의 형질전환이 약 14%에서 발견되었고 육종양 암종으로의 형질전환도 1예 보고된 바가 있다. 육종양 암종의 육종은 상피세포의 줄기세포(stem cell)로부터 상피-중간엽 이행(epithelial-mesenchymal transition)을 통해 발생한 것이 알려져 있으므로, 위의 증례들은 EGFR 돌연변이가 있는 폐의 선암에서의 상피-중간엽 이행으로 발생한 2차적 변이로 보는 것이 타당할 것이다.
본 2예의 증례에서는 EGFR 돌연변이가 있는 육종양 폐암종에 대해 EGFR 표적치료제인 gefitinib을 사용하여 치료를 하여 비교적 좋은 반응을 보였다. 이전 증례보고들에서 gefitinib을 치료에 사용한 경우가 있었으나 효과는 미미하였다. 세 개의 증례에서 무진행 생존기간(progression free survival)은 각각 1개월, 3개월, 4개월이었고 반응이 관찰되지 않았다[3]. 이전 증례에서 gefitinib에 종양이 전혀 반응하지 않았던 것과 비교하여 본 증례는 약물에 대해 부분관해(partial response)이상의 반응을 보였다는 점과 증례 1에서는 6개월 이상의 무진행 생존기간(progression free survival)을 보였다는 점이 특징적이다. 이번 증례에서 앞선 증례들과는 다르게 첫번째 치료로 육종의 표준 항암치료를 시행하였는데, EGFR 표적치료제 전의 세포독성 항암제의 투여가 이전 증례와 다른 결과를 보였을 가능성을 조심스럽게 생각해 볼 수 있겠다.
본 2예의 증례에서는 4기 육종양 폐암 환자의 증례로 침생검을 실시하여 조직을 얻어 육종(sarcoma)과 선암(adenocarcinoma)의 분율에 대해 확인할 수 없었다. 환자에 대해 절제생검(excisional biopsy)을 실시하여 육종과 선암의 분율을 확인한다면 치료제에 대한 반응을 보다 정확하게 예측할 수 있을 것으로 예상된다.
이에 본 2 증례들에서 비흡연가 여성에서 발생한 육종양 암종에서 EGFR 돌연변이 검사를 통해 돌연변이를 발견하였다. 이후 육종양 암종에서 초치료로서 육종의 표준 항암치료를 시행한 후 EGFR 표적치료제의 투약으로 의미 있는 반응을 보였기에 문헌고찰과 함께 증례 보고하는 바이다.