비장티푸스성 살모넬라균에 의한 심율동전환제세동기 삽입부 감염 1예
Cardiac Resynchronization Therapy-Defibrillator Pocket Infection Due to Non-Typhoidal Salmonella Infection
Article information
Abstract
비장티푸스성 살모넬라 감염증에서 국소 병변으로 심장 내 장치의 포켓 감염은 드물게 발생한다. 저자들은 국내에서 보고된 바 없는 CRT-D 삽입부위의 비장티푸스성 살모넬라 감염으로 CRT-D 제거술 및 항생제 치료 후 완치된 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다. 또한 이러한 의원성 감염을 줄이기 위해 우리는 시술 전후의 환자 상태를 철저히 관리하고, 시술 중 무균적 상태를 유지하고, 감염이 발생한 경우엔 조기에 적절한 치료가 이루어져야 하겠다.
Trans Abstract
Non-typhoidal salmonella is rarely the cause of pacemaker infection. A 68-year-old man was referred to our hospital with tenderness and swelling at his cardiac resynchronization therapy defibrillator (CRT-D) implantation site. He had undergone CRT-D implantation because of sustained ventricular tachycardia and heart failure 7 years earlier, and the generator had been changed 2 months earlier. Twenty-four years earlier, he had undergone aortic valve replacement and mitral valve repair. We removed the generator and all of the CRT-D leads. After lead extraction, non-typhoidal salmonella serogroup B was cultured at the pocket and lead tip. The patient was managed successfully with lead extraction and antibiotic therapy. (Korean J Med 2013;84:418-422)
서 론
살모넬라(Salmonella Typhi) 감염은 경제 및 위생 상태가 개선됨에 따라 선진국에서는 거의 박멸된 상태이다. 하지만 1980년 이후부터는 비장티푸스성 살모넬라(nontyphoidal Salmonella)감염이 증가하고 있다. 과거 우리나라의 살모넬라 감염균의 대부분은 Salmonella typhi였으나, 1970년대 후반부터는 비장티푸스성 혈청 B군 살모넬라의 감염이 증가하였고, 균주는 계속 변화하여 1990년대 중반부터는 비장티푸스성 혈청 D군 살모넬라 감염이 증가되고 있다[1]. 비장티푸스성 살모넬라 감염의 합병증으로는 급성 설사, 패혈증, 국소농양, 뇌수막염, 골수염, 심내막염 등이 나타날 수 있으며, 드물게 동맥염이나 감염성 동맥류 같은 혈관 감염이 발생할 수 있다고 보고된다[2,3]. 이러한 비장티푸스성 살모넬라 감염은 면역 기능이 정상인 경우에는 발생률이 낮고, 면역력이 저하된 고령, 당뇨병 환자, 겸상 적혈구 빈혈이나 혈색소 병이 있는 경우, 만성 간질환, 결체 조직 질환, 악성 종양, 스테로이드 사용 등과 관련해서 잘 발생하는 것으로 알려져 있다[4]. 최근 고령 환자의 증가로 심혈관 질환자가 증가되고 있으며, 또한 심장내 장치(intracardiac device)인 인공 심박동기를 삽입하는 환자가 증가하고 있는 추세이고 전 세계적으로 인공 심박동기는 3백만 명 이상, 이식형 제세동기는 18만 명 이상 사용하고 있는 것으로 보고되고 있고[5], 이 환자들 중 동반된 질환도 많고, 면역 기능이 저하된 경우에 심각한 감염이나 흔하지 않은 균주의 감염이 보고된다. 심박동기 삽입 환자에서 박동기 부위의 감염인 포켓(pocket) 감염은 약 1-7%로 알려져 있고, 전신적 감염인 심내막염은 약 0.38-1%에서 발생하는 것으로 알려져 있다[5,6]. 저자들은 국내에서는 아직 보고된 바 없는 심장재동기화치료(cardiac resynchronization therapy defibrillator, CRT-D) 삽입 부위의 비장티푸스성 혈청 B군 살모넬라 감염을 경험하였기에 보고하는 바이다.
증 례
환 자: 남자, 68세
주 소: 내원 1개월 전부터 발생한 CRT-D 삽입 부위에 열감 및 압통을 동반한 종창
현병력: 내원 2개월 전 generator의 수명이 다하여 CRT generator를 교체하였고, 교체 2주 후부터 포켓부위에 압통을 동반한 종창이 있어 내원하였다.
과거력: 환자는 내원 24년 전 외부병원에서 류마티스 심장질환으로 대동맥 판막 치환술 및 승모판 수선술을 시행 받았고, 7년 전 심전도에서 지속성 심실 빈맥과 심실 내 전도장애, 심초음파에서 박출계수 15%의 중증 심실 기능 부전으로 CRT-D를 삽입하였다. 그 외 과거력상 특이 소견은 없었다.
이학적 소견: 내원 당시 혈압은 100/70 mmHg, 맥박은 분당 70회, 호흡수는 분당 15회, 체온은 섭씨 36.4도였다. 청진상 심잡음 및 이상호흡음은 들리지 않았다. CRT-D 삽입부위 주변으로 2 × 2 cm 종괴처럼 보이는 종창과 상처위로 가피가 관찰되었다(Fig. 1). 누르면 압통을 호소하였고 국소적 열감이 촉지되었다.
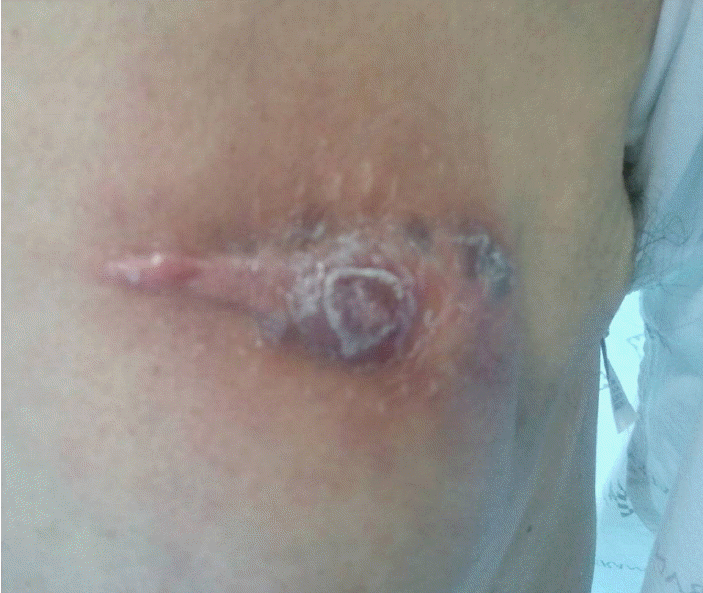
There is eschar and tissue swelling surrounding the implanted cardiac resynchronization therapy-defibrillator (CRT-D).
검사실 소견: 일반 혈액검사(CBC)에서 혈색소 11 g/dL, 백혈구 4,020/mm3, 분절 호중구 53%, 임파구 21%, 호산구 3%, 혈소판 88,000/mm3였으며, 혈청 생화학 검사상 나트륨 136 mmol/L 칼륨 4.5 mmol/L, 염소 102 mmol/L, 요소질소 23.7 mg/dL, 크레아티닌 1.76 mg/dL, 인 3.3 mg/dL 적혈구 침강속도(ESR)는 21 mm/hr C-반응 단백(CRP)은 4.53 mg/dL (정상 0-8)였다.
방사선학적 검사: 흉부 사진에서 좌측에 삽입된 CRT-D generator와 우심실 및 좌심실의 관정맥동에 위치한 전극선들이 관찰되고 있다. 우심실의 전극선은 제세동기 전극선이다(Fig. 2A). 폐 실질이나 심장에 특이 소견은 없었다.
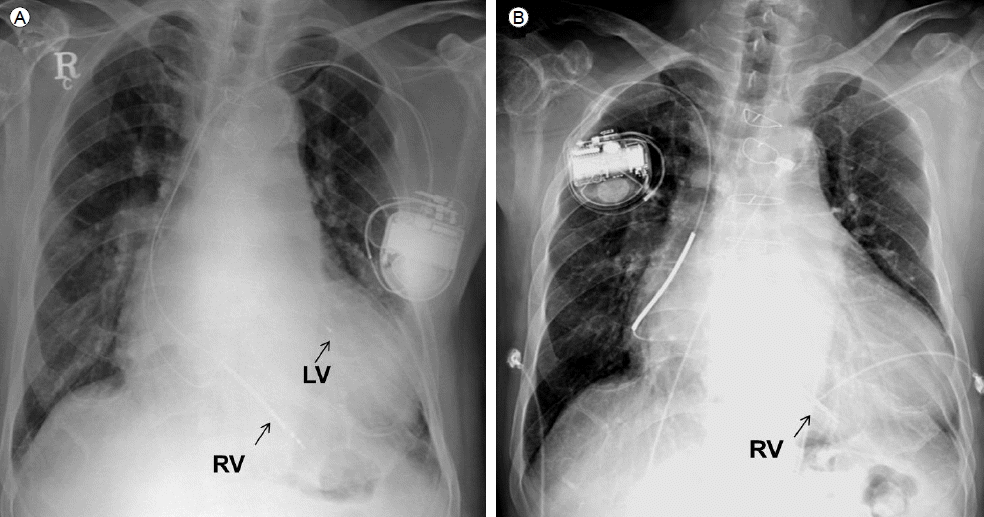
The chest X-ray (A) before lead extraction and (B) after lead extraction and insertion of a new implantable cardioverter defibrillator (ICD) lead.
심초음파 검사: 국소적 염증 소견이 있어 처음 입원해 시행한 경 흉부 심초음파 검사에서 vegetation 등의 특이소견 없었다.
임상경과: 환자는 내원 당일부터 vancomycin 정주치료를 시작하였고, 내원 3일째 포켓을 절개하고 CRT-D generator를 제거하였다. 드러난 환부에서는 상당한 연부조직 괴사 및 고름 소견이 보였다. 내원 4일째 창상배양과 혈액배양에서 동정되는 균이 없었으나 육안상 창상부위 감염소견이 호전되지 않아 vancomycin 1 g을 3일마다 투여하고, isepamicin 체중(kg)당 8 mg을 24시간마다 투여하여 정주치료를 하였다. 포켓에서 시행한 창상배양(swab culture) 및 흡인배양(aspiration culture)에서 비장티푸스성 혈청 B군 살모넬라균(G [-] nontyphoidal salmonella serogroup B)이 동정되었다. 내원 9일째 동정된 균주에 감수성이 있는 cefotaxim 4 g/day로 변경하여 치료하였다.
내원 4일째 경피적 방법을 이용하여 우심실에 위치한 전극선과 관정맥에 위치한 좌심실 전극선을 제거하였다. 전극선 말단에서 시행한 균 배양 검사에서도 포켓에서 배양된 균주와 동일한 균주가 동정되었다. 입원 후 시행한 혈액, 소변 및 대변배양 검사에서는 지속적으로 음성소견을 보였으며 면역 혈청 검사에서도 Widal 응집 반응 음성소견을 보였다. 환자는 지속성 심방세동으로 인해 CRT-D 치료의 이점이 많지 않을 것으로 사료되어, 내원 14일째 이식형 제세동기(implantable cardioverter defibrillator, ICD)를 우측으로 삽입하였다(Fig. 2B). 환자는 항생제 치료 2주 이후 시행한 창상배양(swab culture) 및 흡인배양에서 2번 연속으로 음전된 것을 확인 후 퇴원하였고, 이후 2개월간 cefixime 200 mg/day을 경구 치료 후 후유증 없이 치료 완료되었다.
고 찰
살모넬라 균속은 Salmonella Typhi, Salmonella Cholerasuis, Salmonella Enteritidis의 3종으로 나뉘어지고 이는 생화학적 방법으로 쉽게 구분되지만 항원 분석을 통하여 각각의 혈청형을 알 수 있다. Kauffmann-White에 따라 O 항원에 따라 A, B, C, D, E 5개 군으로 분류한다.
이러한 살모넬라 감염 중 6.4% 정도만이 장외 감염으로서 이 중 국소적 살모넬라 감염증으로는 관절염, 요로 감염, 중추 신경계 감염, 골 감염, 연부 조직 감염 등이 비교적 흔하나 면역 기능이 정상인 성인에서는 드물게 발생한다.
Fernández Guerrero [7] 등에 의하면 비장티푸스성 살모넬라 위장염에서 혈행성 감염이 되는 경우는 5% 미만으로 적었고 이 중 대동맥염 또는 심내막염은 극소수이나 사망률이 매우 높은 질환으로 조기 진단이 매우 중요하다고 하였다. 특히 Fernández Guerrero [7] 등이 보고한 심내장치 감염으로 인한 비장티푸스성 살모넬라 2예 중 1예는 당뇨로 면역 저하된 환자에서 Salmonella enterica serotype Enteitidis에 의한 제세동기 감염으로 환자는 결국 사망하였고, 다른 1예는 Smonella enterica serotype Enteitidis로 인한 심박동기 주머니 국소 감염이 있었으나 심박동기 제거 시술 및 항생제 치료 후 완치되었다.
심박동기 삽입 환자에서 가장 심각한 합병증은 감염이다. 이러한 감염은 피부 상재균에 의한 감염이 대부분이고 대표적인 균주로는 staphylococci (Staphylococcus epidermidis and Staphylococcus aureus), Streptococcus species, Enterobacteriaceae, Pseudomonas aeruginosa, Enterococcus species가 흔한 균주이다[8]. 이러한 심박동기 감염은 장치를 삽입한 경우 0.13%에서 19.9%로 다양한데, 가끔 흔치 않은 균주가 혈행성 전이로 장치 삽입 후 동정되는 경우가 있다[8]. Uslan 등[9]에 의하면 혈행성 전이로 인한 살모넬라 혈행증으로 심박동기 포켓 감염이 된 경우가 보고된 바 있다.
인공 심장박동 조율기 삽입 후 국소적 감염을 시사하는 소견으로는 인공 심박동기 삽입부위의 발적, 통증, 심장박동 조율기 일부 노출, 혈종형성, 시술부위 미란과 이로 인한 이차적 염증, 심박동기 이동, 삽입부위 농양형성 등이 있다[5,6,10].
심박동기 삽입 후 발생하는 국소적 염증과 감염성 심내막염 사이의 관련성에 대해 Klug 등[10]이 국소적 염증반응을 보이는(전신적 감염성 심내막염 제외) 105명의 환자를 전향적으로 추적해 연구한 바에 따르면, 균 배양 양성률이 혈액배양에서는 9%, 창상부위에서는 38%였으며, 혈관 외측부위 전극선에서는 92% 그리고 혈관 내측 부위 전극선에서는 79%로 매우 높게 나왔다. 전체 105명에 대한 치료 후 경과 추적 중 항생제 치료만 시행한 군에서는 재감염이 8명 중 4명이 나와 재발률이 50%였으나, 심박동기를 제거하고 항생제 치료를 한 97명에서는 1명만 발생해 1%의 재발률을 보였다. 따라서 심박동기 삽입부위의 피부 및 피하조직에 국소적 감염이 국한된 경우는 상당히 드물고, 국소적으로 발생했다 하더라도 전신감염으로 이행할 가능성이 크므로 시술을 통해 완전히 제거하는 것이 바람직하다.
이 중 비장티푸스성 살모넬라의 심박동기 감염은 세계적으로 4예가 보고된 상태로 매우 드물다. 4예 중 2예는 국소 감염이었고 그중 1예는 국소감염이 전극선을 따라 전신감염으로 발전한 경우이다[7,9,11]. 이처럼 발병률이 매우 적은 감염이나 발병 시 혈행성 전이로 전신 합병증 가능성이 있고 다른 포켓감염처럼 전극선까지 심박동기를 완전히 제거하지 않으면 반복적으로 국소감염 재발을 잘한다[11].
본 증례에서 환자는 위장관 감염이나 요로 감염 및 전신감염을 시사하는 증상이 없었고, 혈액배양과 면역 혈청 검사에서 Widal 응집 반응이 음성이었다. 따라서 혈행을 통한 전이보다는 generator 교체 시 오염(contamination)되었을 가능성이 높다. 이처럼 무균상태의 수술실에서 시술하는 경우에도 의원성 감염이 생길 수 있고 이를 예방하기 위해서 첫째, 시술 전 환자의 감염이 있는 경우 우선 치료하고, 환자의 기저질환을 최상의 상태로 조절하며, 시술 전 예방적 항생제를 사용한다. 둘째, 시술 중의 시술자 및 시술 환경의 무균적 처치가 이루어져야 하고, 시술 시 외상부위와 혈종, 전기 소작한 조직, 사강에 시술하는 것을 피해야 한다. 또한 피부봉합 시간을 단축시키고, 심장수술과 동시에 진행하는 것을 피해야 한다. 마지막으로 수술 후 조직의 관류와 영양 및 산소공급, 배농과 항생제 치료가 적절히 이루어져야 한다[12,13]. 이럼에도 불구하고 심박동기 삽입부 감염이 발생한 경우 전극선을 통해 전신감염(심내막염, 대동맥염 등)으로 진행될 가능성이 높으므로 유도선을 포함한 CRT-D를 완전 제거하고 항생제 치료를 병행하여 치료하여야 한다.
이와 같이 비장티푸스성 살모넬라 심박동기 감염은 매우 드문 증례일 뿐만 아니라 국내에서는 심장보조기기 감염원으로 보고된 바가 없어 살모넬라 감염에 임상적 의의가 있을 것으로 사료된다. 또한 치료로 국내에서 드물게 시행되는 비수술적 방법으로 CRT-D를 완전 제거하고 성공적으로 환자를 치료한 경우로 이를 보고하는 바이다.