후천성 다발성 관상동맥-심방실누공 1예
A Case of Acquired Coronary-Cameral Fistulae
Article information
Abstract
본 증례는 급성 심근경색으로 시행했던 응급 재관류 시술에서 좌전 하행지 관상동맥-좌심실 누공(LAD-LV fistulae)을 발견했고, 10년 후 비전형적인 흉통이 재발하여 시행한 관상동맥 조영술에서 이전 누공(LAD-LV fistulae) 외에 우관상동맥-좌심실 누공(RCA-LV fistulae)을 새롭게 관찰한 예이다. 대다수의 관상동맥 누공은 선천적으로 발생하고 단일혈관에서 기시하며 대개 우심방 또는 우심실로 유입되나, 본 증례의 관상동맥 누공은 후천적으로 발생하였고 다혈관에서 기시하였으며 모두 좌심실로 유입되었다. 이는 매우 희귀한 경우로 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
We report a rare case of acquired multiple coronary-cameral fistulae. A 46-year-old man presented to the cardiology department clinic complaining of recently aggravated exertional chest pain. He had been treated 10 years ago for an acute ST segment elevation myocardial infarction (STEMI) with percutaneous coronary intervention (PCI). During revascularization, diffuse multiple fistulae from the left anterior descending (LAD) artery to the left ventricle (LV) had been observed. The current chest pain was evaluated by elective coronary angiography but no significant stenosis was observed. However, newly developed diffuse fistulae from the distal right coronary artery (RCA) to LV were found during angiography, as well as LAD-LV coronary fistulae. Multiple coronary- cameral fistulae were thought to be causing chest pain. A beta-blocker was prescribed and, after 3 months of follow-up, exertional chest pain had subsided without further complication. (Korean J Med 2013;84:91-95)
서 론
관상동맥 누공(coronary artery fistula)은 크게 두 가지 형태로 구분된다. 하나는 관상동맥이 심방 혹은 심실과 직접적으로 교통하는 관상동맥-심방실 누공(coronary-cameral fistula), 그리고 또 다른 하나는 관상동맥이 다른 혈관과 직접적으로 교통하는 관상 동정맥 누공(coronary arteriovenous fistula)이다. 이들 대부분은 발생학적 이상에 기인하는데, 대다수의 관상동맥 누공은 하나의 관상동맥에서 기시하며(우관상동맥 55%, 좌관상동맥 35%), 누공의 끝(termination)은 대개 우심방이나 우심실로 알려져 있다[1,2].
본 증례의 환자는 양 관상동맥에서 동시에 기시하고 좌심실로 교통하는 관상동맥 누공을 가졌고, 이들 중 하나는 후천적 요인에 의해 발생된 관상동맥 누공이었다. 이는 임상에서 흔히 볼 수 없는 예로 보고하는 바이다.
증 례
46세 남자가 2개월 전부터 가벼운 활동 시 발생하여 10여 분간 지속되는 흉골하 통증을 주소로 내원하였다. 내원 시 혈압은 110/70 mmHg였고 심박수는 76회였으며 호흡곤란은 호소하지 않았다. 심음은 규칙적이었으며 심잡음은 들리지 않았다. 과거력상 고혈압이 있었고 20갑년의 흡연자였으며 10년 전 급성 심근경색으로 경피적 관상동맥 중재시술을 받았었다. 과거의 의무기록을 참조한 결과, 10년 전 ST 분절 상승 급성 심근경색이 발생하여 혈전용해제(urokinase)를 투여 받았으나, 흉통과 ST 분절 상승이 지속되어 관상동맥 조영술을 시행, 중위부 좌전 하행지 관상동맥의 완전폐쇄(TIMI 0)가 관찰되어 경피적 관상동맥 중재술(3.0 × 20 mm, Maestro, JOMED GmbH, Rangendingen, Germany)을 시행 받았다. 당시 좌전 하행지의 원위부 사선분지(LAD distal diagonal branch)와 좌심실이 연결된 미세 관상동맥 누공 관찰되었으나 이에 대해서는 별다른 시술 없이 aspirin 100 mg, clopidogrel 75 mg, carvedilol 12.5 mg, 하루 1회, captopril 25 mg 하루 2회, nicorandil 5 mg 하루 3회 유지하였으며, 5년 전부터는 개인의원에서 경과관찰하며 aspirin, clopidorel, atorvastatin만 복용하였다.
이번 내원 시, 심전도에서 V2에서 V4전극에 걸쳐서 Q파가 관찰되었으나 5년 전의 심전도와 비교, 큰 차이 없었으며(Fig. 1A), 검사실 소견상 저밀도 지질 단백질/중성지방(LDL/ triglyceride) 185/382 mg/dL로 상승된바 외에 이상소견 관찰되지 않았다. 단순 흉부 사진에서 정상 심장크기였고 폐부종은 관찰되지 않았으며, troponin T 0.004 ng/mL으로 정상이었다.
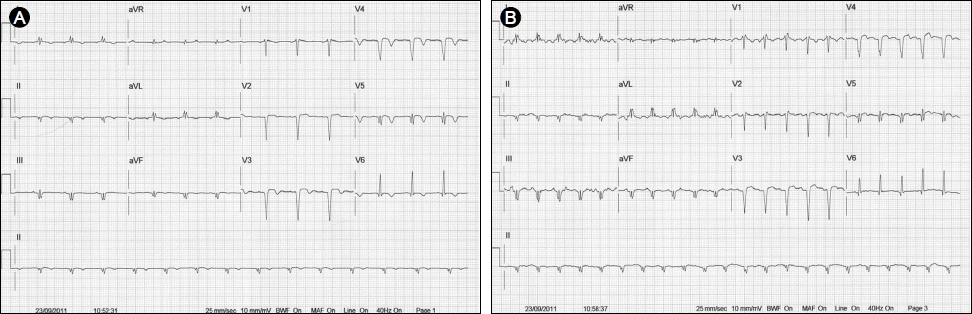
Treadmill electrocardiogram (EKG). (A) Baseline EKG. (B) At peak exercise, there was no significant ST change and the target heart rate (THR = 148/min) was not achieved.
경흉부 심초음파상 좌심실 구혈률 43%로 경도의 좌심실 수축기능 장애를 보였으며, 좌전 하행지 동맥 영역(whole apex, mid septum, mid anterior wall)으로 허혈 손상으로 인한 국소벽 운동장애가 관찰되었으나 과거의 심초음파 결과와 비교하였을 때 의미 있는 차이는 관찰되지 않았다. 환자의 운동능력 및 심근허혈의 증거확보를 위하여 답차 운동부하 심전도(treadmill test) 시행하였으며 7.0 MET까지 운동하였으나, 숨찬 증상과 피로감 호소하여 최대 심박수에 도달 못한 채 검사 중단하였다. 운동 부하 검사 중 흉통이나 심전도상 ST 변화는 보이지 않았다(Fig. 1).
새로 발생한 흉통의 양상은 다소 비전형적이었으나, ST 분절 상승 급성 심근경색의 병력으로 관상동맥폐쇄 질환의 악화를 배제할 수 없어, 관상동맥 조영술을 시행하였다.
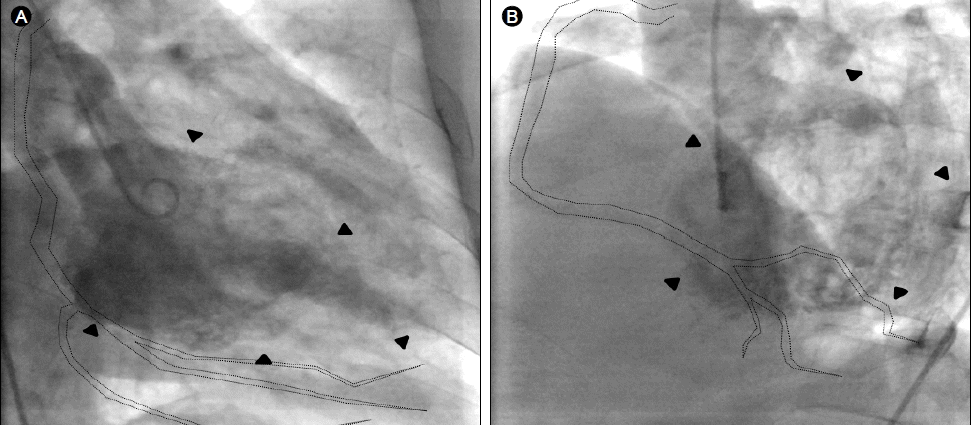
관상동맥 조영술상에서 중위부 좌전 하행지 동맥(LAD)의 경도의 협착 소견이 관찰되었으나, 그 외 다른 관상동맥 내허혈증상을 유발할 의미 있는 협착 소견은 관찰되지 않았고(Fig. 2B), 과거 관찰되던 좌전 하행지의 원위부 사선분지(LAD diagonal branch)와 좌심실 간의 관상동맥 누공은 동일한 양상으로 관찰되었다(Fig. 2A). 그러나 과거에 관찰할 수 없었던 원위부 우관상동맥의 후하행지(posterior descending branch of distal RCA)와 좌심실 간의 관상동맥 누공이 새롭게 관찰되었다(Fig. 2C and 2D). 좌심실 조영술(Left ventriculargraphy)상에서 심첨부와 중전벽의 국소벽 운동장애 소견을 관찰하였고, 관상동맥 누공이 좌심실로 연결됨을 확인할 수 있었다(Fig. 3).

Coronary angiography. (A) Diffuse fistulae from the left anterior descending artery to left ventricular cavity (dotted line); right anterior oblique, caudal view. (B) Diffuse fistulae from the left anterior descending artery to left ventricular cavity (dotted line); antero-posterior, cranial view. Moderate concentric stenosis was observed at the mid-segment of the left anterior descending artery (arrows). (C) Diffuse fistulae from right coronary artery to left ventricular cavity (dotted line); right anterior, oblique view. (D) Diffuse fistulae from right coronary artery to left ventricular cavity (dotted line); left anterior, oblique view.
Left ventriculography. (A) Left ventriculography, right anterior oblique view. The left ventricle is marked by arrowheads and the right coronary artery is superimposed. (B) Left ventriculargrophy, left anterior oblique view.
흉통이 심하지 않았고 운동에 의하여 악화되지 않았으며, 다수의 크기가 작은 미만성 관상동맥 누공이어서 보존적 치료를 하기로 하고 환자는 퇴원하였다. 기존 처방에 베타차단제 중 하나인 carvedilol을 추가 투여하며 외래에서 경과관찰하였으며, 3달 후 추적 진료에서 환자는 흉통을 더 이상 호소하지 않았다.
고 찰
본 증례는 관상동맥이 심방 혹은 심실과 직접적으로 교통하는 관상동맥-심방실 누공(coronary-cameral fistula)으로 이는 임상진료에서 매우 드물게 발견된다. 진단목적으로 무작위로 시행했던 관상동맥 조영술의 대략 0.08-0.3%에서 관상동맥 누공이 보고된 바 있다[3,4]. 또한 관상동맥 누공의 시작(origin)은 우관상동맥 55%, 좌관상동맥 35%, 양쪽 모두에서 기시되는 경우는 5%이며, 끝(termination)은 우측 심방 또는 심실이 대략 90%로 매우 우세한 것으로 보고되고 있다[1,2]. 1996년에서 2003년까지 30,829명의 심장내과 환자들을 대상으로 시행한 독일의 연구에서도 오직 20명만이 다수의 관상동맥-좌심실 미세 누공을 지니는 것으로 나타났다[5]. 다발성 관상동맥-좌심실 누공은 드물며, 본 증례처럼 양측 관상동맥에서 기시하여 좌측 심실로 연결된 관상동맥 누공은 임상진료에서 접하기 어려운 경우이다.
관상동맥 누공은 대부분 선천적 발생학적 이상에 의해 발생하나, 후천적으로도 외상이나 침습적 심장관련 시술(예: 심근조직검사), 심근경색 후 발생할 수 있다[6-8]. 본 증례에서 우관상동맥 누공은 10년 전 심근경색 발생 당시의 관상동맥 조영술에서 관찰되지 않았던 점을 고려할 때, 심근경색 발병 후 후천적으로 발생한 경우지만, 누공 부위가 경색부위(전벽 심근경색)와 일치하지 않았기에 심근경색과의 직접적 인과관계는 불분명하다. 본 증례의 관상동맥 누공들은 좌심실로 유입되고 있기 때문에 thebesian vein system과 관련된 관상동맥 누공으로는 생각되지 않았다. 다만 과거 심초음파 상에서 관찰할 수 없는 심내막 심근경색이 새로이 발생하여, 심벽의 국소적 미세괴사로 동맥 누공이 발생했을 것을 추정할 수는 있을 것이다[9].
관상동맥 누공을 가진 대다수의 환자들은 증상이 없으나, 소수의 환자군에서 협심증, 심부전, 심근경색, 심내막염, 동맥루 파열, 동맥류 형성, 동맥루내 혈전형성, 부정맥 등이 발생한다. 무증상이 우세한 이유는 대다수의 관상동맥 누공의 크기가 작고, 개수가 한 개이기 때문이다. 다수의 미만성 관상동맥 누공을 지녔던 본 증례의 환자는 비전형적이긴 하지만 협심증 양상의 흉통을 호소하였다. 이러한 증상은 심장 혈류 전환 증후군(coronary steal syndrome, 저항성이 적은 누관으로 혈류의 단락이 발생하여 동맥루 이하의 혈관이 지배하는 심근부위에 허혈 현상이 발생하는 것), 또는 용적과부하(Lt-to-Lt shunt)에 의해 야기된다고 알려져 있다[9].
관상동맥 누공 진단은 심초음파와 관상동맥 조영술로 가능하다. 심외막에서 심실 내로 지속적으로 유입되는 혈류가 관찰될 때 심초음파로도 진단이 가능하나, 누공의 끝이 미만성의 작은 혈관일 때는 진단이 어렵다. 관상동맥 조영술이 관상동맥 누공의 해부학적 구조 및 크기를 확인하는 데 가장 좋은 진단법으로 알려져 있다. 최근에는 다배열 검출기 전산화단층촬영 장치(Multi-Detector Computed Tomography), 심장 자기공명촬영(Cardiac Magnetic Resonance Imaging)도 이용되고 있다. 본 증례는 경흉부 심초음파를 시행했으나 관상동맥 누공은 관찰되지 않았고, 관상동맥 조영술에서 심실로 조영제 유입이 확인되어 진단 할 수 있었다[10,11].
관상동맥 누공의 치료는 증상 유무, 누공의 개수 및 크기에 따라 달라지며, 치료 방법으로는 약물치료, 수술적 치료, 경피적 도관 시술법이 있다. 증상이 동반되는 경우에 치료를 시작하며, 누공이 작은 크기로 다수 존재하는 경우에는 약물치료를 먼저 시행하고, 그에 반해 크기가 큰 누공이 한 개 존재하는 경우에는 수술, 시술 방법을 통해 치료한다. 약물치료로는 베타 차단제, 칼슘채널 차단제가 증상을 호전시키는 것으로 보고되고 있고[12], 수술적 치료법으로는 해당혈관 결찰이 있으며, 경피적 도관 시술법으로 코일, 풍선, 플러그 등을 이용한 색전술이 있다. 수술적 혈관 결찰법이 사망률, 합병증 발생률 및 장기 증상 완화율에서 모두 탁월한 결과를 보이지만 적은 비용과 빠른 회복률 때문에 최근에는 경피적 도관 시술법이 보다 널리 시도되고 있다[9,13-16]. 본 증례의 경우, 증상이 있어 치료가 필요했지만 크기가 작은 다수의 누공이었기에 시술이나 수술보다는 약물치료로 베타 차단제를 투여했다.