상장간막동맥증후군: 과거와 현재
Superior Mesenteric Artery Syndrome: Past and Present
Article information
Trans Abstract
Superior mesenteric artery syndrome (SMAS) is an uncommon disease resulting from compression of the third portion of the duodenum by the superior mesenteric artery. Typical symptoms of SMAS are anorexia, nausea, vomiting, early satiety, abdominal pain and postprandial fullness. The diagnosis requires radiologic studies in patients with symptoms suggestive of SMAS. Radiologic studies include upper gastrointestinal barium study, angiography, abdominal ultrasound, endoscopic ultrasound, computed tomography (CT), and magnetic resonance imaging. The SMA angle to the aorta is normally 45° (range, 38-56°), whereas in SMAS, that SMA angle is decreased to 6 to 25°. Additionally, the distance between the SMA and the aorta normally ranges from 10 to 20 mm, whereas in SMAS this distance is decreased to 2 to 8 mm. Recently SMAS diagnosis has been most commonly confirmed by CT. Therapy of SMAS includes weight gain to increase the aortomesenteric angle, but surgery is indicated in symptomatic patients when conservative management failed. To date, laparoscopic duodenojejunostomy seems to be a first-choice surgical options. (Korean J Med 2013;84:28-36)
상장간막동맥증후군(superior mesenteric artery syndrome)은 십이지장의 3부가 대동맥과 상장간막동맥에 의해 눌려서 십이지장 폐쇄 증상이 발생하는 드문 질환이다. 상장간막동맥증후군은 1842년 Rokitansky [1]에 의해 처음으로 소개되었으며 이후에 Wilkie [2]는 1927년에 75명의 환자들을 모아 이 질환들의 특징들을 보고하였다. 이 질환은 Wilkie 증후군이라고도 불리우며 다른 별칭에는 대동맥-상장간막동맥 압박(aortomesenteric artery compression) [3], 장간막동맥성 십이지장 압박(arteriomesenteric duodenal compression) [4], 십이지장 혈관성 압박(duodenal vascular compression) [5], 캐스트(cast) 증후군[6]이 있다.
사실 과거의 많은 문헌보고에도 불구하고 아직까지도 이 질환이 과연 존재하는지가 논란이 되고 있다. 많은 연구가들은 상장간막동맥증후군이 거대십이지장의 다른 원인과 혼동되기 때문에 과잉진단될 수 있다고 주장하고 있다. 그럼에도 불구하고 이 질환은 척추측만증 수술 이후에 발생하는 합병증으로 잘 알려져 있으며 최근 의학적 기술이 발달함에 따라 진단 기준도 다양하게 제시되고 있어 이 질환의 실체가 좀더 명확해 지고 있다. 현재 이 질환은 PubMed 검색에서 약 500여 문헌을 찾아볼 수 있지만 대부분 증례 보고에 그치고 일부 증례 수가 많은 보고의 경우 30년 전에 출판되었다. 따라서 현재의 발전된 의학 수준에서 본 질환을 다시 고찰해 보고자 한다.
본 론
해부학과 병인론
상장간막동맥증후군은 대동맥과 상장간막동맥사이의 각도가 줄어들면서 십이지장의 3부가 눌려 혈류가 감소하면서 발생하게 된다. 십이지장의 횡행부는 후복막 제2요추 높이에 위치하며 내장 중 가장 잘 고정된 부분으로 대동맥과 상장간막동맥 사이를 지나게 된다. 상장간막동맥은 제1요추 높이의 췌장 경부의 뒤에 있는 복부대동맥에서 기시한다. 좌신정맥, 췌장의 구상돌기, 림프관이 대동맥과 상장간막동맥 사이 각도(aortomesenteric angle)를 유지하는 역할을 하는 후복막 지방조직에 둘러싸여 있다(Fig. 1). 따라서 대동맥과 상장간막동맥 사이 각도가 줄어들면 십이지장뿐만 아니라 좌신정맥도 압박되어 정맥성 고혈압(venous hypertension) 등을 일으키는 호두까기 증후군(nutcracker syndrome)도 발생할 수 있다[7]. 대동맥과 상장간막동맥 사이의 평균각도는 38-56°이다[8-10]. 복부초음파 연구에서 두 동맥 사이의 평균 거리는 10-28 mm이다[11]. 과거 상장간막동맥증후군은 대동맥과 상장간막동맥 사이의 각도가 6-16°까지 감소하면(대동맥과 상장간막동맥 사이 거리가 2-8 mm) 발생한다고 보고되었으며[10-12] 현재의 발달된 CT 혈관조영술이나 MR 혈관조영술, 색채 도플러 초음파, 내시경 초음파 등에서는 대동맥과 상장간막동맥 사이의 각도가 22°, 사이의 거리가 8 mm 이하면 발생한다고 보고되고 있다.
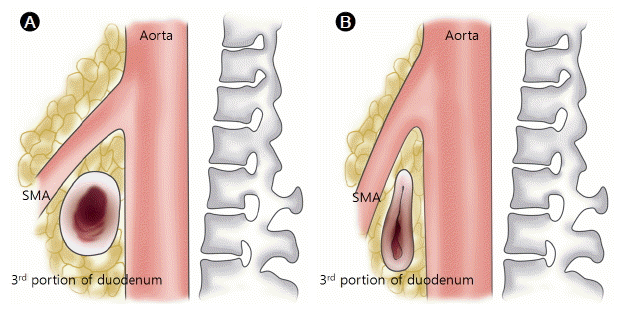
Aortomenseteric angle between normal anatomy and superior mesenteric artery (SMA) syndrome. (A) Normal aortomesenteric angle is 38 to 56 degrees. (B) The aortomestenteric angle of SMA syndrome is less than 22 degrees, and therefore the third portion of duodenum is compressed between the aorta and the SMA.
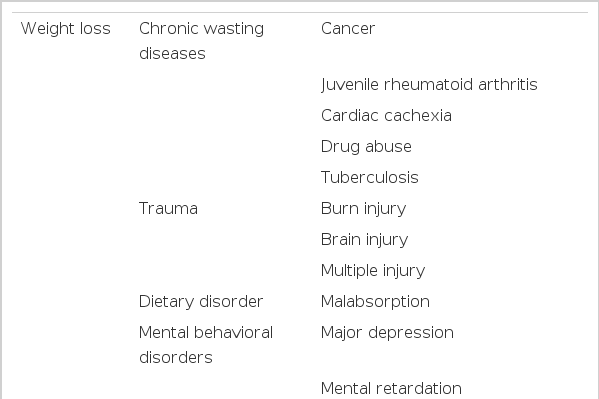
상장간막동맥증후군의 유발 요인들은 크게 세 가지 범주 1) 체중감소, 2) 외부 혹은 복강내 압박, 3) 장간막 장력 증가로 분류할 수 있다(Table 1) [13]. 마른 체형에서 상장간막동맥증후군이 잘 발생하지만 임상 증상이 병발하는 데 다른 요인들이 관여한다[14]. 과거에는 빠른 체중감소나 다른 대사 상태의 변화가 장간막과 후복강의 지방조직의 감소를 초래하여 대동맥과 상장간막동맥 사이 각도가 줄어들어 상장간막동맥증후군이 잘 발생하게 된다고 보고되었다. 최근 거식증, 우울증 같은 정신의학적 질환도 상장간막동맥증후군과 관련이 있다고 보고되고 있으나 이러한 질환들이 상장간막동맥증후군의 원인인지 아니면 합병증인지는 확실하지 않다[15]. 외부 혹은 복강내 압박도 상장간막동맥증후군을 유발할 수 있다. 종양이나 복부대동맥 동맥류 등이 십이지장을 압박하여 폐색 증상을 일으킬 수 있으며[16,17] 수술 후 복부 캐스트를 했을 때도 복부 압박에 의하여 상장간막동맥증후군이 발생할 수 있다. 또한 수술에 의한 대동맥과 상장간막동맥 사이 각도에 영향을 주는 구조물의 변형도 위험 요소이다. 회장-항문 파우치 문합수술 이후 소장 장간막이 아래로 잡아당겨질 때 대동맥-장간막동맥 각도가 줄어들게 되며[18] 척추측만증 수술 이후 발생하는 척추의 길이증가도 상장간막동맥증후군의 잘 알려진 위험 요소이다[19]. 십이지장-공장 굴곡에 존재하는 트리이쯔 인대(ligament of Treitz)의 현수근의 비후와 연관된 해부학적 변이도 십이지장을 대동맥-장간막동맥 사이 각도 위쪽으로 이동시키게 된다[20].
역학
본 질환의 정확한 발생빈도는 아직 모르지만 과거 일반 대중인구에서 바륨을 이용한 위 조영술에 기초했을 때 0.013-0.3%로 아주 드물게 보고되고 있으며[21,22] 최근의 위 조영술에서는 0.78%의 빈도로 보고되었다[23]. 척추측만증 수술 이후 발생하는 상장간막동맥증후군은 0.5-2.4%로 보고되고 있고[24,25] 화상 환자에서는 1.1%로 보고되고 있다[26]. 상장간막동맥증후군은 과잉 진단되는 경향이 있으며 엄격하게 임상적, 영상학적 진단 기준을 적용했을 때는 잠재적으로 유병률이 더 낮아질 수 있다. Hines 등[12]은 상장간막동맥증후군으로 진단된 44명의 환자를 엄격한 영상학적 진단 기준에 따라 재평가 했을 때 오직 14.6%만이 확진되었다고 보고하였다.
국내에서는 Park [27]이 1967년 처음 보고하였는데 부산지역에서 10년간(1957-1966년) 외래 환자 34,107명 중 단지 1명에서만 발견되었고 1967년에 Kim [28]은 5년간 입원 환자 10,520명 중 1명(0.062%)에서 진단되었다고 보고하였다. 그러나 최근 영상 진단 기술의 수준의 발달과 더불어 이 질환에 대한 인식도가 증가하면서 국내에서도 상장간막동맥증후군의 증례들의 보고가 점점 증가하고 있으며 Sung 등[29]은 1967년부터 36년간 수술 치료를 시행한 상장간막동맥증후군 환자 53예를 모아 발표하였다. 최근에는 Lee 등[30]이 1999년부터 최근 10년간 7개 대학병원에서 진단된 상장간막동맥증후군 80예를 모아 보고하였다. 본 질환은 젊은 10-30대의 여성에서 호발하는 경향을 보이나[31] 소아나 고령의 노인에서도 발생할 수 있다[32].
증상
주된 임상증상은 간헐적인 악화를 동반하는 상복부 통증이다. 다른 빈번한 임상증상은 오심, 구토, 식욕부진, 식후 복부 불편감, 담즙성 구토, 체중 감소 등이다[19,33]. 상복부 통증은 복와위(prone position), 무릎-흉위(knee-chest) 혹은 좌측 측와위(left lateral decubitus)에서 특징적으로 증상이 완화되는데, 이러한 자세들이 소장 장간막 장력을 줄여 대동맥-장간막동맥 사이 각도를 늘리기 때문이다[12]. 또한 소화성 궤양도 발생하게 되는데, 이는 십이지장의 폐색에 의한 십이지장의 저류, 십이지장 근위부의 확장, 담즙성 구토와 관련이 있다[2,16,19,34,35]. 또한 화상으로 인한 상장간막동맥증후군 환자 19명 중 5명에서 십이지장 궤양의 발생이 보고되었다[26].
임상경과는 급성형과 만성형으로 구분할 수 있다[36]. 급성형은 외상, 수술, 화상 등에 의해 상복부 통증과 담즙성 구토가 반복적으로 나타나고 체중감소가 동반된다. 측만증 수술을 받은 환자에서는 수술 후 첫 일주일 안에 대부분 증상이 나타나는 반면[24,25,33] 화상 환자에서는 보통 2주일 이후에 증상이 잘 발생한다[26]. 만성형은 마른 체격에서 수개월에서 수년간 소화불량, 오심, 구토, 간헐적인 담즙성 구토가 대부분이다.
과거 이 질환의 임상양상이 소화기 기능성 위장관 질환과 유사하기 때문에 실제 환자를 접하는 임상의가 이 질환을 의심하고 꼭 감별진단에 포함시켜 생각하는 것이 조기 진단을 위한 지름길이라 하겠다.
진단
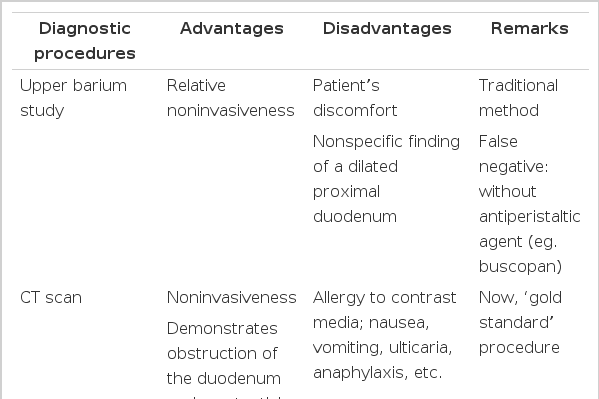
상장간막동맥증후군의 진단 검사법으로 과거에는 상부위장관 바륨 조영검사, 일반 혈관조영술이 많이 시행되었으나 최근에는 CT 스캔 혹은 CT 혈관조영검사, MR 혈관조영검사, 복부 초음파, 내시경, 내시경 초음파 등의 비침습적 방법이 사용되고 있다(Table 2) [9,11,16,37-41]. 상부위장관 바륨 조영검사가 과거에는 진단에 주로 이용되었는데 십이지장의 3부에서 수직 방향의 선상 외부압박과 함께 십이지장 근위부의 확장 소견을 보이면 진단할 수 있다. 그러나 이러한 영상학적 특징은 거대 십이지장(가성장폐색)의 경우에도 나타날 수 있으므로 감별이 필요하다[42]. 상장간막동맥증후군의 상부위장관 바륨 조영검사의 영상학적 진단기준은 1) 십이지장 1부 혹은 2부의 확장, 2) 십이지장 3부의 급격한 수직의 혹은 사선의 압박, 3) 폐색 근위 부위에서 장연동에 반하는 조영제 운동, 4) 음식물의 위 십이지장 통과 시간의 지연 (4-6시간), 5) 복와위, 무릎-흉부 혹은 좌측 측와위 자세에서 폐색의 호전이다[12]. 저 긴장성 십이지장 조영검사(hypotonic duodenography)는 상부위장관 바륨 조영검사와 같은 방법으로 하되 조영제가 십이지장으로 넘어간 후 촬영하는 방법으로 검사 15분 전에 buscopan 2 cc를 근육주사하여 연동 운동을 억제시킴으로써 십이지장 내 병소나 십이지장 자체를 일정하게 잘 펴서 관찰하는 방법이다. 상장간막동맥증후군에서 일반적인 조영술에 비해 저 긴장성 십이지장 조영검사가 더 정확한 검사로 알려져 있다[12]. Lee 등[30]의 연구에서도 CT를 표준검사로 하였을 때 상부위장관 바륨 조영검사의 위음성률은 18.6%이었는데 위음성을 보였던 환자들은 모두 위장관 연동운동 억제제를 사용하지 않은 환자들이었다. 따라서 임상에서 상장간막동맥증후군이 의심되는 환자에서 조영검사를 시행하는 경우 영상의학과 의사에게 저 긴장성 십이지장 조영검사를 의뢰해야 한다.
조영검사는 대동맥과 상장간막동맥 사이를 직접적으로 평가한 것은 아니므로 과거에는 확진 목적으로 침습적인 혈관조영술을 시행하였다[38]. 혈관 조영술상에서 상장간막동맥에 의해 교차되는 십이지장의 폐쇄부위와 상장간막 동맥의 비정상적인 주행, 대동맥-상장간막동맥 간 각도와 거리의 감소 소견을 보인다. 혈관 조영술상에서 대동맥과 상장간막동맥 사이 각도가 7-22도 이하이면서 사이 거리가 2-8 mm 이하일 때 상장간막동맥증후군의 증상과 잘 일치하였다. 조영검사와 혈관조영술을 동시에 시행하면 십이지장의 폐쇄와 상장간막동맥과의 관계를 동시에 볼 수 있는 장점이 있다. 그러나 일반 혈관조영술은 침습적이어서 최근에는 비침습적인 진단 방법이 사용되고 있다.
최근에 시행되는 진단 방법 중 CT 스캔 혹은 MR 혈관조영술은 상장간막동맥증후군의 원인이 불명확할 때 도움이 된다. CT스캔은 대동맥-장간막동맥 사이 각도와 거리뿐만 아니라 부가적으로 십이지장의 폐색, 후복막 지방조직, 그리고 종양이나 동맥류 같은 압박의 원인 등을 확인할 수 있다(Fig. 2). CT스캔과 MR 혈관조영술은 정확한 각도와 거리를 평가하는 데 동등한 가치를 보인다[37]. Unal 등[39]은 적어도 한 가지 이상의 상장간막동맥증후군 증상이 있으면서 CT 스캔상 대동맥-장간막동맥 사이 각도가 22도 미만(민감도 42.8%, 특이도 100%), 사이 거리가 8 mm 미만(민감도, 특이도 100%)일 때 상장간막동맥증후군으로 진단하였다.
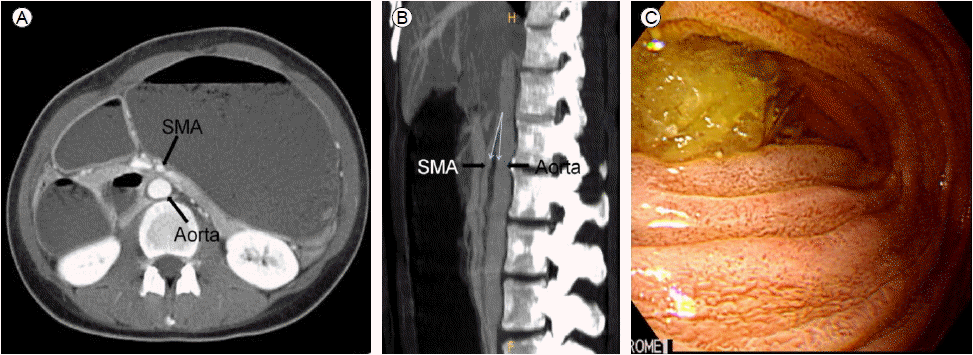
Computed tomography of a 30 year-old-women with superior mesenteric artery syndrome. (A) The aortomesenteric distance is 4.7 mm. (B) The aortomesenteric angle is 9.2 degrees. (C) A pulsatile compressive lesion in the third portion of the duodenum is noted.
최근 색채 도플러 초음파(ultrasound power color doppler imaging)가 대동맥-장간막동맥 사이 각도를 측정하는 데 사용되고 있다. Neri 등[11]은 950명의 상복부 증상이 있는 환자들의 대동맥-장간막동맥 각도를 색채 도플러 초음파를 통하여 측정하였을 때 29명에서 각도의 감소를 확인하였고 이를 CT 스캔을 통하여 확진하였다. 따라서 색채 도플러 초음파가 상장간막동맥증후군이 의심되는 환자에서 선별 검사로 시행될 수 있다고 보고하였다.
최근에는 내시경초음파 검사를 이용하여 대동맥과 상장간막동맥 사이 각도를 직접적으로 측정하여 진단했던 보고가 증가하고 있다[41,43].
상부위장관 내시경 검사는 십이지장 폐쇄의 기계적 원인을 배제하는데 이용하는 검사법으로 십이지장 3부에 박동성의 외부 압박의 전형적인 소견을 보이지만 항상 관찰되는 것은 아니다[13]. 또한 십이지장 폐쇄와 연관된 합병증인 소화성 궤양 및 이차성 역류성 식도염을 보이기도 한다.
치료 및 예후
상장간막동맥증후군의 치료는 우선 보존 치료로 시작하고 실패한 경우 수술 치료를 고려한다. 보존 치료는 전비경구 영양이나 비공장관을 통한 영양 공급에 따른 체중 증량이 중요하며 십이지장 또는 위의 감압을 위하여 비위관을 삽입하거나 증상 완화를 위하여 복와위 혹은 좌측와위 자세를 취한다[3]. 상장간막동맥증후군에서 과도하게 십이지장이 확장된 경우 감압 치료가 늦어졌을 때 십이지장의 무긴장을 초래하여 정상 기능 회복이 늦어질 수 있으므로 십이지장이 과도하게 확장되기 전에 조기에 감압 치료를 시행해야 한다[13]. 최근 전비경구 영양이나 경장영양이 발전하면서 상장간막동맥증후군의 외과 치료가 줄어들 것으로 예상되는데 1974년과 2006년에 발표된 두 유사한 소아 상장간막동맥증후군 코호트 연구에서 수술 치료의 필요성이 70%에서 14%로 감소하였다[33]. Lee 등[30]의 최근 10년간 상장간막동맥증후군 환자의 약 18%에서 보존 치료의 실패나 재발로 인해 외과 치료가 필요하다고 하였다. 그러나 보존 치료를 언제까지 해야 하는지에 대해서 잘 알려진 바 없다. 여러 연구에서 보존 치료에 의한 증상 완화가 2-12일까지 관찰되었고 치료 기간이 최장 169일까지로 보고되었다[25,33,44]. Lee 등[30]의 연구에서도 보존 치료에 완화를 보인 자들의 중앙 치료기간은 9일이었으며 최장 기간이 62일이었다.
외과 치료는 보존 치료가 실패하였을 때 시행하는 데 수술 방법은 위-공장문합술(gastrojejunostomy), 트리이쯔 인대박리술인 Strong 수술법, 십이지장-공장문합술(duodenojejunostomy) 등이 있다[44]. 위공장문합술은 위감압에는 효과가 있으나 완전히 십이지장의 폐색을 해결하지 못하고 오히려 십이지장의 팽대가 더욱 진행되어 증상을 유발할 수 있고 담즙역류, 수술 후 문합부 궤양, 맹관 증후군이 발생할 수 있는 단점이 있다[44]. Strong 수술법은 십이지장의 미골부 이동을 위하여 횡행, 상행 십이지장의 이동과 함께 트리이쯔 인대의 분할을 하는 수술법이다[45]. 이 수술은 장에 덜 침습적이고 빠르며 안전한 수술이라는 장점이 있으나 하췌십이지장동맥(inferior pancreaticoduodenal artery)의 해부학적 변이에 따라 시행할 수 없는 단점이 있어 실패율이 25%까지 보고되고 있다. 현재까지는 십이지장공장문합술은 장유착이 적고 성공률(80-100%)이 제일 높은 수술법으로 알려져 있다. 국내의 경우 1967년부터 2003년까지 외과 치료를 받은 상장간막동맥증후군 환자 중 92.5% (49/53)이 십이지장공장문합술을 받았고 그들 중 93.9%에서 수술 후 호전을 보였다.
최근 들어 위장관 수술에서 복강경 수술이 증가하고 있는데 복강경 수술의 장점은 시야가 좋고 최소침습으로 인한 창상부 합병증과 유착으로 인한 장폐색의 빈도가 적으며 미용문제뿐 아니라 조기퇴원으로 인한 비용절감 효과 등의 장점이 있어 각광받고 있다. 1995년에 Massoud [46]는 4명의 환자중 3명을 복강경하에 트리이쯔 인대의 분리 성공을 보고하였다. Gersin과 Heniford는 1998년 첫 복강경하 십이지장공장문합술의 성공을 발표하였다[47]. Munene 등[48]은 MEDLINE에서 검색된 상장간막동맥증후군의 복강경하 십이지장공장문합술을 시행했던 9개의 증례들을 모아 분석한 결과 평균재원일은 4.5일, 이환율은 7%, 사망률은 0%로 보고하여 100%의 성공률을 보였다고 보고하였다. 따라서 복강경하 십이지장공장문합술은 상장간막동맥증후군의 안전하고 효과적인 치료법으로 생각된다. 표 3에 상장간막동맥증후군의 수술적 치료법을 비교 분석하였다.
결 론
상장간막동맥증후군은 십이지장의 3부가 대동맥과 상장간막동맥에 의해 눌려서 십이지장 폐쇄 증상이 발생하는 드문 질환으로 증상 발현 양상은 급성 또는 만성으로 나타난다. 급성인 경우 오심, 구토, 복통, 복부 팽만, 담즙성 구토 등을 보여 외과적 복증(surgical abdomen)으로 오인할 수 있고 만성인 경우 오심, 반복 구토를 동반한 복통, 포만감, 식욕부진, 체중감소 등으로 기능성 위장관 질환과 유사하다. 이 질환의 진단은 상기 증상들과 함께 상장간막동맥증후군에 합당한 영상학적 소견이 모두 뒷받침해야 진단을 내릴 수 있다. 과거와는 달리 최근에는 CT가 가장 흔히 사용되는 영상학적 검사로 대동맥과 상장간막동맥 사이 각도는 22도 이하(대동맥과 상장간막동맥 사이 거리 8 mm 이하)면서 십이지장 근위부 확장 소견으로 관찰된다. 현재도 이 질환의 치료시작은 보존 치료이며 전비경구 영양이나 비공장관을 통한 영양 공급에 따른 체중 증량이 중요하다. 의학 수준이 향상되면서 최근에는 보존 치료의 성공률이 향상되었다. 하지만 내과 치료가 실패한 경우 외과 치료를 시행하는 데 현재 복강경하 십이지장공장문합술이 가장 성적이 우수하고 선호되는 수술법이다. 본 질환의 경우 빈도가 드물고 증상도 다양하여 진단이 어렵지만 임상에서 상장간막동맥증후군에 대한 의심을 갖는 것이 조기 진단과 적절한 치료의 열쇠가 되겠다.