P-ANCA 양성 항사구체기저막 항체 질환 1예
A Case of P-ANCA-Positive Anti-Glomerular Basement Membrane Antibody Disease
Article information
Abstract
항사구체기저막 항체 질환은 드문 자가면역성 질환으로 급속 진행성 사구체신염으로 흔히 발현된다. 많게는 40%의 환자에서 ANCA가 양성인데, 이렇게 항사구체기저막 항체와 ANCA가 모두 양성인 경우에는 대체로 예후가 좋지 않다. 저자들은 p-ANCA가 양성인 항사구체기저막 항체 질환으로 투석이 필요했던 59세 여자 환자에서 혈장분리교환술과 적극적인 면역억제 치료로 신기능의 회복을 보여 투석치료를 중지한 급속 진행성 사구체신염 1예를 경험하였기에 문헌고찰과 함께 보고한다.
Trans Abstract
Up to 40% of patients with anti-glomerular basement membrane (GBM) disease, which is a rare autoimmune disorder usually manifesting as rapidly progressive glomerulonephritis (RPGN), are positive for circulating anti-neutrophil cytoplasmic antibody (ANCA). Many previous reports showed poor outcomes in these “double-positive” patients. We report a patient with perinuclear (p)-ANCA positive anti-GBM disease who presented with RPGN and required hemodialysis. Plasmapheresis and steroid and cyclophosphamide therapy were initiated following renal biopsy and resulted in normalization of anti-GBM antibody and p-ANCA titers, recovery of renal function, and discontinuation of hemodialysis. This case suggests that aggressive immunosuppression with plasmapheresis in patients who are p-ANCA positive with anti-GBM disease should be considered, even in those with severe renal dysfunction. (Korean J Med 2012;83:807-812)
서 론
항사구체막 항체 질환은 항사구체기저막 항체에 의해 발생하는 매우 드문 자가면역성 사구체신염으로 유병률은 백만 명당 0.5-0.9에 불과하다[1]. 대부분 급속 진행성 사구체신염으로 나타나므로, 즉각적인 면역억제치료와 혈장분리교환술이 필요하다. 항사구체막 항체 질환 환자에서 많게는 40%의 환자에서 ANCA도 양성으로 나타나는데, 이처럼 두 가지 항체가 모두 양성인 급속 진행성 사구체신염 환자에서 진단 당시에 투석이 필요한 경우에는 예후가 나쁜 것으로 보고되어 있다[1,2].
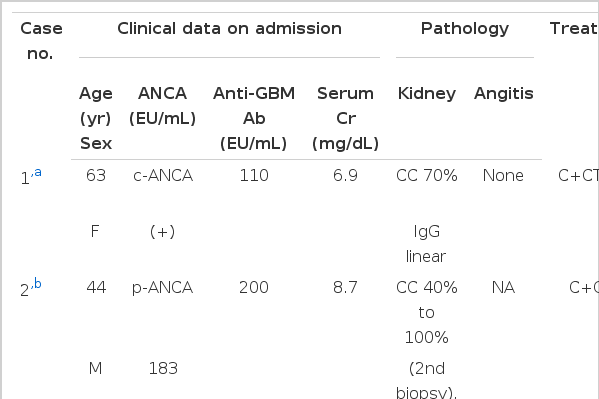
국내에서는 항사구체기저막 항체와 ANCA가 모두 양성인 급속 진행성 사구체신염이 지금까지 모두 2예가 보고되었는데, 한 예는 사망하였고 다른 한 예는 말기신부전으로 진행하였다(Table 1) [3,4]. 그런데 저자들은 항사구체기저막 항체와 p-ANCA가 양성인 급속 진행성 사구체신염 환자에서 입원 당시 혈청 크레아티닌이 7.1 mg/dL로 투석이 필요하였으나 혈장분리교환술과 면역억제치료로 신기능이 회복된 예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 여자, 59세
주 소: 오심, 구토 및 상복부 통증
현병력: 내원 10일 전부터 오심, 구토 및 상복부 통증 지속되어 소화기내과에 입원하였다가, 입원 후 검사에서 신기능 저하 소견이 보여 신장내과로 전과되었다.
가족력: 특이사항 없음.
과거력: 특이사항 없음(정기 건강 검진상 신기능 이상 소견없었음)
진찰 소견: 입원 당시의 활력징후는 혈압 159/96 mmHg, 맥박수 70회/분, 호흡수 20회/분, 체온은 36.5℃였다. 급성병색을 보였으나 의식은 명료하였다. 폐 및 심장 청진 소견에서 특이 소견은 없었고, 상복부에 압통이 있었다. 피부 발진등의 소견은 관찰되지 않았고, 하지에 함요부종은 없었다.
검사 소견: 입원 당시의 말초 혈액 검사에서는 혈색소 10.3 g/dL, 생화학 검사에서는 총 단백 7.39 g/L, 알부민 3.1 g/dL, 칼슘 9.3 mg/dL, 인 7.3 mg/dL, 요소질소 88.0 mg/dL, 크레아티닌 7.1 mg/dL였고, 고민감도 반응성 단백(hs-CRP)은 7.5 mg/dL로 증가되어 있었다. 소변검사에서는 요단백(2+), 적혈구 50-99/ HPF, 백혈구 1-4/HPF, 임의뇨에서 시행한 단백질 대 크레아티닌 비율은 2.57 (mg/mg)이었다. MDRD 공식으로 구한 사구체 여과율은 6.0 mL/min/1.73 m2였고 24시간 소변검사로 구한 크레아티닌 청소율은 4.5 mL/min이었다. 소디움 분획배설률(FENa)은 3.8%였다. 혈청검사에서 B형 간염 표면 항원, 항체 및 C형 간염 항체는 음성이었으며, 항핵항체는 약 양성, 항이중쇄 DNA항체는 음성이었다. 혈청 보체는 C3 147 mg/dL (참고치 90-180 mg/dL), C4 55 mg/dL (참고치 10-40 mg/dL)였다. 항사구체기저막 항체는 57 EU/mL(양성: 15 EU/mL 이상)이었고, ANCA는 항골수세포형과산화효소(anti-MPO) 항체가 강양성(1:320X), anti-PR3항체는 음성이었다. 면역 글로불린은 IgG 704.0 mg/dL (참고치 800- 2,000 mg/dL), IgA 124.0 mg/dL (참고치 70-470 mg/dL), IgM 80.0 mg/dL (참고치 40-350 mg/dL)였다. 흉부 X-선 검사에서는 특이소견이 없었으며, 복부 초음파검사에서는 신장 크기는 정상이었으나 신실질 에코 음영이 증가되어 있었다(Fig. 1).
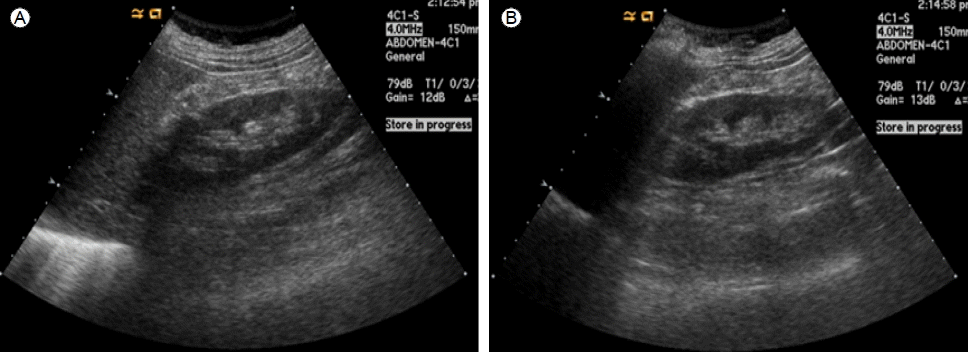
Renal sonogram shows that the kidneys have normal length, but increased renal parenchymal echogenicity.
치료 및 경과: 신기능의 급격한 악화를 설명할 만한 원인이 뚜렷하지 않아 급속 진행성 사구체신염을 의심하여 입원 3일째에 신장조직검사를 시행하였다. 광학현미경 검사에서 사구체 38개 중 35개에서 반월상이 보였고, 경한 신간질의 염증성 침윤과 부종을 동반한 혈관염의 소견이 관찰되었다. 면역형광현미경 검사에서는 사구체기저막을 따라 선상으로 IgG가 진하게 염색되었다(Fig. 2). 이에 항사구체기저막 항체 질환에 의한 급속 진행성 사구체신염으로 진단을 하고 입원 5일째부터 혈장분리교환술을 시작하여 입원 중 총 10회를 시행하였다. 입원 8일째부터 스테로이드 충격요법(methylprednisolone 1,000 mg/일, 3일)을 시작하였고, 이후 경구로 프레드니솔론(50 mg/일)을 투여하였다. 또한 스테로이드 충격요법과 함께 cyclophosphamide (0.5 g/BSA)을 정맥으로 주사하였다(Fig. 3). 한편, 입원 2일째부터 혈액투석을 시작하여 입원 16일까지 총 4회 투석을 시행하였다. 입원 11일째 시행한 혈액검사에서 항사구체기저막 항체는 < 5 EU/mL로 음성을 보였고, anti-MPO항체는 중등도 양성(1:80X), anti-PR3 항체는 음성이었다. 입원 기간 동안 간헐적으로 발열, 근육통 및 쇠약감 등의 전신증상을 호소하였고 면역억제 치료를 시작한 이후에 항문주위 및 입안에 미란이 발생하였으나 보존적 치료로 호전이 되어 제32병일째에 퇴원하였다. 입원 중에 폐출혈 증상은 없었으며, 퇴원 시의 검사에서 요소질소는 55.4 mg/dL, 크레아티닌은 4.9 mg/dL이었다. 퇴원 이후 경구로 프레드니솔론을 투여하면서 cyclophosphamide를 월 1회 정맥으로 주사하였고 투석치료는 시행하지 않았다. 2개월 후에 시행한 검사에서 요소질소 69.7 mg/dL, 크레아티닌 4.3 mg/dL으로 신기능은 안정적으로 유지되고 있었고, 항사구체기저막항체, anti-MPO항체 및 anti-PR3 항체는 모두 음성이었다. 이후 환자는 퇴원 3개월째에 혈청 요소질소는 65.7 mg/dL, 크레아티닌은 4.4 mg/dL로 신기능은 투석 없이 안정적으로 유지되었다.
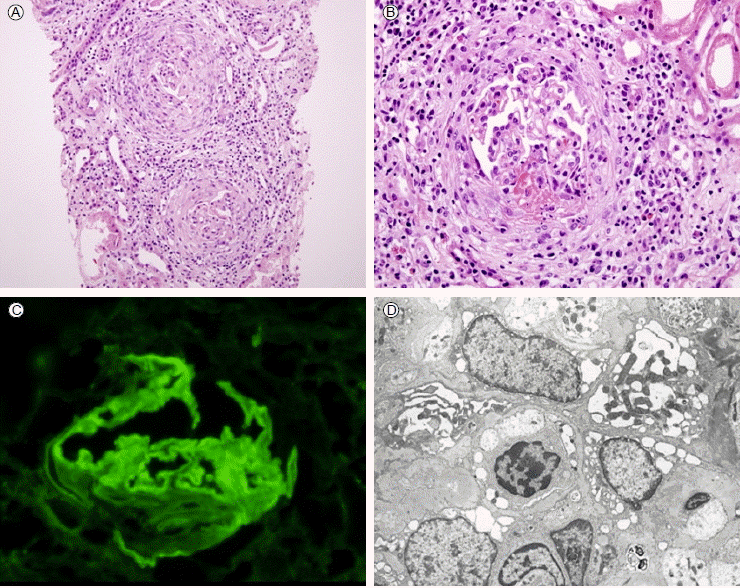
(A) Light microscopic examination [hematoxylin and eosin (H&E), × 100]. The crescents involved the glomeruli. (B) Light microscopic examination (H&E, × 400). The glomerulus shows segmental fibrinoid necrosis and formation of crescents with edema and leukocyte infiltration in the periglomerular interstitium. (C) Immunofluorescent IgG staining. The crescentic glomeruli have intense linear anti-IgG staining of the glomerular basement membrane. (D) Electron microscopic examination (× 10,000). The injured glomerular tufts show crescents mixed with cells.
고 찰
급속 진행성 사구체신염으로 발현된 항사구체기저막 항체 질환 환자의 10-38%는 ANCA도 동시에 양성을 나타낸다[2]. 그런데 이전 연구들에서 두 항체 양성인 급속 진행성 사구체신염 환자의 예후는 매우 다양하게 보고되었다. Bosch 등[5]은 항사구체기저막 항체와 p-ANCA가 모두 양성인 환자가 치료에 반응이 더 좋다고 하였다. 두 항체가 모두 양성인 29명의 환자를 대상으로 한 최근의 연구에서도 환자의 예후가 항사구체기저막 항체만 양성인 환자보다 더 좋았다[6]. 그 이유는 명확하지 않으나 ANCA가 항사구체기저막 항체를 낮추는 데 기여하는 것이 원인일 것으로 추측되었다. 그러나 이와는 반대로 이 두 항체가 모두 양성인 환자들의 예후가 나쁘다는 보고들도 많다. Levy 등[2]과 Lindic 등[7]은 항사구체 기저막항체와 ANCA 모두 양성인 환자에서 진단 당시의 혈청 크레아티닌 농도가 5.7 mg/dL을 넘은 경우 적극적인 면역억제치료나 혈장분리교환술을 시행하더라도 신기능이 회복되지 않아 1년 후 신생존율이 0%라고 보고하였다. 특히 투석이 필요했던 환자에서는 1년 후 환자 생존율과 신생존율이 각각 35%와 0%로 예후가 매우 좋지 않았다. 진단 당시에 투석이 필요했던 환자 외에도 처음 혈청 크레아티닌이 5.7-6.6 mg/dL 이상이거나, 반월상이 전체 사구체의 50-80% 이상에서 형성되어 있거나[1], 그리고 진단 당시에 핍뇨 혹은 무뇨인 경우[1]에도 예후가 좋지 않다.
한편, 사구체막의 α3(Ⅳ)NC1에 대한 자가항체의 특이도가 ANCA가 양성인 항사구체막 항체 질환의 예후에 관련이 있다는 보고도 있다. Levy 등[2]은 항사구체기저막 항체와 ANCA가 모두 양성인 환자들 중 α3(Ⅳ)NC1 이외의 다른 부분과 결합하는 항사구체막 항체를 가진 환자들의 신 예후가 더 좋다고 하였다. Hellmark 등[8]과 Yang 등[9]은 항사구체막 항체 질환에서 α3(IV)NC1에 대한 항체의 역가가 높은 환자의 경우 항사구체막 항체 질환에서 나쁜 예후를 갖는다고 하였다. 또한, Yang 등[10]은 항사구체기저막 항체 단독 양성인 경우 보다 두 항체 양성인 환자에서 α3(IV)NC1에 특이적인 항체의 역가가 더 낮다고 하였다. 이러한 소견은 두 항체 양성인 항사구체막 항체 질환의 다양한 예후가 α3(IV)NC1에 특이적인 항사구체기저막 항체의 역가와 일부 관련이 있음을 시사한다
이처럼 항사구체기저막 항체와 ANCA가 모두 양성인 급속 진행성 사구체 신염은 일반적으로 예후가 좋지는 않으나, 조기에 진단하여 스테로이드, cyclophosphamide 및 혈장분리 교환술의 병합치료를 시행하면 환자 생존율은 비교적 양호하다. 즉, 혈장교환술 및 적극적인 면역억제 치료를 하면 1년 후의 환자생존율은 57-100%를 보였다[7]. 그런데 치료 후의 신생존율은 진단 당시의 신기능과 밀접한 연관이 있어서 진단 당시의 혈청 크레아티닌 농도가 5.7 mg/dL 미만인 환자에서는 1년 후 신생존율이 71-100%인 반면, 혈청 크레아티닌 농도가 5.7 mg/dL 이상인 환자에서는 1년 후 신생존율이 0%였다[7]. 따라서 신생존율을 높이기 위해서는 신기능 악화가 진행되지 않은 조기에 진단하여 혈장분리교환술과 면역억제치료를 시행하는 것이 중요하다. Glassock [11]은 매일 4 L 혈장분리교환술을 2-4주간 지속하고, 2주 시행 후 항사구체기저막 항체치를 측정하여 재치료 여부를 결정하는 것이 좋다고 하였다. 면역억제요법은 항체 생성이 저절로 중단되는 시기까지 대개 6-12개월 지속하는 것이 권장된다. 그런데 일본 신장 학회에서는 항사구체막 항체 질환의 진료지침(2011년)에서 집중적인 병합치료의 적응증을 혈청 크레아티닌이 6.0 mg/dL 이내거나 또는 조직검사상 반월상 형성이 30-50% 미만인 경우로 제시하였다[12]. 그 이유는 이러한 집중치료가 패혈증이나 PCP 폐렴과 같은 심각한 합병증의 유발할 수 있을 뿐만 아니라[2] 진단 당시의 혈청 크레아티닌이 5.7-6.6 mg/dL 이상이거나 반월상이 전체 사구체의 50-80% 이상에서 형성되어 있는 경우에는 예후가 좋지 않은 것으로 알려져 있기 때문이다.
그러나 본 증례에서는 진단 당시에 혈청 크레아티닌이 7.1 mg/dL였고, 신장조직검사에서는 92%의 사구체에서 반월상이 보였으며, 진단 당시 투석이 필요하여 예후가 나쁠 것으로 예측이 되었으나, 환자는 치료에 반응하였고 지속적인 투석치료를 시행하지 않아도 될 정도로 신기능이 회복이 되었다. 예후가 나쁠 것으로 예측되는 인자를 가지고 있었음에도 불구하고 본 증례에서 신기능의 회복이 있었던 것은 신장 조직 검사에서 반월성 사구체신염을 확인 후 즉시 혈장분리교환술과 함께 적극적인 면역억제치료를 시행한 것과 항사구체막 항체의 역가가 비교적 낮았던 것이 중요한 요인이었을 것으로 생각된다. 또한 본 증례에서 항사구체기저막 항체의 표적항원의 특이도가 조사되지는 않았으나 p-ANCA의 존재와 α3(IV)NC1 이외의 다른 부분에 대한 항사구체기저막 항체를 가진 것이 환자의 예후에 좋은 영향을 미쳤을 가능성을 생각해 볼 수 있겠다. 본 증례와는 달리 국내에 보고된 2예는 모두 예후가 좋지 않았는데, 제47병일째 사망한 예는 스테로이드와 cyclophosphamide가 각각 제11병일과 제 14병일째, 혈장분리교환술은 제17병일째부터 시행이 되어 적극적인 치료가 늦었던 것이 나쁜 예후의 원인이었을 것으로 생각된다[3]. 또한 신기능이 회복되지 않아 지속적인 유지 혈액투석치료가 필요했던 2번째 증례에서는 스테로이드 및 cyclophosphamide 치료만 시행되고 혈장분리교환술은 하지 않은 것이 예후가 좋지 않았던 원인일 것으로 생각된다(Table 1) [4].
결론적으로, 본 증례는 항사구체기저막 항체와 ANCA가 양성인 급속 진행성 사구체신염에서 비록 신기능이 회복하기 어렵다고 예상되는 요인들이 있는 경우라도 조기에 적극적인 면역억제치료와 혈장분리교환술을 시행하면 효과적으로 치료될 수 있음을 보여주는 증례이다. 따라서 급속 진행성 사구체신염이 의심되는 환자에서는 조기에 항사구체기저막 항체와 함께 ANCA를 검사하고 신장조직검사를 시행하여 항사구체기저막 항체에 의한 반월형 사구체신염이 확인되면 조기에 혈장분리교환술과 적극적인 면역억제치료를 고려해야 할 것이다.