간동맥화학색전술 후 발생한 기종성 담낭염 및 담도 기종 1예
A Case of Emphysematous Cholecystitis and Pneumobilia after Transarterial Chemoembolization for Hepatocellular Carcinoma
Article information
Abstract
수술이 불가능하거나 수술 후 재발한 간세포암에 주로 시행되는 간동맥화학색전술은 시행 후 다양한 합병증이 발생 가능하고, 드물게 담낭염이 보고되고 있다. 하지만 기종성 담낭염과 더불어 담도 기종 발생이 보고된 적은 없다. 저자들은 간동맥화학색전술 후 기종성 담남염과 동반된 담도 기종의 발생을 경험하였고, 내시경적 치료만으로 호전된 증례를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
Transarterial chemoembolization (TACE) is reportedly a useful palliative treatment in patients with unresectable or recurred hepatocellular carcinoma. Post-TACE complications are common; however, acute cholecystitis after TACE is rare. We herein report a case of a 73-year-old woman who presented with emphysematous cholecystitis and pneumobilia following TACE. Computed tomography performed for evaluation of her tumor status before TACE incidentally showed gallbladder and common bile duct stones. After TACE, she complained of severe epigastric pain with a positive Murphy’s sign. Computed tomography showed emphysematous cholecystitis and pneumobilia. She was successfully treated with emergent biliary stone removal by endoscopic retrograde cholangiopancreatography. (Korean J Med 2012;83:764-770)
서 론
간동맥화학색전술(transarterial chemoembolization, TACE)은 수술이 불가능하거나 수술 후 재발한 간세포 암의 치료와 생명 연장을 위해 널리 이용되고 있다[1]. 간동맥화학색전술의 가장 흔한 합병증은 색전술 후 증후군(postembolization syndrome)으로 간동맥화학색전술 후 복통 및 발열, 오심과 구토와 같은 비특이적인 증상과 일시적인 간 기능의 변화를 보이며 대부분 일주일 이내에 회복된다. 그러나 일부에서는 급성 간부전, 신기능 저하, 간농양, 급성 담낭염, 담낭과 비장의 경색, 위궤양 및 급성 위 장관출혈, 담낭이나 비장의 경색 등의 심각한 합병증을 유발하기도 한다. 간동맥화학색전술 후 합병증의 하나인 기종성 담낭염은 담낭염의 일종으로 매우 드물게 발생 가능하며, 해외에서는 보고된 적이 있으나[2] 국내의 문헌 보고는 없는 실정이다. 또한 간동맥화학색전술후 담도 기종의 발생이나 기종성 담낭염과 동반된 담도 기종의 발생은 국내 및 해외에서 보고된 바 없다. 저자들은 원발성 간암 환자에서 간동맥화학색전술 후 발생한 기종성 담낭염 및 담도 기종의 증례를 경험하였기에 보고하는 바이다.
증 례
환 자: 73세 여자
주 소: 간동맥화학색전술
현병력: 환자는 B형 간염 바이러스 보균자로 내원 6년 전 정기검진 위해 시행한 복부 초음파 검사에서 이상 소견이 있어 복부전산화단층촬영을 시행하였다. 복부전산화단층촬영에서 간세포암이 의심되었으나 추가적인 병기 설정 검사 및 치료를 거부하며 2년여 동안 한약 복용 등 대체 요법을 시행하였다. 내원 3년 전 추적한 복부전산화단층촬영에서 간세포암이 진행된 소견을 보여 연고지 병원에서 전신 항암 치료를 시행하였으나, 항암치료에 반응이 없어 본원에 방문하였다. 내원 2년 6개월 전부터 6차례에 걸쳐 간동맥화학색 전술을 시행하였고 10개월 전 마지막으로 간동맥화학색전술을 시행하였다. 이후 추적관찰한 복부전산화단층촬영에서는 간세포 암의 재발 소견이 없었으나, 내원 1개월 전 시행한 전산화단층촬영에서 간의 6번 분절 및 꼬리엽에서 간세포암의 재발이 의심되어 간동맥화학색전술을 시행하기 위해 입원하였다.
간동맥화학색전술 전에 시행한 복부전산화단층촬영에서 간세포암의 재발소견 외에도 작은 여러 개의 무증상 담석 및 총담관 담석이 관찰되었다(Fig. 1). 문진상 특별한 증상이 없었고 신체검사에서도 특이 소견을 보이지 않아 예정된 간동맥화학색전술 시행 후 총담관 담석에 대한 내시경적 역행성 담도췌관 조영술을 시행하기로 하였다. 간동맥화학색전술을 시행하여 6번 분절에 종양의 염색이 확인되었고, 우측 간동맥에 항암제를 주입한 다음 종양 혈관에 리피오돌(Lipiodol) 및 젤폼(Gelfoam)으로 색전술을 시행하였다. 시술 직후에 오심 및 구토를 호소하였고, 시술 2일째부터 갑작스런 심와부 통증을 새로이 호소하였다.
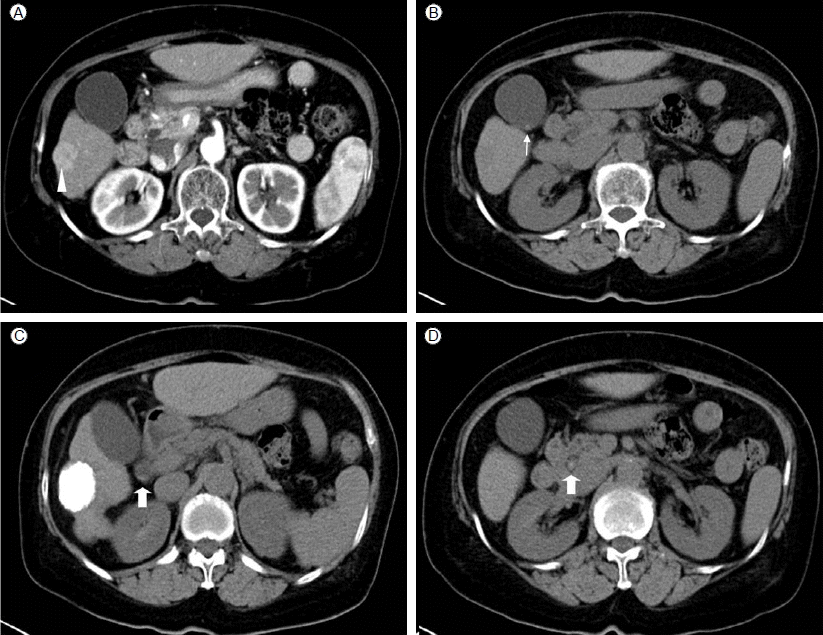
Computed tomography scan prior to transarterial chemoembolization. Hepatic mass with arterial phase enhancement (A, arrowhead), gallbladder stones (B, narrow arrow), and tiny common bile duct stones (C and D, wide arrow).
과거력: 고혈압(2년 전)
가족력: B형 간염 바이러스 보균자(모, 오빠)
진찰 소견: 입원 당시 활력 징후는 혈압 108/74 mmHg, 심박수 81회/min, 호흡수 18회/min, 체온 36.3℃였다. 당시 만성 병색을 보이기는 하였으나 공막에 황달 소견 없었고, 간비종대도 보이지 않았다. 시술 2일째 심와부 통증 호소 시환자의 활력 징후는 혈압 127/88 mmHg, 심박수 112회/min, 호흡수 20회/min, 체온 36.9℃였다. 의식은 명료하였고 급성 병색을 보였다. 결막은 창백하지 않았으나 공막에 황달 소견이 새로 보였다. 복부 촉진상 심와부에 압통이 있었으나 반발통은 없으며 Murphy’s sign은 양성이었다.
검사 소견: 입원 당시 일반 혈액 검사에서 백혈구 4,500/mm3, 혈색소 12.0 g/dL, 헤마토크리트 37.0%, 혈소판 123,000/mm3이었고, 혈액응고 검사에서 PT (international normalization ratio, INR) 1.05이었다. 생화학 검사에서는 혈중 요소질소 14 mg/dL, 크레아틴 0.60 mg/dL, 총 단백 6.5 g/dL 알부민 3.8 g/dL, 아스파르테이트아미노전이효소 61 IU/L, 알라닌 아미노전이효소 35 IU/L, 총 빌리루빈 1.0 mg/dL였다. Child-Turcotte-Pugh 점수는 5점으로 A등급에 해당되었다. 알파 태아단백 865.2 ng/mL로 4개월 전 29.7 ng/mL에 비해 증가한 상태였다.
간동맥화학색전술 2일째 복통이 발생했을 당시 시행한 일반 혈액 검사는 백혈구 14,800/mm3 (호중구 93.3%, 림프구 3.4%), 혈색소 13.0 g/dL, 헤마토크리트 38.8%, 혈소판 133,000/ mm3였고, 혈액응고 검사에서 PT (INR) 1.14였다. 생화학 검사에서 혈중 요소질소 19 mg/dL, 크레아틴 0.53 mg/dL, 총 단백 7.0 g/dL 알부민 4.1 g/dL, 아스파르테이트아미노전이효소 268 IU/L, 알라닌아미노전이효소 120 IU/L, 총 빌리루빈 2.4 mg/dL였고 CRP는 19.45 mg/dL였다.
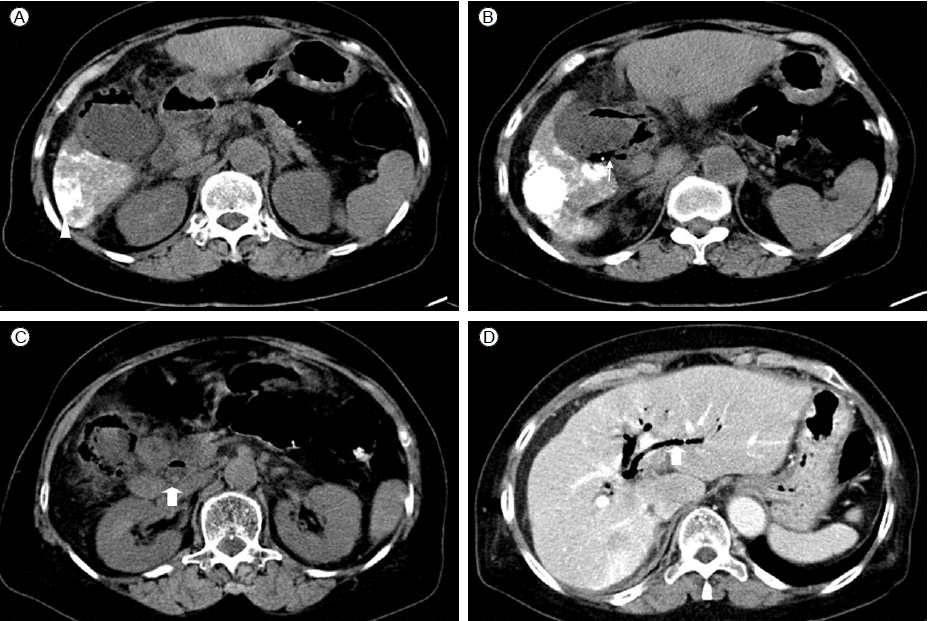
방사선 소견: 입원 당시 시행한 단순흉부촬영에서 간세포암의 전이 의심 소견은 없었다. 간동맥화학색전술 전에 시행한 복부전산화단층촬영에서 간세포암의 재발소견 외에도 담낭벽의 비후를 동반하지 않은 여러 개의 작은 담석 및 총담관 담석이 관찰되었다(Fig. 1). 간동맥화학색전술 시행 시 혈관조영술에서 시술 전에는 보이지 않던 담낭벽을 따라 리피오돌의 흡착이 관찰되었다(Fig 2). 간동맥화학색전술 시행 후 심와부 통증, 심와부 압통 및 Murphy’s sign 양성, 그리고 이전에 존재하였던 무증상 담석 및 총담관 담석, 간동맥화학색전술 후 보인 담낭벽의 리피오돌 흡착 등을 고려할 때, 급성 담낭염이 의심되어 복부전산화단층촬영 검사를 재시행하였다. 전산화단층촬영에서 간내 담도에 담도 기종이 관찰되었고, 간외 담도에도 담도 기종 및 담도의 확장이 관찰되었다. 또한 다발성 담석 및 총담관 담석 보이고 있었으며, 쓸개벽을 따라 공기가 관찰되고 있어 기종성 담낭염이 의심되었으나, 간동맥화학색전술 시 보인 담낭벽의 리피오돌 흡착은 보이지 않았다(Fig. 3). 또한 간의 6번 분절의 재발성 간암이 의심되는 부위 및 그 주위 간실질에 리피오돌의 흡착이 관찰되었으나, 꼬리엽에는 리피오돌의 흡착이 관찰되지 않았다.
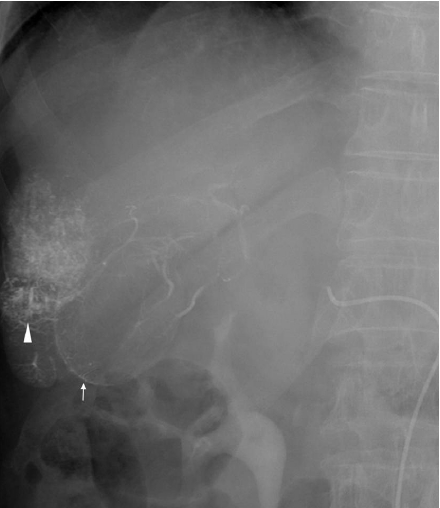
Transarterial chemoembolization. Lipiodolized hepatic mass (A, arrowhead) and lipiodolized linear gallbladder wall (B, narrow arrow).
Transarterial chemoembolization. Lipiodolized hepatic mass (A, arrowhead) and lipiodolized linear gallbladder wall (B, narrow arrow).
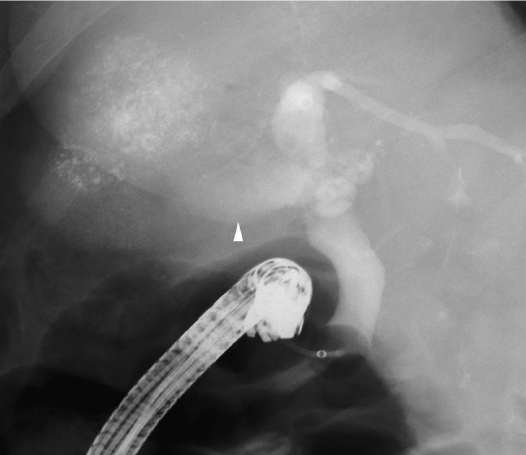
치료 및 임상경과: 복통을 동반한 급성 기종성 답낭염 및 담도 기종에 대해서 응급으로 내시경적 역행성 담도췌관 조영술을 시행하였고, 내시경적 조임근 절개술 시행 시 다수의 갈색석 및 다량의 찌꺼기가 배출되었다. 답즙 배액 시 고름이나 감염 소견은 뚜렷하지 않았다. 조영제의 누출은 관찰되지 않았고 담낭이 잘 조영되었으나 복부전산화단층촬영과 달리 담낭의 확장은 보이지 않았다(Fig. 4). 내시경적 역행성 담도췌관 조영술로 담도 배액이 이루어졌고, 담낭의 확장이 명확하지 않아 바로 추가적인 경피적 담낭 배액술은 시행하지 않기로 하였다. 다만 환자의 경과에 따라 추가적인 경피적 담낭 또는 담도 배액술을 고려하기로 하였다. 담석 및 총담관 담석이 있었기 때문에 담낭 절제술이 필요하다고 판단되었으나 간동맥화학색전술 후 간 기능이 완전히 호전되지 않은 상태(아스파르테이트아미노전이효소 268 IU/L, 알라닌 아미노전이효소 120 IU/L, 총 빌리루빈 2.4 mg/dL)로 전신마취로 인한 합병증의 발생 가능성을 고려하여 가능하면 환자의 간 기능이 회복된 후에 담낭절제술을 시행하기로 하였다. 혈액배양 검사상 동정된 균은 없었으나 경험적 항생제로 3세대 세팔로스포린 제제를 사용한 보존적 치료만으로 임상 경과의 호전을 보여 경피적 담낭 또는 담도 배액술 시행 없이 퇴원하였다. 3개월 뒤 환자는 이전에 간동맥화학색전술을 시행 받았던 병변 주위의 재발이 의심되며 담낭 담석으로 인한 합병증의 발생 가능성을 고려하여 오른쪽 바깥 분절 및 꼬리엽 절제술을 포함하여 담낭 절제술을 같이 시행 받았다.
Pre-enhanced computed tomography scan after transarterial chemoembolization. Lipiodolized hepatic mass (A, arrowhead), emphysematous cholecystitis with gallbladder stones (B, narrow arrow), pneumobilia with a common bile duct stone (C, wide arrow), and pneumobilia in the intrahepatic duct (D, wide arrow).
고 찰
간동맥화학색전술 후 발생하는 가장 흔한 합병증은 60-80%의 환자가 경험하는 색전술 후 증후군이다[3]. 이것은 다양한 정도의 우상복부 통증, 오심, 구토, 중등도의 장마비, 피로감, 열, 일시적인 간 기능 저하를 보이게 된다. 대개 증상은 3-4일 정도 지속되다가 자연 호전되며, 7-10일 이내에 완전히 회복되는 경과를 보인다. 색전술 후 증후군의 기전은 잘 알려져 있지는 않으나 종양의 괴사나 정상 간 실질의 손상 때문으로 생각된다[3].
간동맥화학색전술 후 발생하는 심각한 합병증에는 허혈성 합병증으로 생각되는 간농양, 급성 담낭염, 담도계 손상 및 정상 간조직의 허혈성 손상으로 인한 간부전, 그 밖에 위장관 출혈, 폐색전증 등이 알려져 있다[2]. 이런 심각한 합병증들은 환자의 사망과도 연결될 수 있는데, 발생 기전은 주로 간동맥 폐쇄을 통해 간암의 허혈성 괴사 및 2차 감염, 시술 중의 혈관 손상 또는 항암 치료 약물이 혈액 공급을 통해 타 장기에 영향을 미치기 때문인 것으로 알려져 있다[2]. 이중 간동맥화학색전술 후 발생한 급성 담낭염의 빈도는 문헌에 따라 0.3-10%까지 다양하나[4] 최근의 Liang 등[5]의 연구에 따르면 1,252명 중 4명(0.3%)의 빈도를 보였다. 또한 담도계 손상의 빈도는 0.5-2%이고, 피막하 담즙종(1.3%), 간내 담관 또는 총담관의 국소 협착(0.3%), 간내 담관의 광범위한 확장(0.2%) 등이 있다[6].
기종성 담낭염은 급성 담낭염의 일종으로 담낭벽이나 담낭 내강에 기체 형성을 특징으로 하는 드문 질환이다[2]. 임상양상은 일반적인 담낭염과 비슷하나 괴저와 천공의 발생율이 높아 치사율이 15%에 이르러, 조기 진단이 중요하며 응급 수술이나 경피적 담낭 배액술이 추천된다. 초기에는 담낭관의 폐쇄가 기종성 담낭염의 주된 발생 기전으로 생각되었으나 현재에는 다양한 원인에 의해서 담낭의 허혈 상태가 발생하고 여기에 가스 형성을 하는 세균에 의한 담낭의 감염으로 인해 발생하는 것으로 알려져 있다. 담낭의 허혈 상태를 일으킬 수 있는 인자로는 당뇨, 말초 혈관 질환, 담석의 담낭관 내 매복 등이 있으며 간동맥화학색전술[7], 내시경적역행성 췌담도 조영술, 심폐 소생술 후에도 보고된 바 있다. 또한 신우신염 후 2차적으로 생긴 기종성 담낭염[8]도 보고된 바 있어 기체 형성 세균의 혈행성 전이도 또 하나의 기전으로 고려될 수 있을 것으로 판단된다. 이 중 간동맥화학색 전술 후 발생한 기종성 담낭염은 1985년 Coldwell 등[7]에 의해 처음 보고되었고 이후에 몇 차례 보고된 바 있다. 국내에서는 1969년 기종성 담낭염이 처음 보고되었고[9], 이후 12예의 기종성 담낭염이 추가로 보고되었으나 간동맥화학색전술 후 발생한 기종성 담낭염에 대한 문헌 보고는 아직 없다. 그러므로 본 증례는 국내 최초 문헌 보고라는 점에서 의미를 부여할 수 있을 것으로 본다. 본 증례에서는 간동맥화학색전술 시행 이전에 이미 담석 및 총담관 담석이 존재하였기 때문에 기종성 담낭염이 간동맥화학색전술을 시행한 시점에서 우연히 발생하였을 가능성을 완전히 배제할 수는 없겠으나, 간동맥화학색전술 시행 시에 보였던 리피오돌의 담낭벽 흡착 소견을 고려하면, 담석보다는 간동맥화학색전술로 인한 허혈이 기종성 담낭염의 발생에 주요한 기전으로 작용하였을 가능성이 높다고 하겠다.
담도 기종은 담도계 내에 공기가 존재하는 상태로 주로 위장관과 담도 사이에 비정상적인 교통이 있을 때 연결부위를 통해 장 내 공기가 담도계로 들어가 발생한다[10]. 담도-장관루는 주로 담도계와 장관계의 수술적 문합 또는 담석에 의해서 발생하지만, 드물게 외상이나 소화성 궤양, 담도 주위 염증, 작은 담석의 자연 배출로 인하여 생긴 일과성 유두부 조임근 기능 부전 등에 의해서도 발생한다. 이외에도 기전이 명확하지 않지만 담도 기종과 동반된 급성 기종성 담낭염 3예가 보고된 적이 있다[10]. 이 중 1예는 담석이 동반되었고, 나머지 2예에서는 담석이 동반되지 않았다. 증례 고찰에서 담도 기종과 동반된 급성 기종성 담낭염의 존재는담낭관이 폐쇄되지 않았다는 것을 의미하며, 담낭의 일차적인 허혈로 인한 이차적인 변화로 담도 기종까지 동반하였을 가능성이 높다고 설명하였다. 본 증례에서는 내시경적 역행성 담도췌관 조영술에서 담도-장관루나 일과성 조임근 기능부전 등의 증거를 찾을 수 없었으며, 담즙의 감염 소견이 명확하지 않았다는 점에서 담관염으로 인해 이차적으로 담도 기종이 생겼을 가능성도 적다고 볼 수 있겠다. 그러므로 담도 기종 역시 총담관 담석과 관련한 담관염 때문에 발생하였다기 보다는 기종성 담낭염에 의해 2차적으로 발생하였다고 보는 것이 타당하겠다.
간동맥화학색전술 후 발생하는 담낭염은 대부분의 연구들[4,7]에서 보존적 치료를 하였지만, 괴저성 담낭염, 담낭천공, 기종성 담낭염, 리피오돌 담낭염과 같이 심각한 경우는 담낭 절제술이나 경피적 담낭 배액술 등이 필요하였다. 증례의 경우 기종성 담낭염의 높은 치사율을 고려할 때 응급 경피적 담낭 배액술이나 담낭절제술을 시행하는 것이 원칙이었겠으나, 동반된 총담도 담석이 있어 먼저 내시경적 역행성 담도췌관 조영술을 시행하였다. 응급 담낭 절제술은 간동맥화학색전술 후 간 기능 저하로 바로 전신 마취를 하기에는 적절하지 않아 되도록 간 기능 안정 후 수술하기로 하였고, 응급 내시경적 역행성 담도췌관 조영술을 통해 빠른 경피적 담낭 배액술에 준하는 적절한 배액이 이루어졌다고 판단하였기 때문에 추가적인 경피적 담낭 배액술은 시행하지 않았다. 또한 담즙의 염증 소견이 심하지 않았으며, 담낭의 팽창이 심하지 않아서 일단 항생제를 사용하며 경과를 관찰하였다. 하지만 동반되었던 담석 및 총담관 담석을 고려하여 2차적인 합병증 발생을 예방하기 위해 환자의 간 기능이 안정된 후에 담낭 절제술을 시행하였다. 대개의 간동맥화학색전술 후 발생하는 담낭염이 보존적 치료로 충분하다는 것이 기존에 이미 보고되었지만 본 증례에서는 비교적 심한 담낭염도 총담관 담석이 존재하여 내시경적 역행성 담도췌관 조영술로 빠르고 적절한 배액이 이루어진 경우에는 경피적 담낭 배액술이나 응급 담낭절제술을 하지 않고 치료하여 볼 수도 있다는 것을 보여 주었다. 그렇지만 본 증례에서는 전산화단층촬영 소견과 달리 내시경적 역행성 담도췌관 조영술에서 담낭의 확장이 동반되지 않았다는 점에서 차이를 보이고 있으므로 질병의 높은 치사율을 고려할 때, 응급 경피적 담낭 배액술 및 수술의 필요성에 대해서는 항상 고려를 하고 있어야 할 것이다.
본 증례는 무증상 담석 및 총담관 담석이 있는 환자에서 간동맥화학색전술 시행 후 기종성 담낭염 및 담도 기종이 발생한 경우이다. 이에 응급 내시경적 역행성 담도 췌관 조영술을 시행하여 여러 개의 담관석이 배출된 후 경과 호전을 보였다. 간동맥화학색전술 시행 후 발생한 기종성 담낭염 및 담도 기종은 매우 드물지만 높은 치사율을 보일 수 있으므로 간동맥화학색전술 후 발생할 있는 합병증으로 고려되어야 할 것이다. 그리고 제한된 경우에는 응급 경피적 배액술 또는 수술 이외에 내시경적 치료만으로도 경과가 호전될 수 있음을 보여준 증례로 이에 문헌고찰과 함께 보고하는 바이다.